
Orice trecere în revistă a punctelor tari din medicina anului 2020 se va deschide, invariabil și aproape copleșitor, cu vaccinurile anti-COVID. Și totuși, în aceste 12 luni, lumea știinţifică a primit și alte răspunsuri la eforturile depuse de-a lungul timpului.
La invitaţia lansată de Viaţa Medicală, profesorul Mircea Ivan, de la Universitatea din Indiana, Statele Unite, și cercetătorul Octavian Voiculescu, de la Universitatea din Cambridge, Marea Britanie, ne-au transmis alegerile lor pentru 2020. „Venirea pe scenă a RNA vaccines” a fost prima alegere a lui Mircea Ivan: „Strict vorbind, asta se bazează deocamdată numai pe trials, sper să fim la fel de pozitivi și peste 6 luni – 1 an”. Între timp, peste 6 milioane de persoane au primit, până la 4 ianuarie, vaccinul ARNm. Profesorul Ivan este unul dintre oamenii de știinţă care au contribuit la descoperirea mecanismelor celulare de adaptare la disponibilitatea oxigenului, descoperire care a fost recompensată în 2019 cu Premiul Nobel pentru Fiziologie sau Medicină. Cercetarea sa a fost una dintre cele cinci care au fost recunoscute de comitetul Nobel drept definitorii pentru cercetarea premiată.
Și Octavian Voiculescu a menţionat ca primă alegere „vaccinurile anti-coronavirus, atât cele ARN – după eforturi de 30 de ani, (...) nu sunt așa de noi precum în percepţia publică –, cât și cele adeno-virale”. Vaccinurile bazate pe vectori virali au fost precedate de rVSV Zebov, pe aceeași tehnică, vaccin aprobat de FDA la 19 decembrie 2019 împotriva Ebola.
1. „Succesul predicţiei structurii 3D a proteinelor, cu ajutorul supercomputerului DeepMind. Implicaţiile vor fi enorme dacă devine metodă aplicabilă la orice proteină, întrucât ar putea accelera extrem de mult designul medicamentelor”.
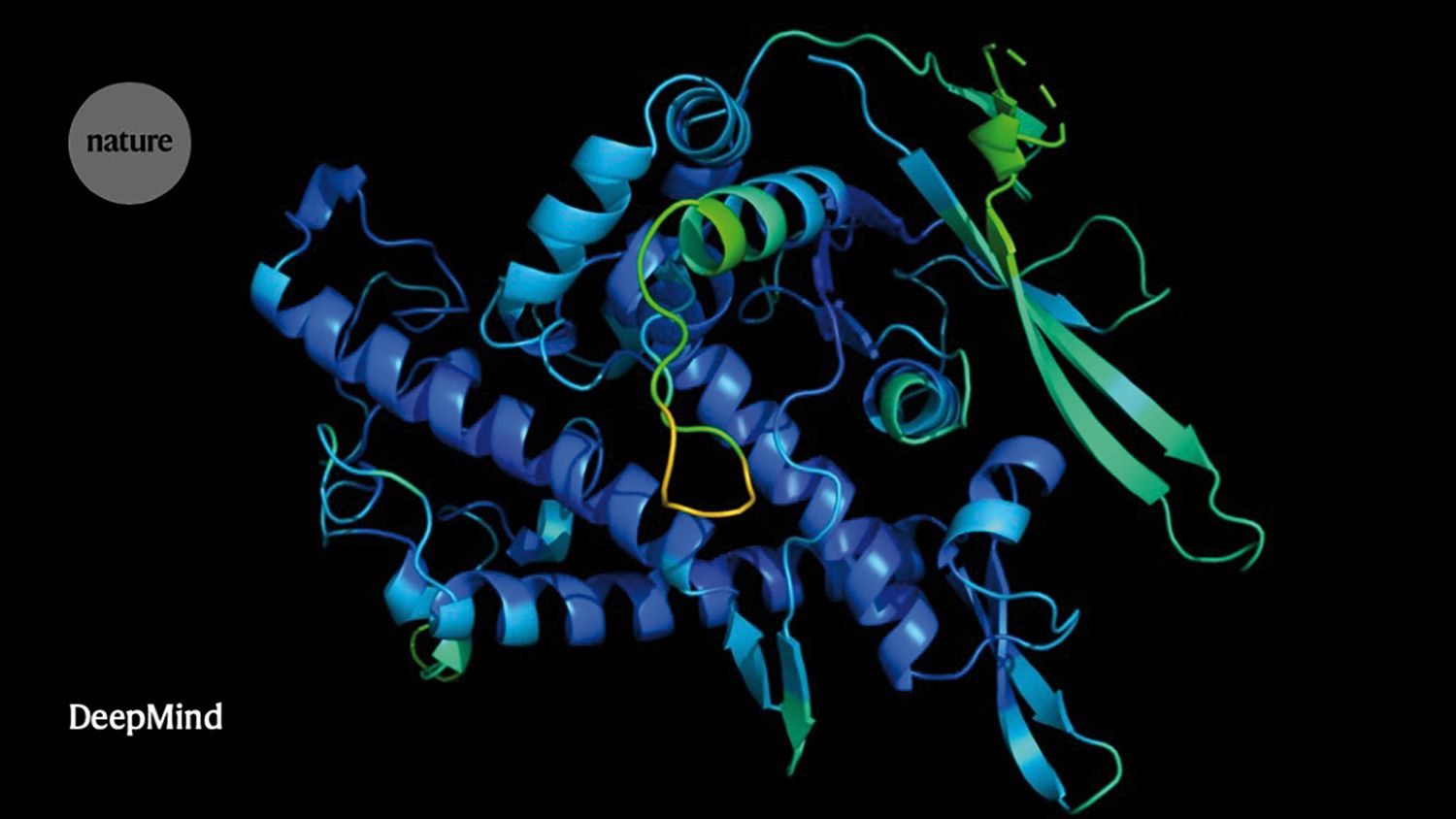
DeepMind este o companie britanică de inteligenţă artificială fondată în 2010 și cumpărată de Google în 2014. Se bazează pe o echipă interdisciplinară din care nu lipsesc cercetători în neuroștiinţe, ingineri, matematicieni, IT-ști. La sfârșitul lui noiembrie, DeepMind a oferit lumii știinţifice programul AlphaFold, care le permite cercetătorilor să prezică cu acurateţe structura 3D a proteinelor pe baza aminoacizilor din care sunt formate. Programul a câștigat detașat competiţia CASP (Critical Assessment of Structure Prediction) de anul acesta, în care mai multe echipe au estimat structura unei proteine pe baza fragmentelor pe care le-au primit de la juriu, estimarea fiind comparată ulterior cu structura proteinei obţinută prin metode experimentale. „[Această descoperire] schimbă jocul”, spunea într-un articol din Nature biologul Andrei Lupaș, de origine română, care lucrează la Institutul Max Planck din Tübingen, Germania, unul dintre cei care au evaluat performanţa echipelor înscrise în concurs.
Proteinele, cărămizi ale structurilor vii, sunt responsabile pentru majoritatea proceselor din celulă. Forma proteinelor le determină acestora funcţia și rolul, iar felul în care o proteină se pliază depinde numai de regulile fizicii. Deocamdată, performanţa AlphaFold necesită îmbunătăţiri în ceea ce privește structurile complexe, formate din mai multe proteine. Pentru lumea știinţifică, descoperirea înseamnă mai multe răspunsuri primite într-un timp mult mai scurt și pe baza unor date mai puţine decât le sunt necesare metodelor experimentale. Modelul de inteligenţă artificială va permite și clarificarea funcţiilor a mii de proteine încă necunoscute din genomul uman și a variaţiilor genice care duc la apariţia de boli, a estimat Janet Thornton, specialist în biologie structurală la Laboratorul de Biologie moleculară din cadrul Institutului European de Bioinformatică din Hinxton, Marea Britanie.
2. „Studiile pe brain assembloids ale lui Sergiu Pașca de la Stanford, următorul pas spre înţelegerea creierului uman”.
Echipa lui Sergiu Pașca, profesor asociat de psihiatrie și știinţe comportamentale la Stanford, a reușit să recreeze în placă Petri circuitul cortex cerebral–măduva spinării–mușchi striat, pe baza a trei componente. Acestea, dispuse alături, dar nu lipite una de alta, au fuzionat în așa-numitul asembloid. Studiul publicat în revista Cell la 16 decembrie este continuarea unei serii de cercetări pe tema funcţionării creierului.
Asembloid în urma fuzionării celor trei componente. Sursa: med.stanford.edu
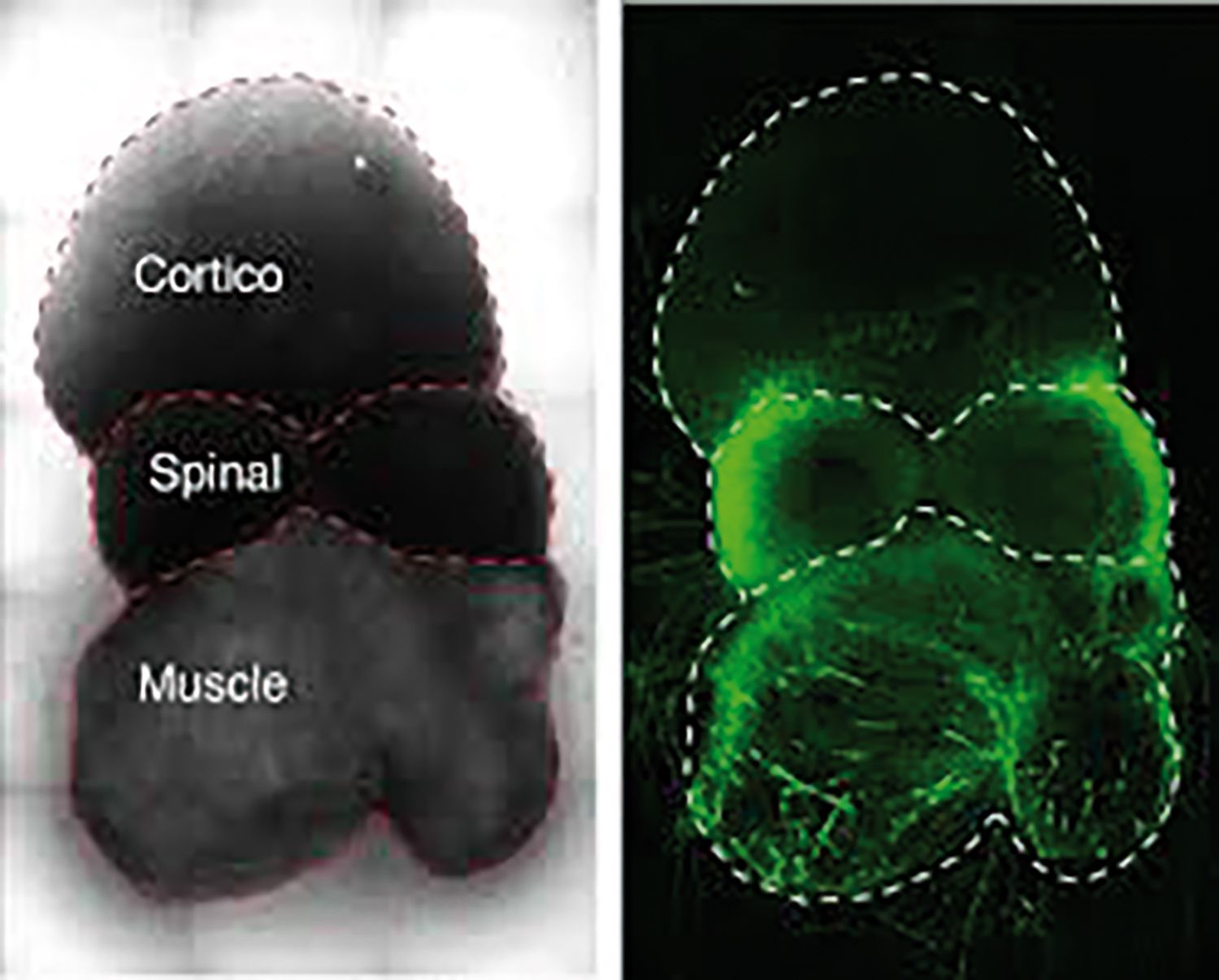
Plecând de la celule stem pluripotente induse, prelevate de la om de la cele trei etaje-cheie pentru mișcarea voluntară, echipa sa a creat așa-numiţii sferoizi, structuri ce mimează arhitectura și funcţia organului originar. Sferoidul de tip cerebral a fost plasat aproape de cel spinal și de cel tip mușchi striat, componenta spinală fiind plasată la mijlocul acestui ansamblu. Neuronii componentelor vecine s-au conectat între ei, iar stimularea sferoidului cerebral a generat contracţie la nivelul componentei motorii. Asembloizii au rămas funcţionali pentru zece săptămâni.
Descoperirea aduce speranţă în domeniul bolilor neuromusculare. „Scleroza laterală amiotrofică a fost vindecată de zeci de ori la rozătoare, dar niciunul dintre aceste tratamente nu a putut fi translatat eficient la om. Dar acum putem folosi celulele pacienţilor pentru a genera modele de lucru personalizate care ne vor ajuta să studiem aceste boli în laborator”, declara Sergiu Pașca pentru publicaţia online a Universităţii Stanford. Într-un alt studiu, publicat la 3 decembrie, echipa sa a obţinut fuziunea sferoidului cortical cu cel de tip ganglion striat, implicat în senzaţia de plăcere și în comportamentele bazate pe motivaţie.
1. „A fost un an extraordinar pentru terapii genice, cum ar fi cele bazate pe virusuri adeno-asociate (AAV). Au primit aprobare și sunt deja disponibile – de exemplu, prin NHS – pentru tratamentul retinopatiei pigmentare și altor afecţiuni oftalmologice”.
Descoperirile în terapia genică oculară au dus la un nou standard de îngrijire pentru pacienţii cu distrofie retiniană ereditară. „Ochiul este o ţintă atractivă pentru terapiile in vivo. Tratamentul poate fi administrat local, iar inflamaţia poate fi de mică amploare, deoarece ochiul este un organ privilegiat din punct de vedere imunologic”, spune dr. Kimberley Stepien, profesor asociat la Universitatea din Wisconsin, Madison.
De exemplu, voretigene neparvovec este aprobat din 2017 de FDA pentru tratamentul persoanelor cu distrofie retiniană ereditară, determinată de mutaţii RPE65 bialelice confirmate, și care au un număr suficient de celule retiniene viabile. Medicamentul folosește un vector viral adeno-asociat pentru a transporta o copie funcţională a genei RPE65 în celulele epiteliului pigmentar retinian. Se injectează subretinian, la cel puţin 2 mm distanţă de centrul foveei.
Mecanism de acţiune a terapiei genice retiniene. Sursa: luxturnachp.com
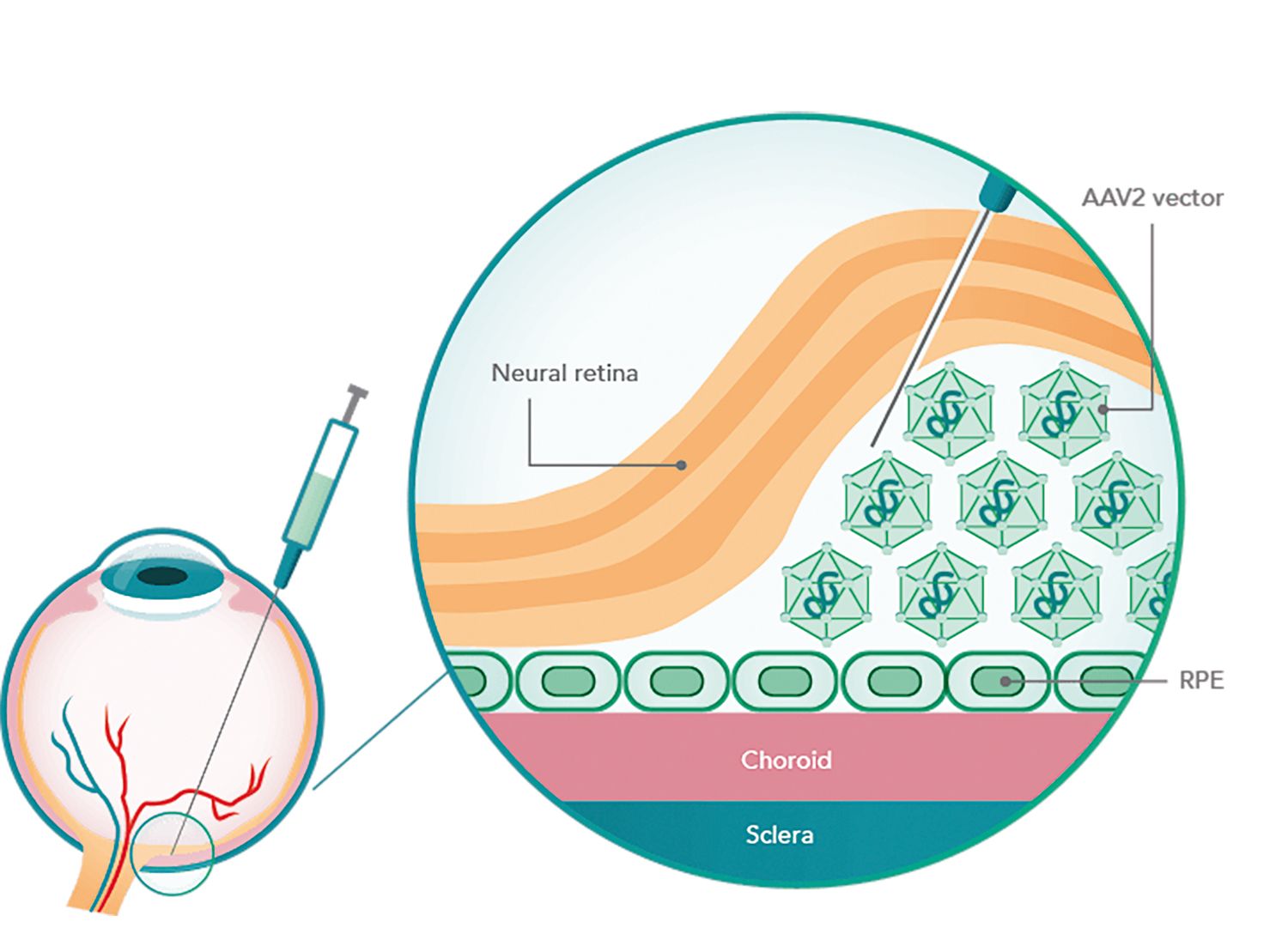
Tratamentele pe bază de vectori virali adeno-asociaţi au rezultate promiţătoare în tratarea unor boli oftalmologice considerate până acum incurabile și care duceau la pierderea graduală a vederii: retinopatia pigmentară X-linkată, amauroza congenitală Leber – pentru care NHS decontează acum tratamentul –, choroideremia, acromatopsia asociată mutaţiilor CNGA3 and CNGB3.
2. „Implanturile cerebrale: cel mai spectaculos este cel care permite restabilirea funcţiei senzoriale”.
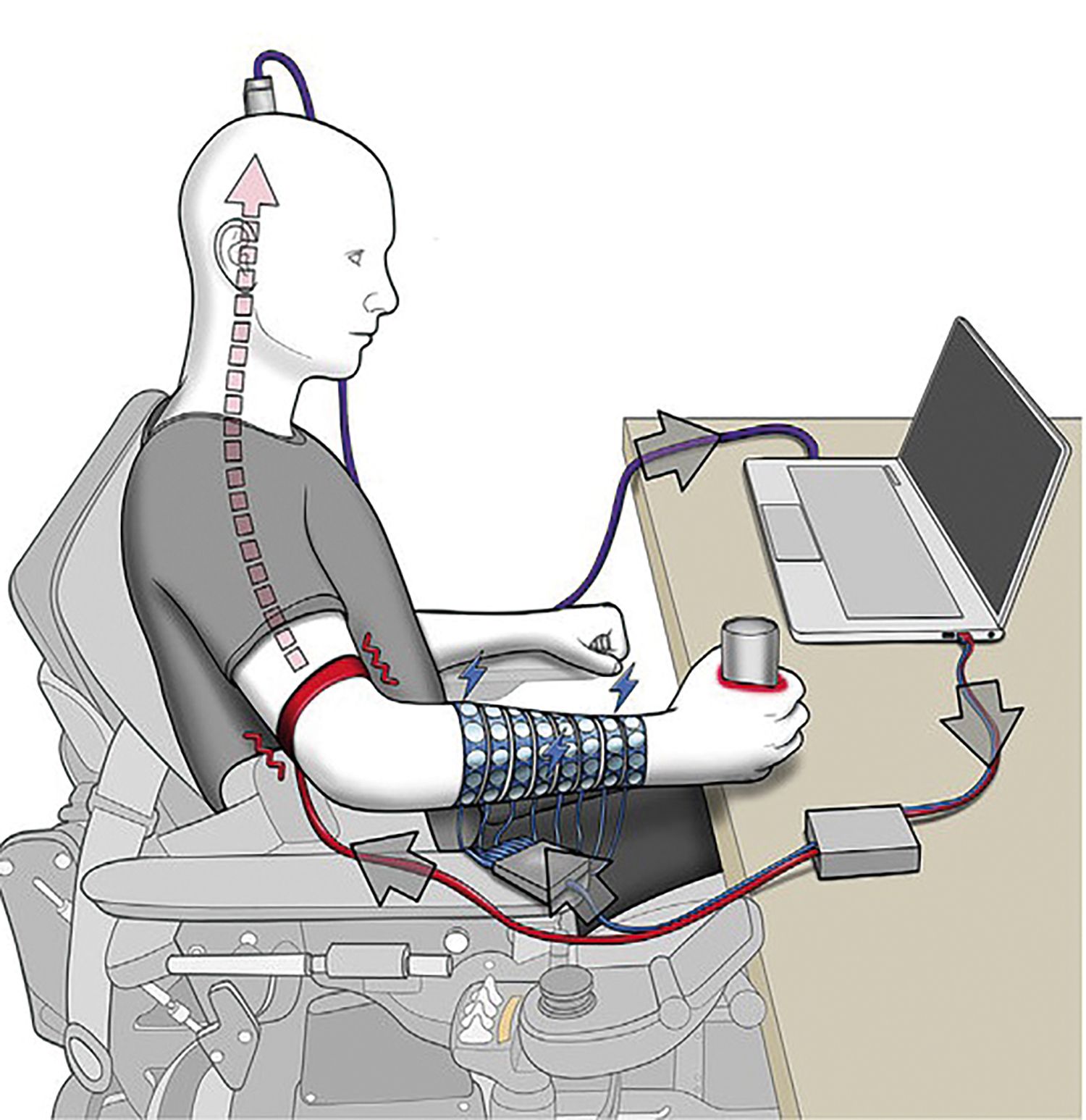
Senzaţia tactilă reprezintă o componentă importantă a funcţiei motorii. Un pacient care a suferit o leziune medulară completă ar putea, prin intermediul unei interfeţe creier-computer, să obţină restabilirea funcţiei motorii și a simţului tactil. Rezultatele obţinute de o echipă de cercetători din SUA (Patrick D. Ganzer, Samuel C. Colachis, Michael A. Schwemmer) au arătat că prin stimularea tegumentului antebraţului, informaţia este transmisă la nivelul cortexului de interfaţa creier-computer, este decodificată de cortex și transformată în senzaţie conștientizată, acest lucru amplificând și răspunsul motor la nivelul mușchilor din teritoriul respectiv.
Circuit senzorimotor realizat cu ajutorul interfeţei creier-computer. Sursa: cell.com
În domeniul neurologiei, dr. Gabriela Mihăilescu, medic neurolog la Spitalul Colentina, a ales ca pași siguri în 2020 tratamentele care au îmbogăţit portofoliul terapeutic pentru scleroza multiplă. Astfel, au devenit disponibile la nivel internaţional Ofatumumab (anticorp monoclonal uman antiCD20 din membrana limfocitelor B) și Ozanimod (imunomodulator indicat pentru formele recurent remisive ale sclerozei multiple). De asemenea, a fost aprobată scurtarea timpului de administrare a Ocrelizumab. Studiul ENSEMBLE PLUS a demonstrat că medicamentul administrat în decurs de două ore produce reacţii adverse comparabile ca în administrarea într-un timp mai îndelungat, de 3-5 ore, cum prevedea protocolul până acum.
În România, după cum ne spune dr. Gabriela Mihăilescu, „vor intra în portofoliul Programului Naţional de tratament al sclerozei multiple și Dimetilfumarat, Cladribina și Fingolimod, pentru formele de scleroză multiplă recurent remisive. De asemenea, sperăm ca Ocrelizumab, care era aprobat pentru același tip de scleroză multiplă, să poată fi utilizat ca unic tratament pentru forma primar progresivă”.
Citește și: Ghiduri, medicamente și device-uri noi în cardiologie
Surse:
https://www.nejm.org/doi/full/10.1056/NEJMoa2034577
https://www.nature.com/articles/nrd.2017.243
https://www.gavi.org/vaccineswork/there-are-four-types-covid-19-vaccines-heres-how-they-work
https://www.nature.com/articles/d41586-020-03348-4
https://med.stanford.edu/news/all-news/2020/12/scientists-assemble-human-nerve-circuit-driving-muscle-movement.html
https://www.cell.com/cell/fulltext/S0092-8674(20)31534-8
https://www.england.nhs.uk/2020/02/first-patients-begin-gene-therapy-treatment-for-blindness/
https://www.ophthalmologytimes.com/view/ocular-gene-therapy-offers-hope-for-inherited-retinal-disease
https://pubmed.ncbi.nlm.nih.gov/32149547/
https://www.cell.com/cell/fulltext/S0092-8674(20)30347-0
https://www.researchgate.net/publication/340876559_Restoring_the_Sense_of_Touch_Using_a_Sensorimotor_Demultiplexing_Neural_Interface
https://www.empr.com/home/news/ocrevus-ocrelizumab-bla-approved-relapsing-primary-progressive-multiple-sclerosis-infusion-time/
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe