Visul de aur al specialiștilor în radioterapie este de a eradica tumora, indiferent de profunzimea ei, fără efecte secundare imediate sau la distanţă și, implicit, fără afectarea ţesuturilor sănătoase. Descoperirile recente ne aduc cu un pas mai aproape de acest deziderat.
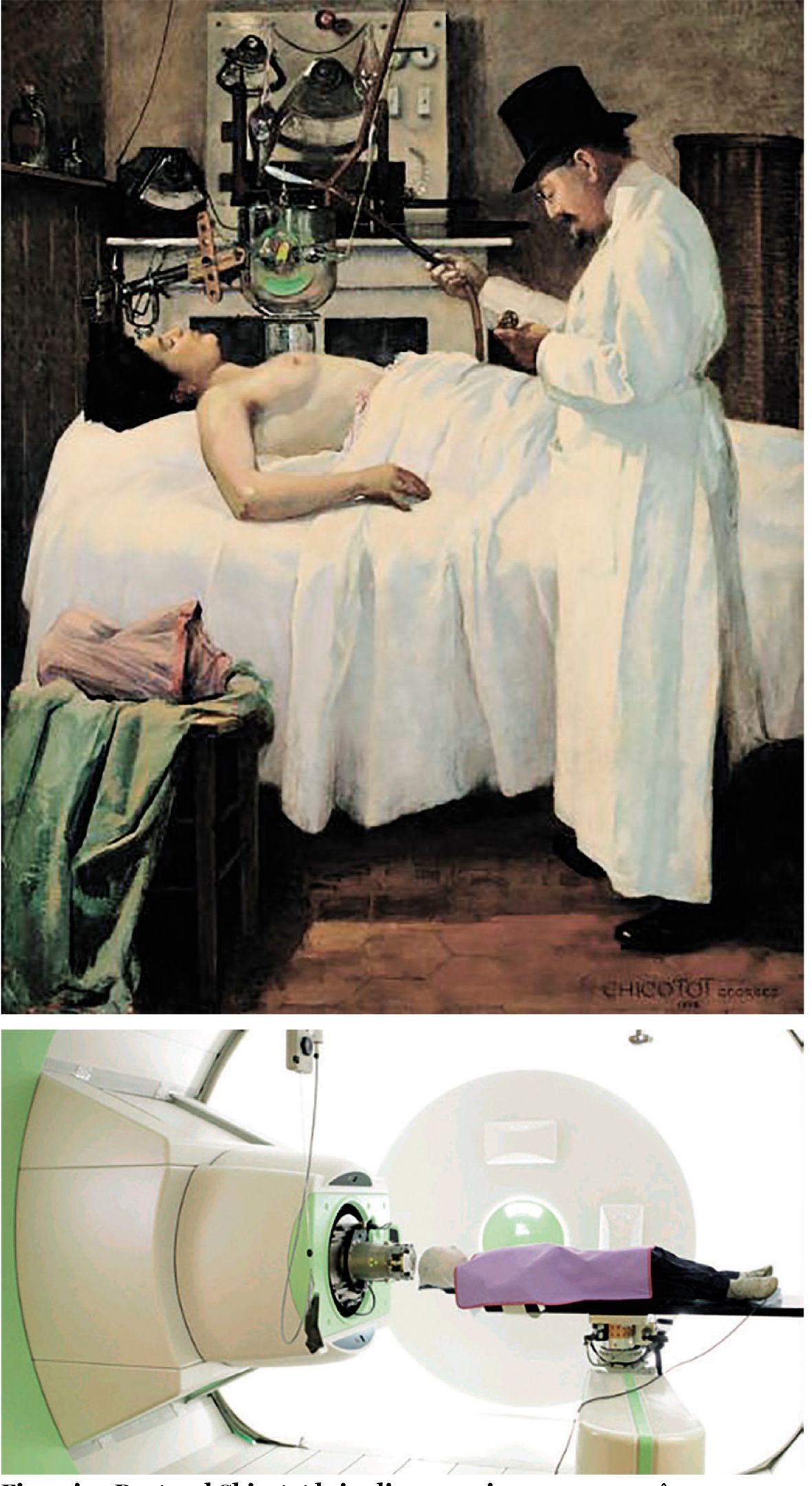
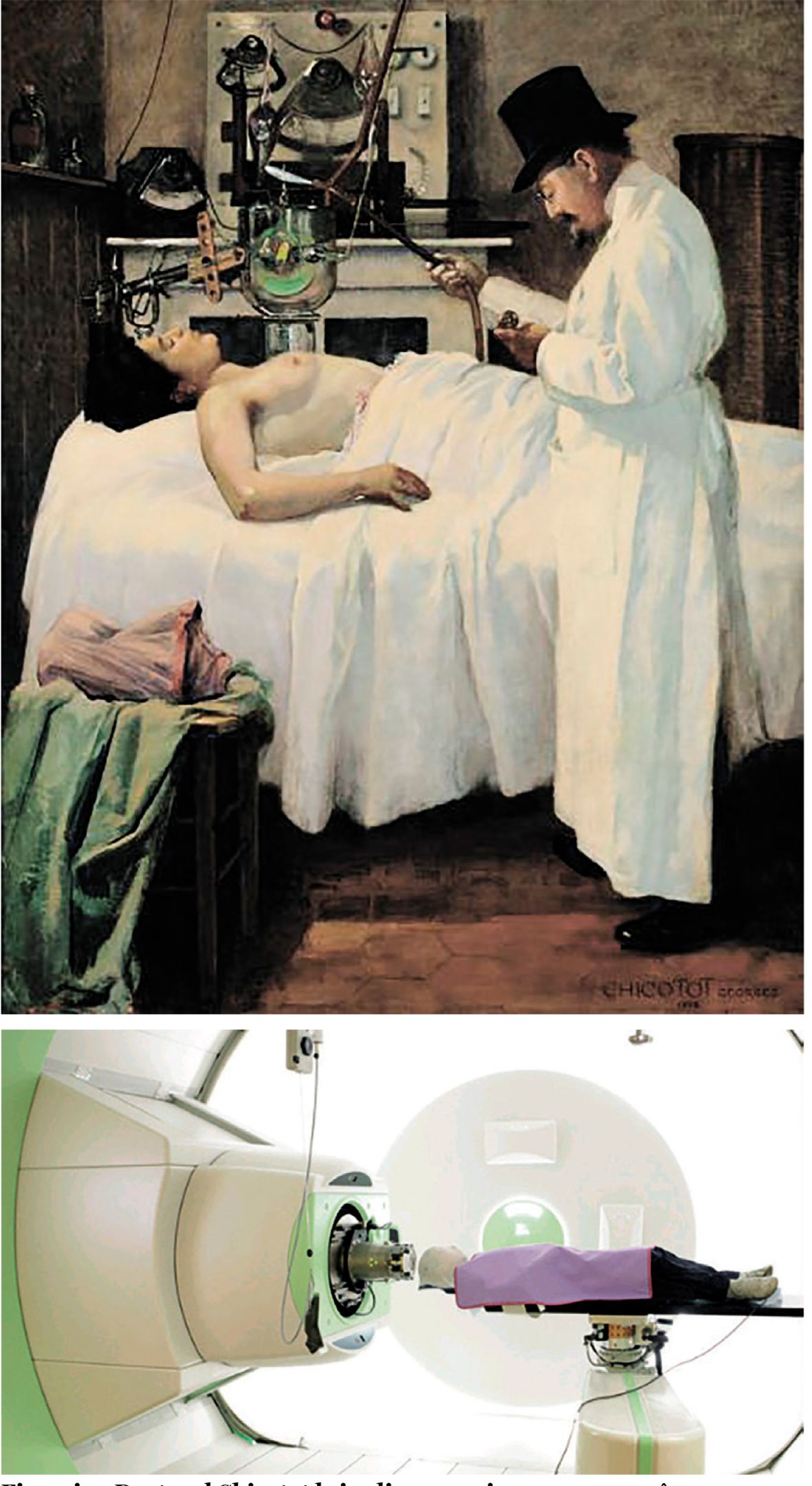
Descoperirea făcută de W. K. Roentgen, în 1895, a razelor care-i poartă numele, descoperire răsplătită cu primul Premiu Nobel pentru Fizică, în anul 1901, a fost urmată imediat și de aplicarea acestor radiaţii în tratamentul cancerului. Este un drum lung de la pictura doctorului Georges Chicotot din Paris, care a imortalizat iradierea realizată de el asupra unei paciente cu cancer mamar în anul 1907, până la iradierea cu protoni (fig. 1 și 2).
Utilizarea în radioterapie a diferitelor radiaţii a fost bazată pe caracteristicile fizice ale diferitelor surse de iradiere, și anume pe modul în care cedează energia în corpul uman și pe efectele biologice pe care le produc la nivelul ţesuturilor normale și tumorale.
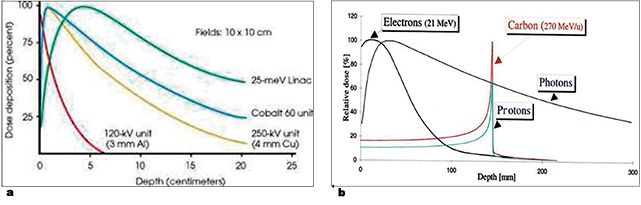
Acţiunea radiaţiilor ionizante depinde și de profunzimea în ţesutul corpului uman la care are loc cedarea lor maximă de energie, proporţională cu efectul biologic maxim. În fig. 3a sunt reprezentate curbele prezenţei în profunzime a radiaţiilor provenind din primele aparate utilizate în radioterapia externă, și anume sursele de radiaţii Roentgen, cu energii în domeniul kV (Dermopanul și Chaoul), comparativ cu Co60 și cu radiaţiile X ale acceleratorilor liniari, în domeniul energiilor de peste 6 MeV.
Ca urmare a efectelor secundare nedorite produse la nivelul tegumentelor de sursele de iradiere cu energii de până la 1 MeV, au fost realizate aparate de iradiere ce produceau radiaţii de energie mai mare, de ordinul 4/6/10 MeV, ce aveau randament în profunzimea corpului, astfel că efectele secundare la nivelul tegumentului erau mult reduse. În ultimii ani apar aceste noi surse de iradiere de înaltă energie (ioni grei și protoni), cu caracteristici fizice care permit aplicarea unei radioterapii ce asigură maximă protecţie ţesuturilor normale din jurul tumorilor aflate în profunzimea corpului și oferă posibilitatea aplicării unor doze mari la nivelul tumorii, astfel încât controlul tumoral și vindecarea să nu fie însoţite de efecte secundare cu relevanţă clinică (fig. 3a și 3b).
Progresele realizate în radioterapie în ultimele decenii și în special în ultimii ani au fost posibile și datorită progreselor realizate în diagnosticul tumorilor cu procedee imagistice precum tomografia computerizată, rezonanţa magnetică și PET/CT cu F18 marcat și cu Ga 68. De asemenea, un rol important l-au avut introducerea noţiunii de volum-ţintă în radioterapie și definirea organelor cu risc crescut pentru apariţia efectelor secundare, de către grupul condus de profesorii W. Bohndorf și E. Richter de la Universitatea din Wuerzburg, în anul 1986, precum și apariţia tehnicilor de iradiere cu iradiere conformaţională, la aceeași universitate, de către grupul condus de profesorii J. Richter și K. Bratengeier. Ulterior a fost posibilă și apariţia radioterapiei cu modularea intensităţii IMRT (Intensity-modulated radiotherapy) de tipul VMAT (Volumetric Arc Therapy), RapidArc sau Tomoterapia. Toate aceste progrese au permis apariţia și implementarea în clinică a unor procedee de iradiere ce permit aplicarea unor doze totale mari doar la nivelul ţesutului tumoral, deci un control tumoral cu efecte secundare mai reduse la nivelul ţesuturilor normale din jurul tumorilor iradiate.
Tratamentul tumorilor maligne la copii cu ajutorul radioterapiei este azi o procedură standard în oncopediatrie. Este recunoscută cerinţa pentru o radioterapie mai ţintită și pentru o protecţie mai mare a structurilor funcţionale în cazul pacienţilor de vârstă mică, urmare a sensibilităţii structurilor normale la radioterapie, a consecinţelor în timp pe care le au efectele secundare ale tratamentului asupra ţesuturilor normale, precum și din cauza inducerii de tumori secundare radioterapiei aplicate. Radioterapia cu protoni face posibilă atingerea acestor ţinte, și anume controlul tumoral maximal, efecte secundare reduse și scăderea incidenţei tumorilor radioinduse.
În rutina clinică a fost introdusă utilizarea diferitelor tehnici de iradiere, precum fracţionarea standard (doze zilnice de 2 Gy), hipofracţionarea – cu doze <2 Gy, de două ori pe zi, la un interval de cel puţin șase ore între proceduri – sau hiperfracţionarea – cu doze >2 Gy (3-6 Gy). Toate aceste proceduri au încercat să îmbunătăţească efectul iradierii la nivelul tumorii, dar nu au reușit să reducă satisfăcător și efectele secundare, care devin factorul limitant al aplicării unor doze totale mai mari.
Grupul condus de profesorul Vincent Favaudon de la Institutul Curie din Paris a publicat rezultatul unor experimente realizate pe animale de laborator. Mai exact, a aplicat iradieri cu doze mult crescute, dar în fracţiuni de timp mult mai reduse faţă de cele folosite în radioterapia clinică. Astfel, a aplicat doze de ordinul 10-30 Gy, în timpi de ordinul milisecundelor. În clinică, iradierea convenţională (CDR) constă în aplicarea de iradieri zilnice, cu fracţiuni de 2 Gy, timp de 1-2 minute, în timp ce în experimentele doctorului Favoudon, doza ultraînaltă, de până la 30 Gy, era aplicată în milisecunde. Aceasta este iradierea de tip „FLASH”. Studiul privind efectele secundare induse în ţesuturile sănătoase, realizat cu ajutorul examinărilor histologice, a permis observaţia că efectele secundare produse de acest tip de iradiere la nivelul ţesuturilor normale sunt mai puţin semnificative decât cele induse atunci când iradierea are loc în fracţionare standard și într-un timp mai lung.
În cazul iradierii tumorilor pulmonare, radioterapia „FLASH” permite eradicarea tumorii, dar fără să producă efecte secundare, ca pneumonita radică, ce se transformă în timp în fibroză pulmonară. La nivel tisular, fibroblastul nu este stimulat în urma iradierii „FLASH”, asa cum este stimulat în cazul iradierii standard. Iradierea „FLASH” a protejat și efectele secundare la nivelul celulelor epiteliale, precum și la nivelul mușchilor netezi.
În fig. 4 este redată schematic complexitatea ţesutului tumoral și a ţesutului normal înconjurător. Acţiunea radiaţiei aplicate la nivelul tumorii și a ţesutului normal peritumoral activează multiple fenomene care duc în final la distrugerea tumorală.
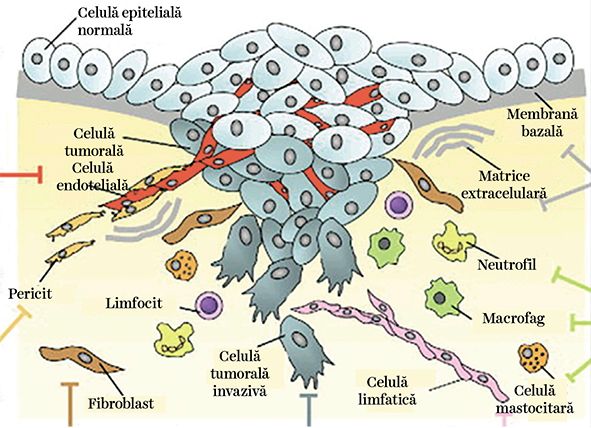
Procesul de liză a celulelor tumorale este indus prin apoptoză și prin activarea multiplelor celule constitutive ale ţesutului normal, începând cu macrofagul, acesta ajutând la eliminarea celulelor tumorale iradiate. De asemenea, iradierea produce activarea fibroblaștilor și promovarea fibrozei în zona iradiată, precum și efecte la nivelul endoteliului vascular, cu reacţiile sale secundare, cum ar fi apariţia de tromboze sau de infarcte. O reprezentare schematică a desfășurării în timp și spaţiu a acţiunii radiaţiilor aplicate prin tehnica convenţională și prin tehnica „FLASH” la nivelul sistemului nervos central este redată în fig. 5.
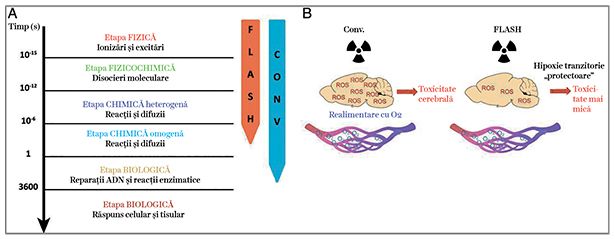
Unul dintre efectele la nivel celular responsabile de reducerea efectelor secundare în cazul iradierii „FLASH” ar fi depleţia rapidă a oxigenului, prin consumul rapid de oxigen și, implicit, reducerea reacţiilor potenţate de speciile reactive de oxygen (ROS). Acest lucru provoacă o radiorezistenţă tranzitorie la nivelul ţesuturilor normale, dar nu și la nivelul tumorilor, care și așa au zone întinse de hipoxie celulară. Hipoxia indusă la nivelul ţesutului sănătos are un efect protector, ce stă la baza efectului protector al iradierii „FLASH” pentru ţesutul sănătos. Astfel, iradierea ultrarapidă reduce toxicitatea chiar și la nivelul ţesutului cerebral. Prezenţa continuă a oxigenului la nivelul ţesutului sănătos favorizează toxicitatea indusă prin iradierea convenţională (fig. 5).
Efectul biologic la nivelul ţesutului tumoral al iradierii „FLASH” este același ca al iradierii standard, și anume distrugerea celulei tumorale. Studiile efectuate in vitro sugerează că iradierea în pulsuri de ordinul milisecundelor potenţează într-o mai mică măsură instabilitatea genomică a celulelor tumorale decât iradierea convenţională.
Reacţia acută la nivelul ţesutului cutanat normal
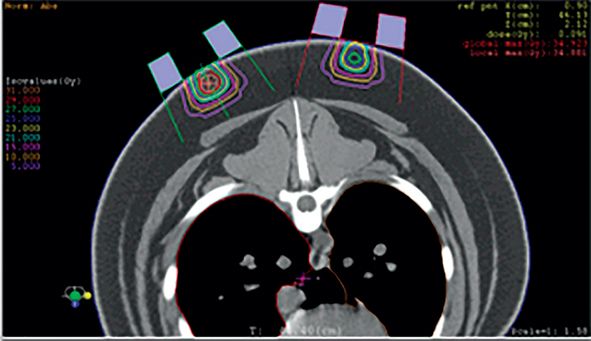
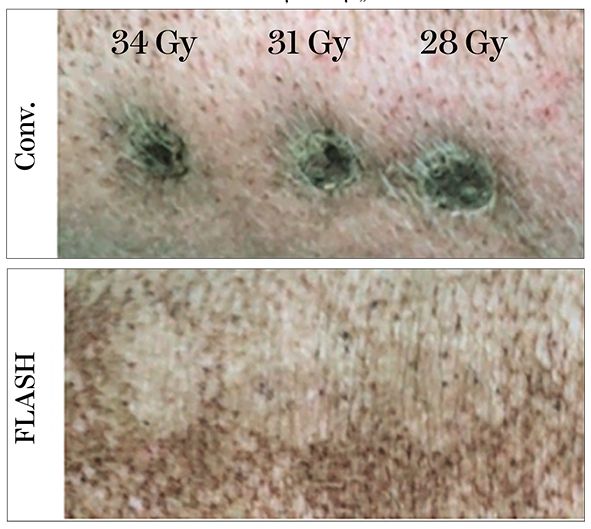
În fig. 6 și 7 este redat planul iradierii efectuate la nivelul ţesutului cutanat la un purcel, utilizând iradierea convenţională și cea „FLASH” cu dozele precizate.
La iradierea tumorilor cerebrale, unul dintre efectele secundare nedorite este pierderea memoriei, a capacităţii cognitive și a rapidităţii executive.
Celulele responsabile de menţinerea memoriei se produc la nivelul hipocampului, și anume la nivelul ventriculilor laterali, de unde migrează în ţesutul cerebral. Iradierea craniană a întregului sistem nervos central, fără protecţia structurilor corespunzătoare hipocampului, duce în timp la reducerea și chiar pierderea memoriei la acești pacienţi. Pentru reducerea acestui efect secundar nedorit, se poate calcula, pentru tehnica IMRT, un plan de iradiere în care doza aplicată la nivelul hipocampului (plexurilor din ventriculii laterali) este diminuată.
Fig. 8 prezintă exemplul unui plan de iradiere a ţesutului cerebral în cazul radioterapiei profilactice, cu aplicarea unei doze totale de 30 Gy în fracţiuni de 3 Gy și cu protecţia adecvată a plexurile coroidiene de la nivelul hipocampului, pe care se aplică o doză maximală 7-9 Gy în 10 fractiuni.
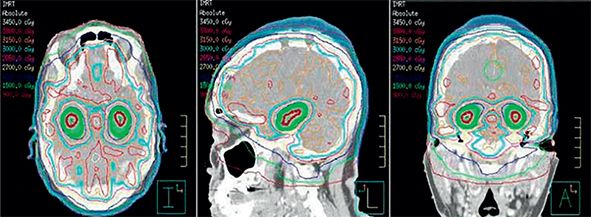
Reducerea dozei aplicate la nivelul plexurilor coroidiene printr-o subdozare, cu ajutorul noilor tehnici de iradiere cu procedura IMRT, permite, la copiii la care o asemenea iradiere este indicată, reducerea efectelor secundare pe plan cognitiv.
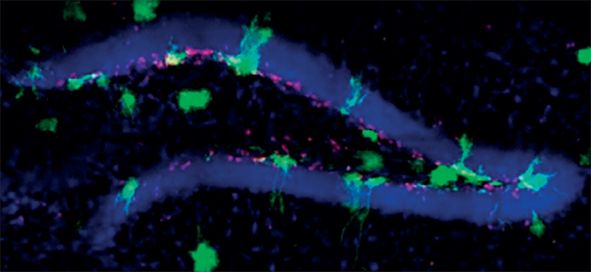
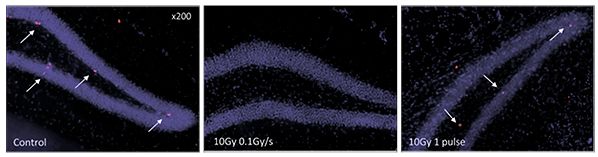
În fig. 9 și 10 este exemplificat efectul protector al iradierii de tip „FLASH” la nivel celular în hipocamp, la șoarece.
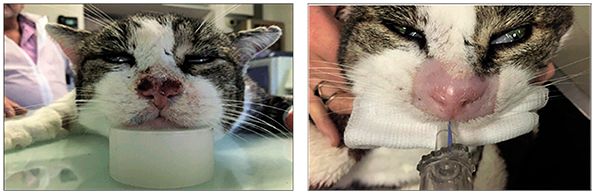
Tehnica „FLASH” a fost deja experimentată și în radioterapia clinică. Rezultatul utilizării în cazul tratamentului cancerului cutanat la o pisică este redat în fig. 11.
În așteptarea publicării rezultatelor utilizării tehnicii „FLASH” în clinica umană, cele raportate și principiul acestei noi proceduri permit să devenim mai optimiști în ceea ce privește viitorul radioterapiei și a noilor posibilităţi deschise.
*Literatura cu rezultatele prezentate în acest articol se pot obţine de la autorul articolului.
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe