Tomografia computerizată este cea mai utilizată modalitate pentru stabilirea extensiei locale sau a statusului metastatic.
Cancerul renal (RCC) reprezintă între 3 și 5% din totalul cazurilor noi de cancer. Conform estimărilor GLOBOCAN 2020, la nivel mondial, incidenţa cancerului renal a fost de 431.288 de cazuri noi pe an (locul 14), dintre care 271.249 la bărbaţi și 160.039 la femei. Mortalitatea a fost de 179.368 de cazuri pe an (locul 15), 115.600 de bărbaţi și 63.768 de femei.
Conform aceleiași surse, în România s-au înregistrat 2.750 de cazuri noi în 2020 (locul 11) și 1.066 de decese (locul 15) (1). Trebuie menţionat că statisticile GLOBOCAN cuprind împreună cazurile de cancer renal și cele ale bazinetului renal. Cele din urmă au histologie diferită, predominând cancerele uroteliale. Se estimează că aproximativ 80-85% dintre cancerele incluse în această statistică sunt la nivelul rinichiului, restul fiind bazinetale (2).
Aproximativ 3% din totalul cancerelor parenchimului renal sunt ereditare, și apar cel mai frecvent în cadrul sindromului von Hippel-Lindau (VHL), cu transmitere autozomal dominantă. Alte sindroame ereditare predispun la cancere renale, precum BAP1-tumor predisposition syndrome, Birt-Hogg-Dubé syndrome, hereditary papillary renal carcinoma, hereditary paraganglioma/pheocromocytoma syndrome și tuberous sclerosis complex. Sindromul Cowden și sindromul Lynch pot, de asemenea, să includă cancere renale (3). Principalii factori de risc pentru cancerul renal sunt: fumatul, obezitatea și hipertensiunea arterială. Studii mai recente au arătat un potenţial efect protector al cofeinei, în timp ce consumul de cafea decofeinizată ar crește riscul de cancer renal (4,5). Pacienţii cu insuficienţă renală cronică terminală, pacienţii dializaţi sau cei cu transplant renal au, de asemenea, risc crescut de a dezvolta cancer renal.
DEPISTARE
Diagnostic clinic
Simptomatologia este reprezentată de triada durere la nivelul flancului, masă tumorală palpabilă și hematurie macroscopică, însă aceste semne apar tardiv în evoluţia bolii. Sindroame paraneoplazice, precum hipercalcemia, eritrocitoza și colestaza fără semne de afectare hepatică, sunt frecvent întâlnite. Cazurile incipiente sunt detectate de regulă întâmplător, ecografic sau tomografic.
Diagnostic histopatologic
Aproximativ 70-80% dintre RCC sunt carcinoame cu celule clare. Alte tipuri histologice sunt cancerul papilar și cancerul cromofob, ce reprezintă 80% dintre tipurile histologice non-clear cell. Mult mai rare sunt cancerul ductelor colectoare, carcinoamele ductelor Bellini și carcinomul medular, variante histologice extrem de agresive (6,7). Conform ISUP (International Society of Urological Pathology), buletinul histopatologic trebuie să cuprindă principalele elemente histopatologice de prognostic, precum: subtipul histologic, gradul nucleolar aplicabil formelor cu celule clare și papilar (diferenţierea sarcomatoidă sau rabdoidă conferă implicit gradul nucleolar 4), prezenţa necrozei, a invaziei vasculare, stadiul pTNM și descrierea ţesutului renal non-neoplazic (8).
Diagnostic molecular
Cel mai frecvent, cazurile sporadice de carcinom renal prezintă mutaţii, deleţii sau hipermetilare a genei supresoare tumorale VHL. Formele histopatologice non-clear cell sunt extrem de heterogene și presupun prezenţa a diferite mutaţii (9). Astfel, carcinomul papilar poate să fie de tip 1 (asociat mai frecvent cu mutaţii MET sau EGFR) sau de tip 2 (fenotip agresiv, asociat cu mutaţii SETD2, CDKN2A ori fuziuni TFE3 sau în cazurile cu istoric familial de mutaţii FH – fumarat hidrataza).
Carcinomul cromofob trebuie diferenţiat de oncocitom (pe baza citokeratinei 7 difuz pozitivă în carcinom și negativă sau focal pozitivă în oncocitom). Cea mai frecventă mutaţie prezentă în această formă este mutaţia p53 (TP53), calea patogenă cel mai des implicată fiind calea mTOR, cu alterări PTEN. Există o serie de alte mutaţii prezente în special în formele cu determinism ereditar și în alte subtipuri patologice non-clear cell.
Metode utilizate
Stadializarea imagistică
Cea mai utilizată modalitate pentru stabilirea extensiei locale sau a statusului metastatic este tomografia computerizată (CT). Retrospectiv, aceasta a demonstrat sensibilitate de 78% și specificitate de 96% pentru detecţia invaziei venei renale, sensibilitate de 83% și specificitate de 88% pentru detecţia adenopatiilor locoregionale invadate și 100% specificitate pentru evaluarea extensiei directe la organele învecinate (10). De asemenea, aceasta este metoda de elecţie pentru stabilirea extensiei bolii la nivel pulmonar (11).
Alte metode utilizate sunt rezonanţa magnetică (RM), ce oferă informaţii superioare în ceea ce privește extensia vasculară a tumorii (12), sau tomografia cu emisie de pozitroni (PET-CT). Cea din urmă, până în prezent, nu și-a demonstrat superioritatea faţă de CT și nu este recomandată de rutină în niciun ghid internaţional de tratament.
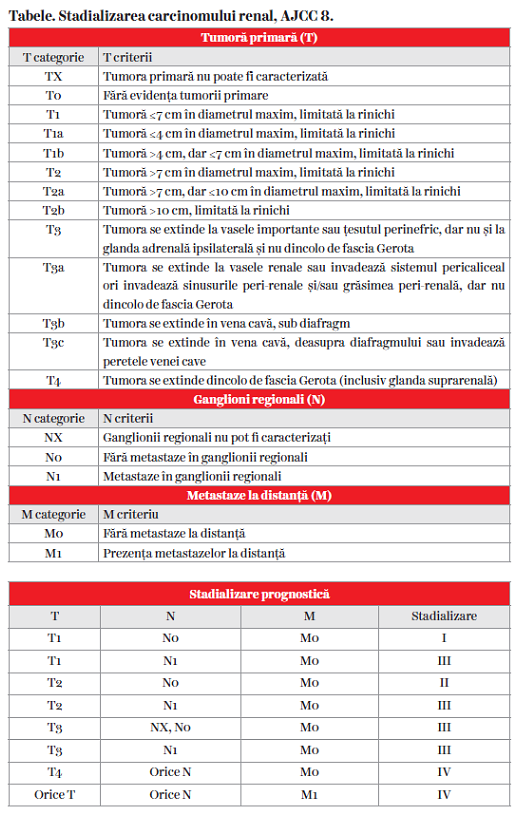
Stadializarea TNM
Se face în concordanţă cu a opta ediţie a AJCC (American Joint Committee on Cancer) (13), conform tabelelor.
Încadrarea prognostică
Stadializarea anatomică (TNM) este cel mai important factor prognostic (11). Pentru boala localizată, supravieţuirea estimată la cinci ani, pentru pacienţii aflaţi în stadiul I, este de peste 90%, iar pentru cei în stadiul II, între 75% și 95%. Supravieţuirea scade până la
59-70% pentru pacienţii în stadiul III (13).
Bazat pe o analiză retrospectivă a peste 1.600 de pacienţi trataţi prin nefrectomie radicală, a fost stabilit un risc adiţional de metastazare la cinci ani, care depinde de marginile chirurgicale, extensia tumorii (pT), statusul ganglionar (pN), gradul de diferenţiere tumorală, prezenţa sau absenţa necrozei, componenta sarcomatoidă și multifocalitatea. Fiecărei componente i s-a atribuit un scor de la 0 la 4, direct proporţional cu agresivitatea, creându-se trei grupe de risc: scăzut (scor 0-2; risc de metastazare la cinci ani de 2,9%), intermediar (scor 3-5; risc de metastazare la cinci ani de 26,2%) sau înalt (scor cel puţin 6; risc de metastazare la cinci ani de 68,8%) (14).
Pentru boala metastatică, cel mai cunoscut algoritm de estimare a prognosticului de supravieţuire îl reprezintă criteriile MSKCC (Memorial Sloan Kettering Cancer Center) (15). Acestea au fost completate de IMDC (International Metastatic RCC Database Consortium), scorul devenind standardul pentru orientarea deciziei de tratament în boala metastatică în prima și în a doua linie. Cele șase constante sunt: indicele Karnofsky <80%, valoarea hemoglobinei sub limita minimă a normalului, timpul scurs de la diagnostic la tratament sub un an, calciul corectat peste valoarea normală, valoarea trombocitelor peste limita maximă admisă și numărul neutrofilelor peste valoarea maximă admisă.
Acestora li se acordă câte un punct dacă sunt prezente sau zero puncte dacă sunt absente. Grupele prognostice care se creează astfel sunt: favorabil (niciun factor de risc prezent), intermediar (1-2 factori de risc) sau nefavorabil (3 sau mai mulţi factori de risc) (16). De asemenea, subtipurile histopatologice ale RCC pot fi clasificate în grupe prognostice. Varianta cu celule clare este catalogată ca având un prognostic inferior comparat cu cel al carcinomului papilar. Subtipurile mai rare (cu diferenţiere sarcomatoidă sau rabdomioidă, medulare sau de ducte colectoare) sunt considerate ca având cea mai scurtă supravieţuire (17).
Din punctul de vedere al biologiei moleculare, o serie de markeri au fost identificaţi ca având prognostic negativ în supravieţuirea pacienţilor cu carcinom cu celule clare: indice de proliferare Ki-67 înalt, niveluri scăzute de anhidrază carbonică IX (18), deleţia cromozomului 9q (19) sau prezenţa mutaţiei BAP1 și PBRM1 pe cromozomul 3p (20). Până în prezent, aplicabilitatea clinică a acestor markeri nu a fost demonstrată.
Material preluat din volumul „Terapii moderne în cancer 2022”, editat de Viaţa Medicală.
Bibliografia este disponibilă pe www.viata-medicala.ro.
Bibliografie
1. GLOBOCAN 2020 at - https://gco.iarc.fr/today/data/factsheets/cancers/29-Kidney-fact-sheet.pdf
2. Cancer Stat Facts: Kidney and Renal Pelvis Cancer - Kidney and Renal Pelvis Cancer — Cancer Stat Facts
3. Eamonn R Maher - Hereditary renal cell carcinoma syndromes: diagnosis, surveillance and management World J Urol 2018 Dec;36(12):1891-1898. doi: 10.1007/s00345-018-2288-5
4. Chow WH, Dong LM, Devesa SS. Epidemiology and risk factors for kidney cancer. Nat Rev Urol 2010; 7(5): 245–257
5. Antwi SO, Eckel-Passow JE, Diehl ND et al. Coffee consumption and risk of renal cell carcinoma. Cancer Causes Control 2017; 28(8): 857–866
6. Moch H, Cubilla AL, Humphrey PA et al. The 2016 WHO classification of tumours of the urinary system and male genital organs-part A: renal, penile, and testicular tumours. Eur Urol 2016; 70(1): 93–105
7. Hsieh JJ, Purdue MP, Signoretti S et al. Renal cell carcinoma. Nat Rev Dis Primers 2017; 3: 17009
8. Delahunt B, Cheville JC, Martignoni G et al. The International Society of Urological Pathology (ISUP) grading system for renal cell carcinoma and other prognostic parameters. Am J Surg Pathol 2013; 37(10): 1490–1504
9. B. Escudier, C. Porta, M. Schmidinger, N. Rioux-Leclercq, A. Bex, V. Khoo, V. Grunwald, S. Gillessen & A. Horwich, on behalf of the ESMO Guidelines Committee Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up - Annals of Oncology 30: 706–720, 2019
10. C. Johnson, N. Dunnick, R. Cohan, and F. Illescas, “Renal adenocarcinoma: CT staging of 100 tumors,” American Journal of Roentgenology, vol. 148, no. 1, pp. 59–63, Jan. 1987, doi: 10.2214/ajr.148.1.59
11. B. Ljungberg et al., “European Association of Urology Guidelines on Renal Cell Carcinoma: The 2022 Update,” European Urology, p. S0302283822016761, Mar. 2022, doi: 10.1016/j.eururo.2022.03.006
12. R. C. Semelka, J. Patrick Shoenut, C. M. Magro, M. A. Kroeker, R. Macmahon, and H. M. Greenberg, “Renal cancer staging: Comparison of contrast-enhanced CT and gadolinium-enhanced fat-suppressed spin-echo and gradient-echo MR imaging,” J. Magn. Reson. Imaging, vol. 3, no. 4, pp. 597–602, Jul. 1993, doi: 10.1002/jmri.1880030408
13. Rini BI, McKiernan JM, Chang SS, “AJCC Cancer Staging Manual, 8th, Amin MB (Ed),” in AJCC Cancer Staging Manual, 8th, New York: Springer, 2017, p. p.739
14. B. C. Leibovich et al., “Prediction of progression after radical nephrectomy for patients with clear cell renal cell carcinoma: A stratification tool for prospective clinical trials,” Cancer, vol. 97, no. 7, pp. 1663–1671, Apr. 2003, doi: 10.1002/cncr.11234
15. R. J. Motzer, M. Mazumdar, J. Bacik, W. Berg, A. Amsterdam, and J. Ferrara, “Survival and Prognostic Stratification of 670 Patients With Advanced Renal Cell Carcinoma,” JCO, vol. 17, no. 8, pp. 2530–2530, Aug. 1999, doi: 10.1200/JCO.1999.17.8.2530
16. J. J. Ko et al., “The International Metastatic Renal Cell Carcinoma Database Consortium model as a prognostic tool in patients with metastatic renal cell carcinoma previously treated with first-line targeted therapy: a population-based study,” The Lancet Oncology, vol. 16, no. 3, pp. 293–300, Mar. 2015, doi: 10.1016/S1470-2045(14)71222-7
17. A. R. Golshayan et al., “Metastatic Sarcomatoid Renal Cell Carcinoma Treated With Vascular Endothelial Growth Factor–Targeted Therapy,” JCO, vol. 27, no. 2, pp. 235–241, Jan. 2009, doi: 10.1200/JCO.2008.18.0000
18. M. H. T. Bui et al., “Prognostic value of carbonic anhydrase IX and ki67 as predictors of survival for renal clear cell carcinoma,” Journal of Urology, vol. 171, no. 6 Part 1, pp. 2461–2466, Jun. 2004, doi: 10.1097/01.ju.0000116444.08690.e2
19. M. Brunelli et al., “Loss of chromosome 9p is an independent prognostic factor in patients with clear cell renal cell carcinoma,” Mod Pathol, vol. 21, no. 1, pp. 1–6, Jan. 2008, doi: 10.1038/modpathol.3800967
20. P. Kapur et al., “Effects on survival of BAP1 and PBRM1 mutations in sporadic clear-cell renal-cell carcinoma: a retrospective analysis with independent validation,” The Lancet Oncology, vol. 14, no. 2, pp. 159–167, Feb. 2013, doi: 10.1016/S1470-2045(12)70584-3
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe