
Tratamentul cu estrogeni la menopauză trebuie să respecte câteva principii, inclusiv corelarea cu vârsta.
Studiul Women Health Initiative WHI, demarat în 1993, a fost efectuat pentru a arăta că estrogenii la menopauză blochează apariţia accidentelor vasculare (mai ales infarctul de miocard). Studiul a fost oprit pe motiv că estrogenii şi progesteronul administrate au provocat creşteri ale prevalenţei infarctului de miocard şi a accidentelor vasculare cerebrale la femeile incluse şi au infirmat ipotezele de lucru.
1. Bolile cardiovasculare, estrogenii şi hipomagneziemia
În esenţă, creşterea prevalenţei manifestărilor trombotice postadministrare de estrogeni (deşi ramura „numai estrogeni” a continuat) a fost pusă pe seama creşterii eliminării de magneziu (Seeling, 2009). Ramura „numai estrogeni” a fost continuată chiar şi după 15 ani, fără efecte negative, în special fără accidente vasculare şi fără cancer de sân (Gurney, 2014).
2. Cancerul de sân
Observaţiile epidemiologice sunt concludente: prevalenţa cancerului de sân este mai mare la menopauză faţă de femeile active uterin. Fenomenul prevalenţei cancerului de sân la menopauză, atunci când scad estrogenii, este aparent paradoxal faţă de observaţia că acest cancer este tratabil cu antiestrogenice. Acest fenomen poate fi însă explicat prin fenomenul de upregulation (Pereţianu, 2016). Lipsa de estrogeni angajează creşterea numărului de receptori pentru estrogeni, ceea ce conduce la proliferări ale celulelor glandulare ale sânului.
Studiul WHI a arătat creşterea prevalenţei cancerului de sân în grupa femeilor care au luat CEE şi progesteron (Chlebovski, 2003), 245 de cazuri din 7.656 paciente (3,2%) vs. placebo: 185 de cazuri din 7.310 (2,53%) paciente. Cancerul agresiv a fost prezent în proporţie de 199 vs. 150 (ambele cca. 81% din totalul cancerelor de sân). Histologia nu a diferit între cancerul de sân de la pacientele tratate vs. placebo: tipul de cancer estrogen pozitiv vs. estrogen negativ a fost prezent în aceeaşi proporţie la pacientele sub tratament, ca şi la cele din grupul placebo. Mortalitatea prin aceste cancere a fost de 4 în lotul tratat cu CEE vs. 4 în lotul placebo. S-a observat că prevalenţa cancerului în lotul cu CEE şi medroxiprogesteron creşte începând cu anul 3 de tratament (Chlebovski, 2003).
De altfel, alte studii arată că după trei ani de administrare de CEE plus MP nu se observă creşterea prevalenţei cancerului de sân (Vickers, 2007). Cu alte cuvinte (preluate din Vickers, 2007), dacă după trei ani de la iniţierea estrogenoterapiei la menopauză nu a apărut un cancer de sân, el nici nu va mai apărea.
Prevalenţa cancerului de sân a fost mai mare la femeile sub tratament în vârstă de peste 60 de ani vs. cele între 50 și 60 de ani (45% vs. 33%), dar la fel a fost proporţia şi în cazul femeilor din lotul placebo.
În plus, se consideră că evoluţia cancerului de sân la pacientele tratate cu estrogeni în menopauză este mai favorabilă decât la pacientele care fac cancer de sân în lipsa oricărui tratament (Fagerholm, 2017). Cauza pare a fi reprezentată de factorii genetici şi familiali. Analiza acestor factori poate conduce la selecţionarea pacientelor pentru tratamentul estrogenic. Dacă pacientele nu posedă BRCA 1 sau BRCA 2, medicii nu au de ce să se îngrijoreze pentru iniţierea terapiei estrogenice.
Înainte de publicarea rezultatelor studiului WHI, o nouă paradigmă apăruse în tratamentul cancerului de sân (precum şi a cancerului de prostată, vezi în Pereţianu, 2017). Este vorba despre administrarea de estrogeni în cancerul de sân (Peters, 2001). Studiul a cuprins numai 56 de femei, cărora li s-au administrat diverse preparate orale sau transdermice de estrogeni (CEE, estradiol, etinilestradiol, în diferite combinaţii cu progestative), timp de 1 an până la 20 de ani (mediana 6,4 ani). În cazul a 54 de paciente, nicio complicaţie oncologică nu a mai apărut; un caz a prezentat recurenţă la 13,5 ani, iar altul a prezentat cancer la celălalt sân la 9,6 ani (Peters, 2001). Niciuna din pacientele cu cancer de sân la care s-au administrat estrogeni per orem nu a decedat în intervalul de analiză (4,7-38,9 ani).
Studii mai recente (Simin, 2017) arată o uşoară creştere a prevalenţei cancerului de sân la femeile care au folosit sau folosesc estrogeni la menopauză: standardised incidence ratios (SIR) a fost 1,09 pentru toate cancerele sexuale, cu evidenţiere mai pregnantă la femeile care au folosit tratamentul la vârsta de peste 70 de ani (SIR=1,33). Studiul nu a făcut nicio corelaţie cu dozele administrate. În acelaşi timp, cancerele gastrointestinale au scăzut prin folosirea estrogenilor la menopauză.
Multiple grupe de cercetători, precum şi cele care au făcut publice primele rezultate din studiul WHI, au revenit asupra observaţiilor iniţiale. Astfel, s-au publicat rezultate la distanţă de ani faţă de primele studii, rezultate care arată extrem de diferit, deşi au urmărit aceleaşi paciente! De exemplu, 8.506 femei sub CEE+MP timp de 5,6 ani (mediana) şi 5.310 femei numai sub CEE, timp de 7,2 ani (mediana) vs. placebo au fost urmărite cumulativ 18 ani și cel puţin 10 ani (Manson, 2017). Mortalitatea de toate cauzele a fost de 27,1% în loturile tratate vs. 27,8% la placebo. Mortalitatea prin cauze cardiovasculare nu a fost mai mare în lotul tratat: 8,9% vs. 9% la placebo. Nici cancerul de toate tipurile nu a avut prevalenţe mult diferite: 8,2% vs. 8% la placebo.
Utilizarea de CEE plus MP sau fără MP, la femeile peste 60 de ani, a condus după 7 ani de administrare zilnică la riscuri considerate ca mici (low) pentru evenimentele coronariene şi pentru cancerul de sân (1/500) (Marjoribanks, 2017). Administrarea numai a CEE a condus la scăderea prevalenţei cancerului de sân, date observate la 11 ani de la iniţierea studiului (Hodis, 2012).
Bizar în toată această pleiadă de observaţii este că lumea medicală nu ţine cont de rezultatele analizate în timp, adică după 15 ani de la primele publicaţii, ci îşi aduce aminte numai de cele publicate acum 15 ani. Datele revizuite ale WHI arată protecţia cardiovasculară în timp şi lipsa creşterii prevalenţei cancerului de sân!
Fenomenul fricii de estrogeni de menopauză seamănă cu acela de a lua ViagraR de teama infarctului de miocard. Aceasta pentru că se uită că sildenafilul a fost dezvoltat ca medicament cu indicaţie pentru insuficienţa cardiacă şi că cei doi bărbaţi care au decedat după ce au consumat sildenafil (în 1998) aveau 80, respectiv 88 de ani, şi au murit în cursul actului sexual (vezi detalii în Pereţianu, 2003).
Datele reinterpretate ale studiului WHI au arătat că iniţierea terapiei la paciente anterior vârstei 60 de ani sau sub 5-10 ani de la încetarea menstrei conduce la scăderea prevalenţei infarctului de miocard (Hodis, 2008, 2012, 2013).
După apariţia rezultatelor Studiului WHI, mai multe organizaţii profesionale legate de menopauză şi hormoni (AACE, NAMS) au observat că femeile incluse în acest studiu nu pot fi considerate ca reprezentative pentru totalitatea femeilor la menopauză. Iar aceasta pentru că pacientele incluse în grupele de cercetare erau considerate ca „vârstnice” (Lukes, 2008). Media pacientelor intrate în studiul WHI a fost de 64 de ani.
1. Principii
Tratamentul cu estrogeni trebuie să ţină seama de câteva principii (Netovitz, 2006):
O metaanaliză mai veche (Nelson, 2004) arată că în acele studii cu durată mai mică de 5 ani nu se citează apariţia de cancer de sân indiferent dacă se administrează CEE sau estradiol. În plus, tratamentul la vârste între 50 şi 60 ani, la femeile fără ateromatoză, sunt mai protectoare decât la femeile peste 60 de ani (Lukes, 2008).
2. Indicaţii terapeutice
Cele mai multe ghiduri de tratamente în menopauză arată că este bine a se administra estrogeni numai la pacientele care au simptome de menopauză (Nelson, 2004). Aceste simptome sunt de fapt două, şi din două, de fapt unul este semn, iar celălalt este simptom.
Cu toate acestea, s-a arătat că lipsa estrogenilor nu produce numai tulburări vasomotorii şi atrofie genitală. Lipsa estrogenilor este cauză de pierdere a memoriei, osteoporoză și degradare a pielii. Pot fi aceste semne şi sindroame considerate ca indicaţie pentru administrarea de estrogeni în menopauză? Sigur că pot, dar încă nu sunt trecute în ghiduri.
a. Simptomatologia vegetativă
Simptomatologia centrală a menopauzei este senzaţia de căldură insuportabilă (flash) şi cea de frig, mai ales după o transpiraţie profuză. Fenomenele apar încă în premenopauză şi pot dura 10 ani. Mai interesant este faptul că, după o perioadă de 15-20 de ani de „pauză”, simptomatologia vegetativă reapare. La femeile de 75-80 de ani, această simptomatologie pare bizară, dar ea se tratează tot cu estradiol! Este adevărat că eu folosesc doze extrem de mici, per orem.
b. Atrofia genitală
Semnul cel mai frecvent pentru care se iniţiază tratament estrogenic la menopauză este atrofia genitală. Aceasta este asociată extrem de frecvent cu infecţii urinare. Administrăm estrogeni în infecţia urinară la femeile la menopauză, indiferent dacă ştim sau nu că au atrofie vaginală? Studiile sunt neconcluzive, cu rezultate diametral opuse (Netovitz, 2006).
De obicei, colegii ginecologi şi urologi recomandă preparate locale, intravaginale. Eu recomand preparatele per orem, pentru motivele expuse (vezi mai departe).
c. Cogniţia şi memoria
Iniţial, studiul WHI a sugerat că administrarea CEE conduce la creşterea demenţei la pacientele cu administrare de estrogeni (Coker, 2009). Datele au fost puse pe seama atrofiei cerebrale şi a leziunilor vasculare cerebrale. Ulterior, analizele poststudiu au arătat că primele date erau greşite. CEE nu modifică volumul creierului şi nu au efect negativ asupra cogniţiei. Factorii care provoacă aceste lucruri la femeile luate în studiu au fost: vârsta de debut a terapiei, mai înaintată, fumatul, preexistenţa unor leziuni cerebrovasculare, hipertensiunea, scorurile de cogniţie mai reduse la momentul intrării în studiu şi preexistenţa simptomelor legate de demenţă (Alzheimer), necunoscute la momentul intrării în studiu (Coker, 2008).
În cadrul Studiului ELITE (Early vs. Late Intervention Trial with Estradiol), un grup de cercetători a investigat efectul procognitiv al estradiolului, E2 (Henderson, 2016). În primul rând, trebuie remarcat că nu s-a folosit CEE, ci E2. În al doilea rând, trebuie remarcat că s-a administrat E2 la două grupe de vârstă: 55-65 de ani şi 69-70 ani. În al treilea rând, de remarcat că nu s-a administrat MP, ci progesteron micronizat, gel intravaginal. În al patrulea rând, pacientele au fost selecţionate ca fiind fără leziuni vasculare, afirmate prin grosimea intimă/medie la dopplerul carotidian.
Rezultatele au arătat că E2 nu influenţează cogniţia, dar, după cinci ani de administrare, nu s-a observat niciunul dintre efectele negative pentru care a fost stopat studiul WHI!
O situaţie clinică interesantă, corelativ cu sexul feminin, este boala Alzheimer. Administrarea de estrogeni imediat după instalarea menopauzei, timp de 20 de ani, scade posibilitatea apariţiei bolii Alzheimer în regiunea de Est a Finlandei (Imtiaz, 2017). La aceste femei s-a înregistrat şi un scor mai bun pentru cogniţia globală şi memoria episodică. Una dintre concluziile studiului arată că terapia este protectivă dacă începe devreme, când neuronii nu sunt încă afectaţi.
În SUA, estrogenii de menopauză sunt protectori faţă de memoria de lucru, afectată de stresul zilnic, cel care produce hipercortizolism episodic. Tratamentul a fost efectuat la femei în vârstă, după 64 ani, timp de 5 ani, cu estradiol (nu CEE) şi progesteron (nu MP) (Ycaza Herrera, 2017).
d. Depresia
Prevalenţa depresiei, mai ales cea minoră, creşte în menopauză (Richter-Rössler, 2007). S-a arătat că estradiolul stimulează formarea de serotonină la nivelul creierului (Richter-Rössler, 2007). Despre serotonină se ştie că este scăzută în sinapsele interneuronale, fapt pentru care se şi administrează medicamente inhibitori de recaptare a serotoninei.
Indicaţia de estrogeni, în aceste cazuri, este corelată cu vârsta, în sensul că administrarea de estrogeni a avut un efect mai mare la femeile mai tinere, cele aflate în „perimenopauză” (Richter-Rössler, 2007).
e. Lipsa libidoului şi a satisfacţiei sexuale
Până acum 30 de ani, acest subiect era „tabu”. Femeile la menopauză nu aveau viaţă sexuală şi nici nu era cazul să se preocupe de aşa ceva. Între timp, situaţia s-a schimbat, numeroase studii cercetează sexualitatea la menopauză.
Administrarea locală de estrogeni poate ameliora simptomatologia locală, cea de atrofiere vaginală, dar nu are efect asupra libidoului şi motivării sexuale (Wylie, 2006).
În sudul Braziliei, 85% dintre femeile la menopauză cu vârste între 45 şi 60 de ani sunt active sexual (Soares De Lorenzi, 2006). O proporţie de 60% declară că au raporturi sexuale cu frecvenţă mai scăzută ca antemeopauză, dar 45% din această diminuare este pusă pe seama bărbaţilor. Femeile între 45 și 49 de ani au o frecvenţă a raporturilor sexuale de 8,5 pe lună, iar cele între 50 şi 60 de ani – de numai 5,8 pe lună (Soares De Lorenzi, 2006).
În Finlanda, 62-65% dintre femeile între 42 și 46 ani la menopauză au un raport sexual pe săptămână (depinzând de starea de sănătate), iar între cele de 52-56 de ani, 45-54% au un raport sexual pe săptămână (Ojanlatva, 2006).
Pentru a menţine această activitate, care este corelativă cu percepţia unei stări de sănătate generală pozitivă (Ojanlatva, 2006), s-au administrat estrogeni, dar şi, cu o indicaţie mai precisă, testosteron, ştiut fiind că hormonul susţine libidoul la bărbaţi. S-a administrat concomitent estradiol şi testosteron în sistem transdermal (Kingsberg, 2007) la femeile cu menopauză indusă chirurgical.
Activitatea sexuală este susţinută de două componente: prima este libidoul, a doua este lipsa atrofiei vaginale. Libidoul este condiţionat cerebral de transformarea locală a testosteronului în estradiol, prin aromatizarea intraneuronală.
Studii mult mai recente arată că tratamentul cu estrogeni are o importantă componentă sexuală. După patru ani de administrare, valorile scorurilor sexuale sunt mai crescute la femeile care au fost tratate cu estradiol transdermal vs. CEE, şi cu mult mai mari decât la femeile netratate (Taylor, 2017).
f. Osteoporoza
Datele de cercetare fundamentală arată că osul este format prin activitatea osteoblastelor, ca urmare a acţiunii estrogenilor, prin receptori de tip b. Analizele detaliate ale studiului WHI arată clar că estrogenii protejează excelent femeile la menopauză de fracturile osteoporotice. Dacă nu se includ în tratament femei cu risc cardiovascular şi de cancer de sân, tratamentul estrogenic este mai protectiv decât cel cu bifosfonaţi (Lukes, 2008). De aceea, tratamentul estrogenic trebuie început în chiar primele momente ale „premenopauzei”.
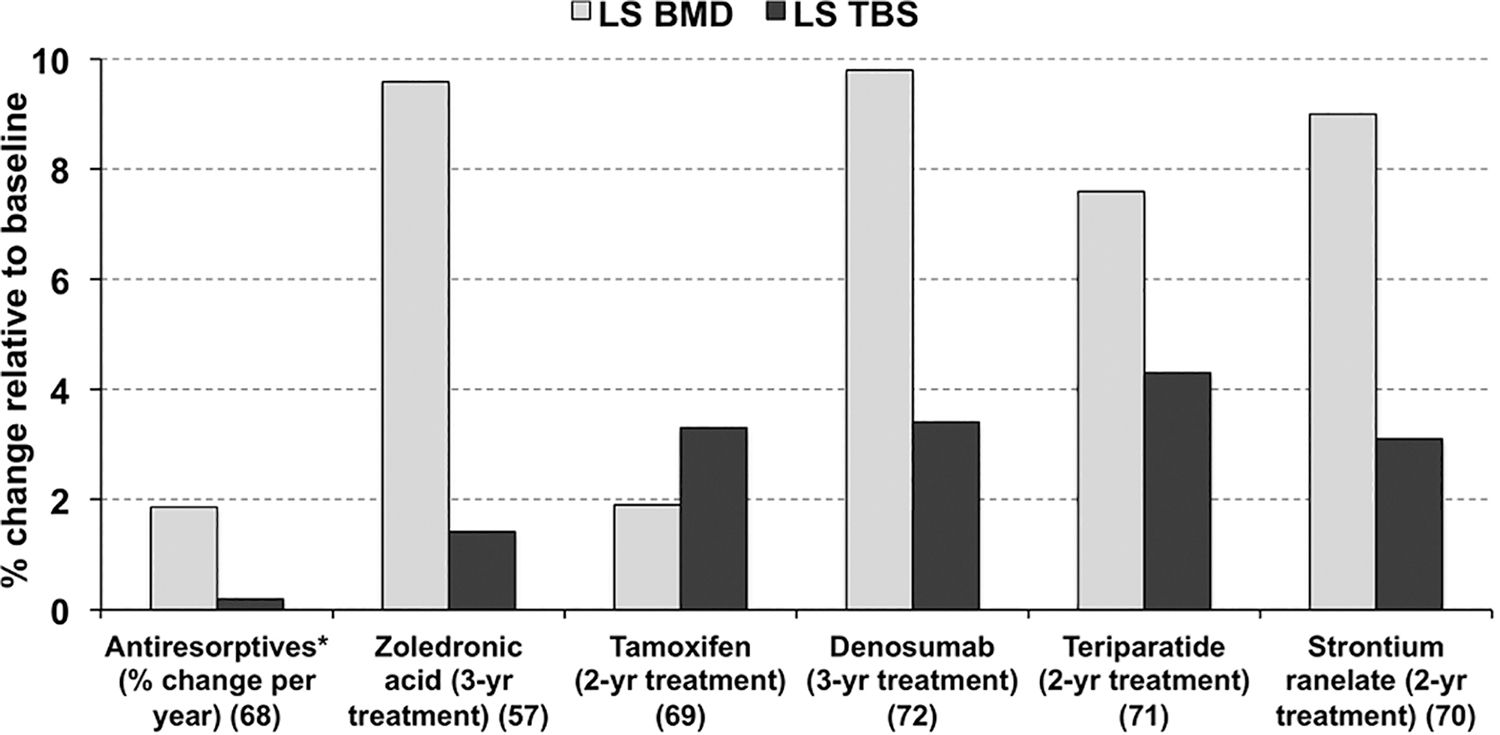
Cu toate acestea, sunt unii clinicieni (Qaseem, 2017) care contraindică administrarea de estrogeni ca tratament al osteoporozei explicit: American College of Physiology (ACP) nu recomandă utilizarea estrogenilor de menopauză sau a estrogenilor plus progestogen sau raloxifen pentru tratamentul osteoporozei la femei. Aceasta, deşi s-a arătat că modulatorii selectivi ai receptorilor de estrogeni (SERM), raloxifenul şi tamoxifenul, sunt chiar mai eficace decât bifosfonaţii promovaţi de ACP (Figură).
Efecte ale medicamentelor antiosteoporotice asupra densităţii minerale osoase şi a scorului osului trabecular (preluat din Pereţianu&Poiană, 2016); BMD = densitatea minerală osoasă. TBS = scorul osului trabecular.
9. Migrena
În menopauză crește prevalenţa migrenelor. Intervenţiile terapeutice recomandate sunt cu doze foarte mici de estrogeni, preferabil transdermic, asociate cu doze mici de progesteron de tip continuu, preferabil intrauterin prin dispozitive specifice (MacGregor, 2017). Progestativele administrate ciclic, secvenţial, nu fac bine migrenei.
10. Mastodinii
Surprinzător, multe dintre femeile de 75-80 de ani acuză dureri de sâni. Medicii le spun pacientelor că aceste dureri de sân apar prin „hiperfoliculinemie”. Nimic mai fals! În plus, „hiperfoliculinemia” este un termen total neadecvat şi nemedical, „foliculina” a devenit estradiol, estronă şi estriol.
La această vârstă, durerile de sân apar printr-un mecanism invers celui observat la vârsta adultă, unde se afirmă „hiperfoliculinemia”. Administrarea de E2, asociat cu un SERM (eu folosesc raloxifen) este extrem de benefică.
11. Prevenţia infarctului de miocard şi scăderea mortalităţii
Primele date ale studiului WHI au arătat că CEE plus MP au condus la creşterea incidenţei infarctului de miocard şi a accidentelor vasculare cerebrale. Reanalizarea datelor a arătat că există un moment în timp în care aceste efecte pot fi reversate. Astfel, administrarea de estrogeni la femeile cu vârste sub 60 de ani, adică în „fereastra” de la oprirea menstrei la 60 de ani, şi la nu mai mult de 10 ani de la oprirea menstrei, conduce la scăderea cu 32% a incidenţei infarctului de miocard şi la creşterea cu 31% a speranţei de viaţă (Hodis, 2013). De aceea, la femeile înainte de 60 de ani, estrogenii de menopauză pot fi consideraţi a face profilaxia infarctului de miocard. În plus, oprirea tratamentului estroprogestativ înaintea vârstei de 60 de ani conduce la creşterea riscului de a face infarct de miocard în primul an după întrerupere (menopause.org, 2017).
12. Contraindicaţie – accidentele vasculare în antecedente, în special venoase
Studiul WHI a arătat că la femeile în vârstă de 60-70 de ani, administrarea de estrogeni creşte incidenţa accidentelor vasculare, în special arteriale, cu prevalenţă crescută a infarctului de miocard şi AVC. O indicaţie terapeutică pentru acest gen de paciente o constituie anticoagulantele.
Un studiu de cohortă din Italia (Martinelli, 2016) a încercat să afle dacă anticoagulantele orale şi percutanate, administrate pentru tromboza profundă a gambelor şi embolia pulmonară, pot fi asociate cu estrogeni şi progesteron în pre- şi postmenopauză. Rezultatul a fost că, sub anticoagulante, hormonii de menopauză nu conduc la creşterea prevalenţei accidentelor vasculare. Cercetătorii italieni nu recomandă oprirea terapiilor estrogenice la astfel de paciente!
Studii cu rezultate inverse au publicat alţi autori. Astfel, se afirmă că vasodilataţia flow-mediată creşte prin hormoni de menopauză (Miyamoto, 2015).
Citește și: Rolul hormonilor sexuali feminini în menopauză (1)
Bibliografie articol versiunea integrală:
Anderson GL, Judd HL, Kaunitz AM, et al. Effects of estrogen plus progestin on gynecologic cancers and associated diagnostic procedures: the Women's Health Initiative randomized trial. JAMA, 2003, 290: 1739–1748.
Barakat R, Oakley O, Kim H, Jin J, Ko CJ. Extra-gonadal sites of estrogen biosynthesis and function. BMB Rep., 2016, Sep; 49, 9: 488-496.
Bardia A, Olson JE, Vachon CM et al. Effect of aspirin and other nsaids on postmenopausal breast cancer incidence by hormone receptor status: results from a prospective cohort study. Breast Cancer Res Treat., 2011, Feb; 126, 1: 149–155.
Basaria S, Dobs AS. Clinical review: Controversies regarding transdermal androgen therapy in postmenopausal women. J Clin Endocrinol Metab., 2006 91, 12: 4743–4752.
Blake J. Menopause: evidence-based practice. Best Pract Res Clin Obstet Gynaecol., 2006, Dec; 20, 6: 799-839.
Braunstein GD. Commentary: The Endocrine Society Clinical Practice Guideline and The North American Menopause Society position statement on androgen therapy in women: another one of Yogi’s forks. J Clin Endocrinol Metab., 2007, 92, 11: 4091-4093.
Carreau S, Lambard S, Delalande C, et al. Aromatase expression and role of estrogens in male gonad : a review. Reprod Biol Endocrinol., 2003, Apr 11; 1: 35.
Comité de l’évolution des pratiques en oncologie (CEPO). Traitement pharmacologique et non hormonal des bouffées de chaleur chez les femmes atteintes d’un cancer du sein. Juin 2012, nr. 3. Bibliothèque et Archives nationales du Québec (Canada), 2012.
Chlebowski RT, Hendrix SL, Langer RD, et al as WHI Investigators. Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women: the Women's Health Initiative Randomized Trial. JAMA, 2003, Jun 25; 289, 24: 3243-3253.
Cobin RH, Goodman NF; AACE Reproductive Endocrinology Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology position statement on menopause-2017 update. Endocr Pract., 2017, Jul; 23, 7: 869-880.
Coker LH, Hogan PE, Bryan NR,et al. For the Women's Health Initiative Memory Study. Postmenopausal hormone therapy and subclinical cerebrovascular disease. The WHIMS-MRI Study. Neurology, 2009, 72, 2: 125-134.
Committee on Gynecologic Practice. Committee Opinion No. 698: Hormone therapy in primary ovarian insufficiency. Obstet Gynecol., 2017, May; 129, 5: e134-e141.
Danforth KN, Tworoger SS, Hecht JL,Rosner BA, Colditz GA, Hankinson SE. A prospective study of postmenopausal hormone use and ovarian cancer risk. Br J Cancer, 2007, Jan 15; 96, 1: 151–156.
Delaney J, Lupton MJ, Toth E. The Curse: A cultural history of menstruation. University of Illinois Press. Urbana & Chicago. 1988.
Dennerstein L, Lehert P, Burger HG, Guthrie JR. New findings from non-linear longitudinal modelling of menopausal hormone changes. Human Reproduction Update, 2007, 13, 6: 551–557.
Fagerholm R, Faltinova M, Aaltonen K, et al. Family history influences the tumor characteristics and prognosis of breast cancers developing during postmenopausal hormone therapy. Fam Cancer, 2017, Oct 10; 1-11.
Grady D, Herrington D, Bittner V, et al; HERS Research Group. Cardiovascular disease outcomes during 6.8 years of hormone therapy: Heart and Estrogen/progestin Replacement Study follow-up (HERS II). JAMA, 2002, Jul 3; 288, 1: 49-57.
Gurney EP, Nachtigall MJ, Nachtigall LE, Naftolin F. The Women's Health Initiative trial and related studies: 10 years later: a clinician's view. J Steroid Biochem Mol Biol., 2014, Jul; 142: 4-11.
Henderson VW, St John JA, Hodis HN, et al. Cognitive effects of estradiol after menopause: A randomized trial of the timing hypothesis. Neurology, 2016, Aug 16; 87, 7: 699-708.
Hodis HN, Mack WJ. Postmenopausal hormone therapy and cardiovascular disease in perspective. Clin Obstet Gynecol., 2008, Sep; 51, 3: 564–580.
Hodis HN, Mack WJ. The timing hypothesis and hormone replacement therapy: a paradigm shift in the primary prevention of coronary heart disease in women. Part 1: comparison of therapeutic efficacy. J Am Geriatr Soc., 2013, Jun; 61, 6: 1005-1010.
Hodis HN, Collins P, Mack WJ, Schierbeck LL. The timing hypothesis for coronary heart disease prevention with hormone therapy: past, present and future in perspective. Climacteric, 2012, Jun; 15, 3: 217-228.
Imtiaz B, Tuppurainen M, Rikkonen T, et al. Postmenopausal hormone therapy and Alzheimer disease: A prospective cohort study. Neurology, 2017, Mar 14; 88, 11: 1062-1068.
Iorga A, Cunningham CM, Moazeni S, et al. The protective role of estrogen and estrogen receptors in cardiovascular disease and the controversial use of estrogen therapy. Biol Sex Differ., 2017, Oct 24; 8, 1: 33.
Jakiel G, Makara-Studzińska M, Ciebiera M, Słabuszewska-Jóźwiak A. Andropause - state of the art 2015 and review of selected aspects. Prz Menopauzalny., 2015, Mar;14, 1: 1-6.
Javed AA, Mayhew AJ, Shea AK, Raina P. Association between hormone therapy and muscle mass in postmenopausal women. A systematic review and meta-analysis. JAMA Network Open, 2019; 2, 8: e1910154.
Johnson J, Bagley J, Skaznik-Wikiel M, et al. Oocyte generation in adult mammalian ovaries by putative germ cells in bone marrow and peripheral blood. Cell, 2005, Jul 29; 122, 2: 303-315.
Kingsberg S. Testosterone treatment for hypoactive sexual desire disorder in postmenopausal women. J Sex Med., 2007, Mar; 4, Suppl 3: 227-234.
Lee JSA, Yaffe K, Lui LY, et al for the Study of Osteoporotic Fractures Group. Prospective study of endogenous circulating estradiol and risk of stroke in older women. Arch Neurol., 2010, Feb; 67, 2: 195–201.
Lobo RA, Bélisle S, Creasman WT, et al. Should symptomatic menopausal women be offered hormone therapy? Med.Gen.Med., 2006, August 16; 8, 3: 40-56.
Lu Y, Sareddy GR, Wang J, Wang R, Li Y, Dong Y, Zhang Q, Liu J, OConnor J, Xu J, Vadlamudi RK, Brann D. J Neurosci. 2019 Feb 6. pii: 1970-18.
Neuron-Derived Estrogen Regulates Synaptic Plasticity and Memory.
Lukes A. Evolving issues in the clinical and managed care settings on the management of menopause following the women's health initiative. J Manag Care Pharm., 2008, Apr; 14, 3 Suppl: 7-13.
MacGregor EA. Migraine, menopause and hormone replacement therapy. Post Reprod Health, 2017, Jan 1: 2053369117731172.
Manson JE, Hsia J, Johnson KC, et al. Estrogen plus progestin and the risk of coronary heart disease. N Eng J Med., 2003, 349, 6: 523–534.
Manson JE, Aragaki AK, Rossouw JE, et al as WHI Investigators. Menopausal Hormone Therapy and Long-term All-Cause and Cause-Specific Mortality: The Women's Health Initiative Randomized Trials. JAMA, 2017, Sep 12; 318, 10: 927-938.
Marjoribanks J, Farquhar C, Roberts H, Lethaby A, Lee J. Long-term hormone therapy for perimenopausal and postmenopausal women. Cochrane Database Syst Rev., 2017, Jan 17; 1: CD004143.
Martinelli I, Lensing AW, Middeldorp S, et al. Recurrent venous thromboembolism and abnormal uterine bleeding with anticoagulant and hormone therapy use. Blood, 2016, Mar 17; 127, 11: 1417-25.
Milcu SM, Dănilă-Muster A. Endocrinologie ginecologică. Edit. Academiei RSR (Buc.), 1968.
Miyamoto M, Kotani K, Taniguchi N. Effect of non-antihypertensive drugs on endothelial function in hypertensive subjects evaluated by flow-mediated vasodilation. Curr Vasc Pharmacol., 2015, 13, 1: 121-127.
Monda V, Salerno M, Fiorenzo M, et al. Role of sex hormones in the control of vegetative and metabolic functions of middle-aged women. Front Physiol., 2017, Oct 4; 8: 773.
Nelson HD. Commonly used types of postmenopausal estrogen for treatment of hot flashes. Scientific review. JAMA, 2004, April 7; 291, 13: 1610-1620
Notelovitz M. Clinical Opinion: The biologic and pharmacologic principles of estrogen therapy for symptomatic menopause. Med GenMed., 2006, 8, 1: 85.
Ojanlatva A, Mäkinen J, Helenius H, Korkeila K, Sundell J, Rautava P. Sexual activity and perceived health among Finnish middle-aged women. Health Qual Life Outcomes, 2006, May 10; 4: 29-39.
Parish SJ, Gillespie JA. The evolving role of oral hormonal therapies and review of conjugated estrogens/bazedoxifene for the management of menopausal symptoms. Postgrad Med., 2017, Apr; 129, 3: 340-351.
Patasius A, Kincius M, Kazlauskas E, Smailyte G. The role of androgen-deprivation therapy on suicide among patients with advanced prostate cancer: A nationwide population-based cohort study. Psychooncology. 2019 Jul 30.
Pereţianu D, Saragea M. Imunitatea în teoria şi practica medicinii. Vol.I. Editura ALL, Bucureşti, 1996.
Pereţianu D. Viagra – o viziune integratoare. Viaţa Medicală (Buc.), 2003, Partea I-a: 15, 39: 8. Partea II-a: 40: 8. Partea III-a: 15, 41: 8.
Pereţianu D., Poiană C., Carşote M. Controversele iodului din sare. Viaţa Medicală (Buc.), 2015, 27, 37 (1339): 3.
Pereţianu D, Aurelian Grigorescu. Unitatea operatională hormon-receptor. Criteriul pentru clasificarea fiziopatologică a bolilor endocrine. Medica Academica (Buc), 2016, Partea I-a: 8, 64 (1): 28-36. Partea a II-a: 8, 65 (2): 32-38. Partea a III-a: 8, 66 (3): 32-37.
Pereţianu D, Poiană C. Controverse legate de DEXA. Viaţa Medicală (Buc.), 2016, 28, 7 (1361): 3.
Pereţianu D, Mara Carşote, Matei Pisoschi, Dan Cristina Staicu, Bogdan Oprişan. Testosteronul. O apreciere după 10 ani de observaţii de tratament depot 1000 mg. Medica Academica (Buc.), Partea I-a: 2017, 9, 76 (4): 20-25. Partea II-a: 2017, 9, 77 (5): 24-34.
Pereţianu D. Comportamentul sexual, definit la naştere şi condiţionat biochimic. Viaţa Medicală (Buc.), 2017, 29, 34 (1440): 6.
Peters GN, Fodera T, Sabol J, Jones S, Euhus D. Estrogen replacement therapy after breast cancer: a 12-year follow-up. Ann.Surg.Oncol., 2001, 8, 10: 828–832.
Pu D, Tan R, Yu Q, Wu J. Metabolic syndrome in menopause and associated factors: a meta-analysis. Climacteric, 2017, Oct 24: 1-9.
Qaseem A, Forciea MA, McLean RM, Denberg TD; Clinical Guidelines Committee of the American College of Physicians. Treatment of low bone density or osteoporosis to prevent fractures in men and women: a clinical practice guideline update from the American College of Physicians. Ann Intern Med., 2017, Jun 6; 166, 11: 818-839.
Reid BM, Permuth JB, Sellers TA. Epidemiology of ovarian cancer: a review. Cancer Biol Med., 2017, Feb; 14, 1: 9–32.
Rennert G, Rennert HS, Pinchev M, Lavie O, Gruber SB. Use of hormone replacement therapy and the risk of colorectal cancer. J Clin Oncol., 2009, Sep 20; 27, 27: 4542–4547.
Resnick SM, Espeland MA, Jaramillo SA, et al. Postmenopausal hormone therapy and regional brain volumes. The WHIMS-MRI Study. Neurology, January 13; 2009, 72, 2: 135-142.
Riecher-Rössler A, de Geyter C. The forthcoming role of treatment with oestrogens in mental health. Swiss Med Wkly, 2007, 137: 565–572.
Seelig, MS, Altura BM, Altura BT. Benefits and risks of sex hormone replacement in postmenopausal women. J. Amer. College Nutrition, 2004, 23, 5, 482S–496S.
Shekhar S, Travis OK, He X, Roman RJ, Fan F. Menopause and ischemic stroke: a brief review. MOJ Toxicol., 2017; 3, 4. pii: 00059.
Simin J, Tamimi R, Lagergren J, Adami HO, Brusselaers N. Menopausal hormone therapy and cancer risk: An overestimated risk? Eur J Cancer, 2017, Oct; 84: 60-68.
Simon J, Braunstein G, Nachtigall L, et al. Testosterone patch increases sexual activity and desire in surgically menopausal women with hypoactive sexual desire disorder. J Clin Endocrinol Metab, 2005, 90, 9: 5226–5233.
Simon J, Nachtigall L, Ulrich LG, Eugster-Hausmann M, Gut R. Endometrial safety of ultra-low-dose estradiol vaginal tablets. Obstet Gynecol., 2010, Oct; 116, 4: 876-883.
Singh A, Kaur S, Walia I. A historical perspective on menopause and menopausal age. Bull Indian Inst Hist Med Hyderabad, 2002, Jul-Dec; 32, 2: 121-135.
Spencer CP, Cooper AJ, Whitehead MI. Management of abnormal bleeding in women receiving hormone replacement therapy. BMJ, 1997, Jul 5; 315, 7099: 37–42.
Stachowiak G, Pertyński T, Pertyńska-Marczewska M. Effect of transdermal hormone therapy on platelet haemostasis in menopausal women. Ann Agric Environ Med., 2015, 22, 1: 167-71.
Taylor HS, Tal A, Pal L, et al. Effects of Oral vs Transdermal Estrogen Therapy on Sexual Function in Early Postmenopause: Ancillary Study of the Kronos Early Estrogen Prevention Study (KEEPS). JAMA Intern Med., 2017, Oct 1; 177, 10: 1471-1479.
Topi G, Ehrnström R, Jirström K, Palmquist I, Lydrup ML, Sjölander A. Association of the oestrogen receptor beta with hormone status and prognosis in a cohort of female patients with colorectal cancer. Eur J Cancer, 2017, Sep; 83: 279-289.
Vickers MR, MacLennan AH, Lawton B, et al. Main morbidities recorded in the women's international study of long duration oestrogen after menopause (WISDOM): a randomised controlled trial of hormone replacement therapy in postmenopausal women. BMJ, 2007, Aug 4; 335, 7613: 239-250.
Viuff MH, Berglund A, Juul S, Andersen NH, Stochholm K, Gravholt CH. Sex hormone replacement therapy in Turner Syndrome - impact on morbidity and mortality. J Clin Endocrinol Metab., 2019, Sep 23. pii: dgz039. doi: 10.1210.
White RE, Han G, Dimitropoulou C, Zhu S, Miyake K, Fulton D, Dave S, Barman SA. Estrogen-induced contraction of coronary arteries is mediated by superoxide generated in vascular smooth muscle. Am J Physiol Heart Circ Physiol., 2005, Oct; 289, 4: H1468-75.
Williams MS, Vaidya D, Kickler T, Ouyang P. Long-term hormone replacement therapy does not cause increased platelet activation. Am Heart J., 2005, Sep; 150, 3: 434-438.
Women's Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy. The Women's Health Initiative randomized controlled trial. JAMA, 2004; Apr 14; 291, 14: 1701–1712.
Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA, 2002; 288: 321-333.
Wylie KR. Sexuality and the menopause. J Br Menopause Soc., 2006, Dec; 12, 4: 149-152.
Yang FL, Hu KQ, Wang X, Liu ZM, Hu Q, Li JF, He H. Combination of raloxifene, aspirin and estrogen as novel paradigm of hormone replacement therapy in rabbit model of menopause. Acta Pharmacol Sin., 2011, Aug; 32, 8: 1031–1037.
Ycaza Herrera A, Hodis HN, et al. Estradiol therapy after menopause mitigates effects of stress on cortisol and working memory. J.Clin.Endocrinol.Metab., 2017, Nov 2; DOI: 10.1210/jc.2017-00825.
http://www.menopause.org/docs/default-source/default-document-library/cardiac-risk-from-discontinuing-ht-11-8-17.pdf.
www.menopause.org/docs/default-source/agm/nams18-regular-and-late-breaking-abstracts.
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe