
Din 2002, lumea medicală s-a împărţit în două: o parte consideră că estrogenii la menopauză fac rău, o alta caută să înţeleagă fenomenul şi să-i administreze în continuare.
 Se spune că bărbaţii sunt mai afectaţi de infarctul de miocard decât femeile pentru că au testosteron, iar femeile sunt protejate de estrogeni. Această paradigmă este folosită şi azi. În baza ei, mulţi au propus ca femeile la menopauză să primească estrogeni pentru a fi protejate de manifestările cardiovasculare. Ulterior, s-a arătat că bărbaţii care fac infarct au deficit de testosteron.
Se spune că bărbaţii sunt mai afectaţi de infarctul de miocard decât femeile pentru că au testosteron, iar femeile sunt protejate de estrogeni. Această paradigmă este folosită şi azi. În baza ei, mulţi au propus ca femeile la menopauză să primească estrogeni pentru a fi protejate de manifestările cardiovasculare. Ulterior, s-a arătat că bărbaţii care fac infarct au deficit de testosteron.
Ar părea că atât testosteronul, cât şi estradiolul sunt protectoare faţă de infarct. Dar până la un punct. Acest punct rămâne încă de stabilit, întrucât există numeroase studii care prezintă date conflictuale. Dar care a fost punctul de cotitură?
Totul a plecat de la Studiul Women Health Initiative (WHI), care a fost iniţiat în 1993 şi oprit pentru o ramură după 10 ani, în 2002 (WHI, 2002, 2004). Studiul a fost efectuat pentru a arăta că estrogenii la menopauză blochează apariţia accidentelor vasculare (mai ales infarctul de miocard).
A fost oprit pentru că estrogenii şi progesteronul administraţi au provocat creşteri ale prevalenţei infarctului de miocard şi a accidentelor vasculare cerebrale la femeile incluse, infirmând ipotezele de lucru. Până atunci, lucrurile mergeau liniştit: studiile asemănătoare pe problemă nu semnalau furtuna. Era vorba despre HERS (Heart and Estrogen/progestin Replacement Study) şi MWS (Million Women Study).
Din acel moment, 2002, lumea medicală s-a împărţit în două: o parte consideră că estrogenii la menopauză fac rău, o alta caută să înţeleagă fenomenul şi să administreze în continuare estrogeni de menopauză.
De aceea, deşi aparent lucrurile erau încheiate odată cu concluzia Comitetului WHI (Steering Committee), cercetările despre estrogenii la menopauză au explodat (vezi mai departe, precum şi bibliografia).
Surprinzător însă, la noi, majoritatea medicilor, precum şi a
pacientelor lor, refuză să administreze, respectiv să primească hormoni de frica de a nu dezvolta cancer de sân (vezi mai departe), şi nu infarct. Pentru a elucida şi frica, şi mecanismele, vă propun următoarea abordare.
Despre termenul „menopauză” se spune că a fost imaginat de către medicul francez Gardanne în 1812. Alţii afirmă că menopauza a fost „creată” în 1821 de către doctorul francez Charles Négrier (1792-1862) (vezi în Singh, 2002). Circa 160 de ani, medicina a considerat menopauza o boală.
Apoi, în urma descoperirilor ştiinţifice de după Al Doilea Război Mondial, când s-au produs şi primii hormoni ovarieni, lumea medicală a considerat menopauza „o stare”. Majoritatea medicilor consideră azi menopauza „o stare” fiziologică a evoluţiei femeii (Blacke, 2006, Riecher-Rössler, 2007, preluând definiţii ale International Menopause Society).
Menopauza este considerată chiar o stare „de tranziţie”, deşi nu se specifică spre ce se produce tranziţia. Din acest punct de vedere, menopauza ar fi oprirea permanentă a menstruaţiei, rezultând din pierderea funcţiei ovariene; perimenopauza ar fi perioada imediat anterioară menopauzei, când aspectele hormonale, biologice şi clinice ale menopauzei tocmai încep să se evidenţieze, până la terminarea primului an după menopauză; postmenopauza ar fi timpul de după menopauză.
Medicina a progresat. Prin acest progres, s-a aflat de ce uterul nu mai funcţionează pentru a produce menstra: lipsa de estrogeni ovarieni. Or, lipsa unor hormoni nu mai poate fi considerată „o stare”, ci „un sindrom” în cadrul unei boli!
Din nou trebuie să remarc că unii nu cunosc diferenţa dintre „o stare” şi „un sindrom”. În endocrinologie, funcţionarea unuia sau mai multor hormoni este definită ca sindrom, nu ca „stare”, şi nici ca „boală”, rezultând hipo-, hiper- sau normofuncţie (eu-). De exemplu, hipotiroidism, hipoestrogenism, hiposomatotropism, hiperparatiroidism,
hipercorticism etc.
Unii folosesc termenul „postmenopauză” pentru a scoate în evidenţă că fenomenele clinice avansează mult timp după ce se opreşte ciclul uterin. Aceiaşi folosesc termenul de perimenopauză, având criterii temporale, şi nicidecum patogenice sau fiziopatologice.
Ca o contra-argumentaţie la faptul că menopauza este o boală, unii folosesc termenul de boală legat de „insuficienţa ovariană prematură”, deşi patogenia și simptomatologia sunt aceleaşi („and also cause menopausal symptoms”).
Din punct de vedere patogenic, situaţia clinică este identică: hipoestrogenismul primar de vârstă. Boală este și lipsa estrogenilor la pacientele cu sindrom Turner, caracterizat patogenic prin lipsa ovarelor și definit genetic prin lipsa unui cromozom X.
La aceste femei, aflate la „menopauză” de la naștere, administrarea de hormoni estrogeni a condus la creșterea speranţei de viaţă, prin scăderea prevalenţei diabetului zaharat, a fracturilor osteoporotice și a accidentelor vasculare cerebrale (Mette H. Viuff, 2019)!
Un alt argument pentru a vedea menopauza ca o boală este numărul de ovocite potenţial produse de ovare şi totalitatea ovulelor care au fost folosite în viaţa femeii. Se afirmă că ovarele sunt construite pentru a produce 0,5-1 milion de ovocite/ovule, observabile la naştere.
La pubertate, se estimează un potenţial funcţional de 300.000 de ovule/ovocite (Johnson, 2005). Din acestea pot fi folosite, între 12 ani şi 57 de ani – adică 45 de ani x 12 luni – maximum 540. Ar însemna 0,05%-0,1% din potenţialul de la naştere sau 0,18% din potenţialul de la pubertate.
Ceea ce nu este caracteristic rezervelor funcţionale ale nici unui organ sau ţesut al organismului. În plus, s-a arătat că mamiferele (experimental, datele sunt obţinute de la şoareci) au capacitatea de a produce ovocite pe toată durata vieţii (Johnson, 2005)!
Estrogenii sunt hormoni de tip steroid. Ei acţionează local, la nivelul locului de secreţie, ovarul, şi sistemic, în tot organismul. În plus faţă de rolul lor convenit în reproducere, estrogenii acţionează fiziologic pentru a menţine sănătatea și funcţia normală a diferitelor organe considerate „ţintă”, cum ar fi creierul, inima și osul.
Cantitatea de estrogeni sintetizată scade semnificativ la/după menopauză. Cu toate acestea, nivelurile de estrogeni nu sunt epuizate. Sinteza și metabolismul estrogenilor postmenopauzali continuă în organele-ţintă, cu niveluri intratisulare ale steroizilor mai mari decât cele măsurate periferic.
Gradul în care se produce acest fenomen diferă de la femeie la femeie și, în cadrul aceluiaşi organism, de la organ la organ. În plus, fiecare organ pare să aibă un prag nedefinit la estrogeni, prag sub care se va manifesta un simptom legat de deficitul de estrogeni, în funcţie de modelul experimental sau observaţional adoptat.
Acest lucru explică parţial simptomatologia variabilă observată la femeile menopauzale și răspunsul lor diferit la o doză standard de terapie cu estrogeni (Notelovitz, 2006). În mod fiziologic, în organism există trei astfel de hormoni estrogeni: estradiolul, estriolul şi estrona. Lor li se adaugă progesteronul şi androgenii.
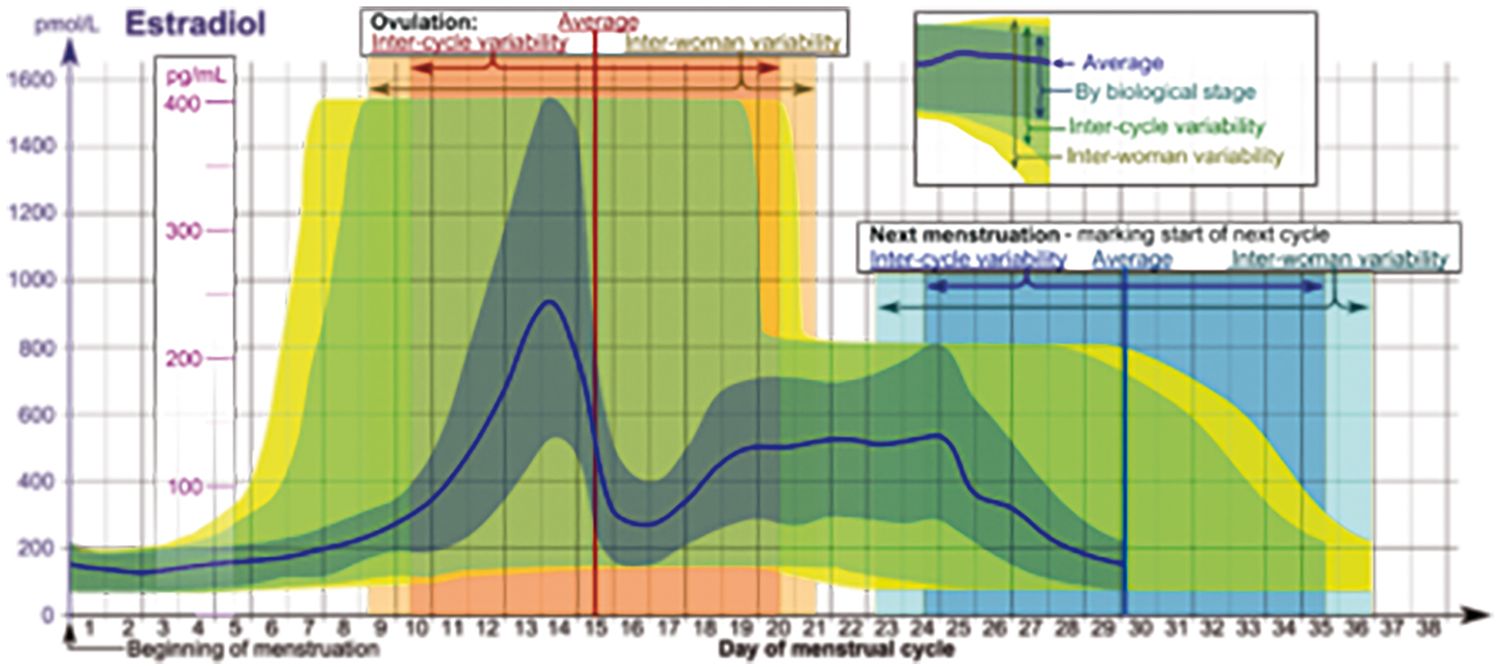
Estradiolul este produs în ovar în celulele foliculare, care preiau testosteronul de la celulele stromale şi îl „aromatizează” în poziţia 3. O parte din estradiol provine din estronă. Estradiolul (E2) reprezintă circa 90% din estrogenii circulanţi, nivelul plasmatic fiind variabil, între 50 pmol/l (zilele 1-2-3) şi 200 pmol/l, în faza nonovulativă, şi până la 1.500-2.000 pmol/l la ovulaţie (Figura 2).
Estradiolul a fost identificat în 1933. Prima injecţie cu scop terapeutic, estradiol benzoat, a fost produsă în 1936 de Schering AG. Etinilestradiolul a fost fabricat prima dată tot de Schering în 1938, când a fost şi introdus în terapie sub formă de anticoncepţionale.
Al doilea estrogen natural este estrona (E1), un „testosteron invers”, o cetonă. Nivelul plasmatic este între 60 pmol/l şi 750 pmol/l (la peakul ovulator). Estrona este sintetizată din precursorul testosteronului numit androstendion și este primul estrogen identificat, în 1929, şi primul care s-a administrat în ovarectomie, sub formă de injecţii (TheelinR).
Estrona este considerată „a doua”, deşi apare în aceleaşi concentraţii, pentru că, la nivel nuclear, nu există receptori pentru estronă, ci pentru estradiol.Estriolul (E3) este al treilea estrogen natural. Este un estradiol cu încă o grupare –OH, în poziţia 16. Nivelul sanguin este foarte mic, între 20 pmol/l şi 40 pmol/l.
Nivelul estriolului creşte în sarcină de circa 1.000 de ori, fără o explicaţie fiziologică clară. Ante-menopauză, raportul E2/E1 este în favoarea E2. În postmenopauză creşte E1.
Nivelul de depleţie estrogenică la menopauză este extrem de individual, pentru că organismul are posibilitatea să convertească steroizii în estradiol. Mai ales androgenii produşi de stroma ovariană (androstendion şi testosteron) şi de reticulara corticosuprarenalei (DHEA).
Nivelul de activitate al estrogenilor este dependent şi de reactivitatea receptorială. Recepţia estrogenilor se face sub forma a doi receptori pentru estradiol (ER), numiţi alfa şi beta (ERa şi ERb) (Pereţianu, 2016).
Repartiţia celulară a acestora este individuală, la fel şi efectivitatea lor. De exemplu, la nivelul sistemului nervos central, celulele gabaergice sunt sensibile la estrogeni prin ERa (Pereţianu, 2017). Lipsa „controlului progestativ” asupra estrogenilor conduce la apariţia cancerului endometrial (Blacke, 2006).
Din punct de vedere al densităţii receptorilor, următoarele organe pot fi considerate ca „superţintă”: creierul, ficatul, ţesutul adipos, sistemul cardiovascular, osul, pielea, intestinul, sistemul imun
(limfocite) (Barakat, 2016).
La nivelul coronarelor, efectul E2 (White, 2006) diferă în funcţie de factorii de mediu, vasodilatatori sau vasoconstrictori adiacenţi (vezi Figura 3). Efectul E2 asupra endoteliului arterelor coronare (experiment pe porc) (White, 2006): A. După injectarea a 10 mmol de PGF2a, un puternic contracturant, s-au administrat până la 1.000 nmoli 17bE2. Efectul E2 este vasodilatator, de blocare a contractării. B.
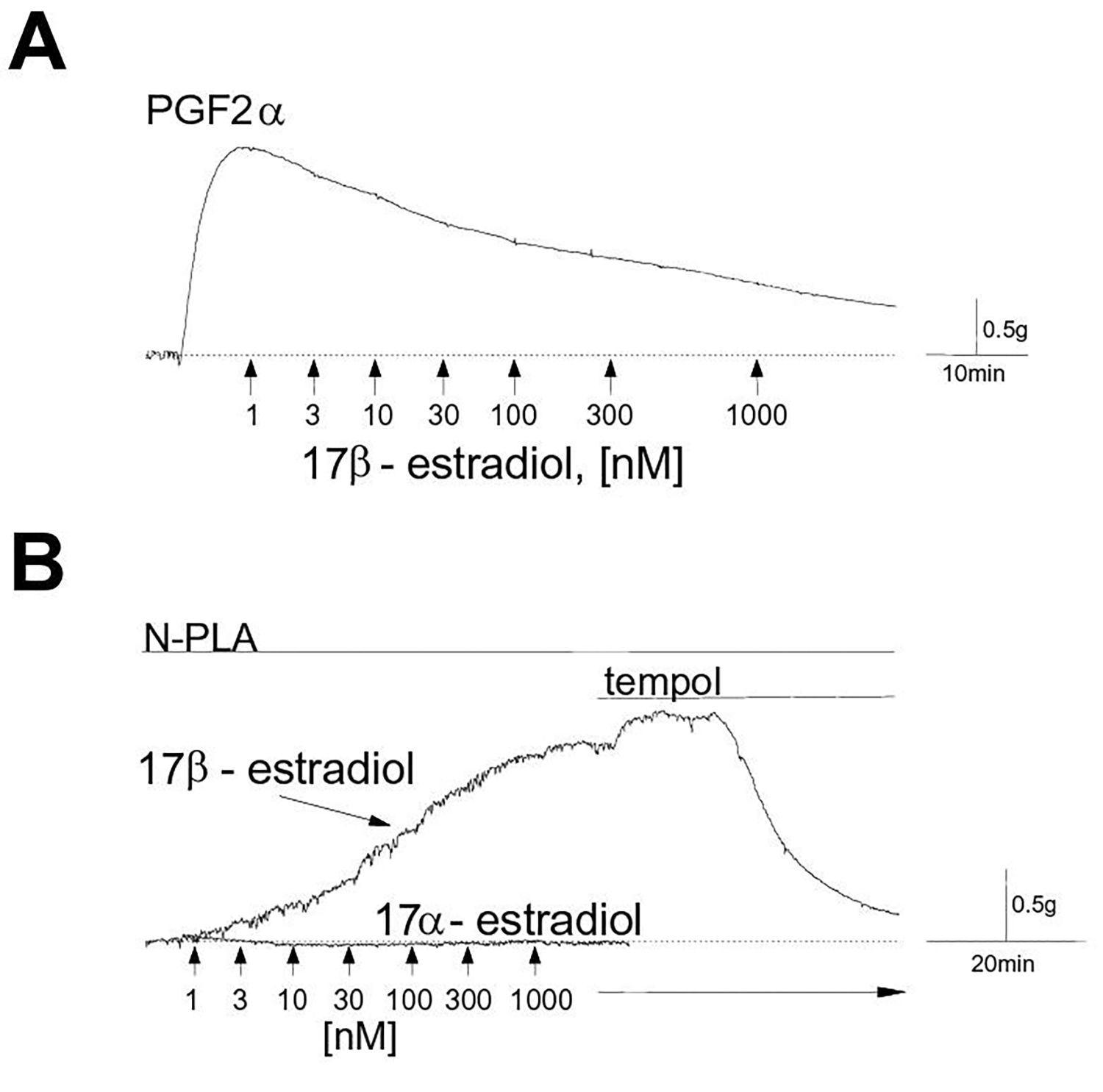
După blocarea cu propil-arginină a dilataţiei coronare prin oxid nitric, administarea de 17bE2 produce vasoconstricţie; în lipsa NO, 17aE2 nu posedă acest efect, adică este direct vasodilatator. Acest experiment arată de ce există rezultate inconstante la administrarea de estrogeni în menopauză.
Prezenţa ERb la nivelul colonului are efect antiproliferativ şi pro-apoptotic (Topi, 2017), fapt ce poate sugera efectul pozitiv al estrogenilor asupra mucoasei intestinale. Unul din cele mai importante organe-ţintă pentru estrogeni este creierul.
În plus, la acest nivel, testosteronul se aromatizează la estradiol, proces prin care se condiţionează comportamentul sexual masculin, libidoul şi reglarea gonadotropilor [Pereţianu, 2015]).
Lipsa aromatizării conduce la scăderea libidoului sau la comportamente homosexuale. Lipsa de estradiol, precum cea care survine la menopauză, conduce la creşterea riscului de accidente cerebrale (Lee, 2010). Mai mult, s-a arătat că estradiolul administrat culturilor de neuroni conduce la creşterea numărului, a sinapselor, a mielinizării şi a conectivităţii între neuroni (Figura 4) (Riechter-Rössler, 2007).
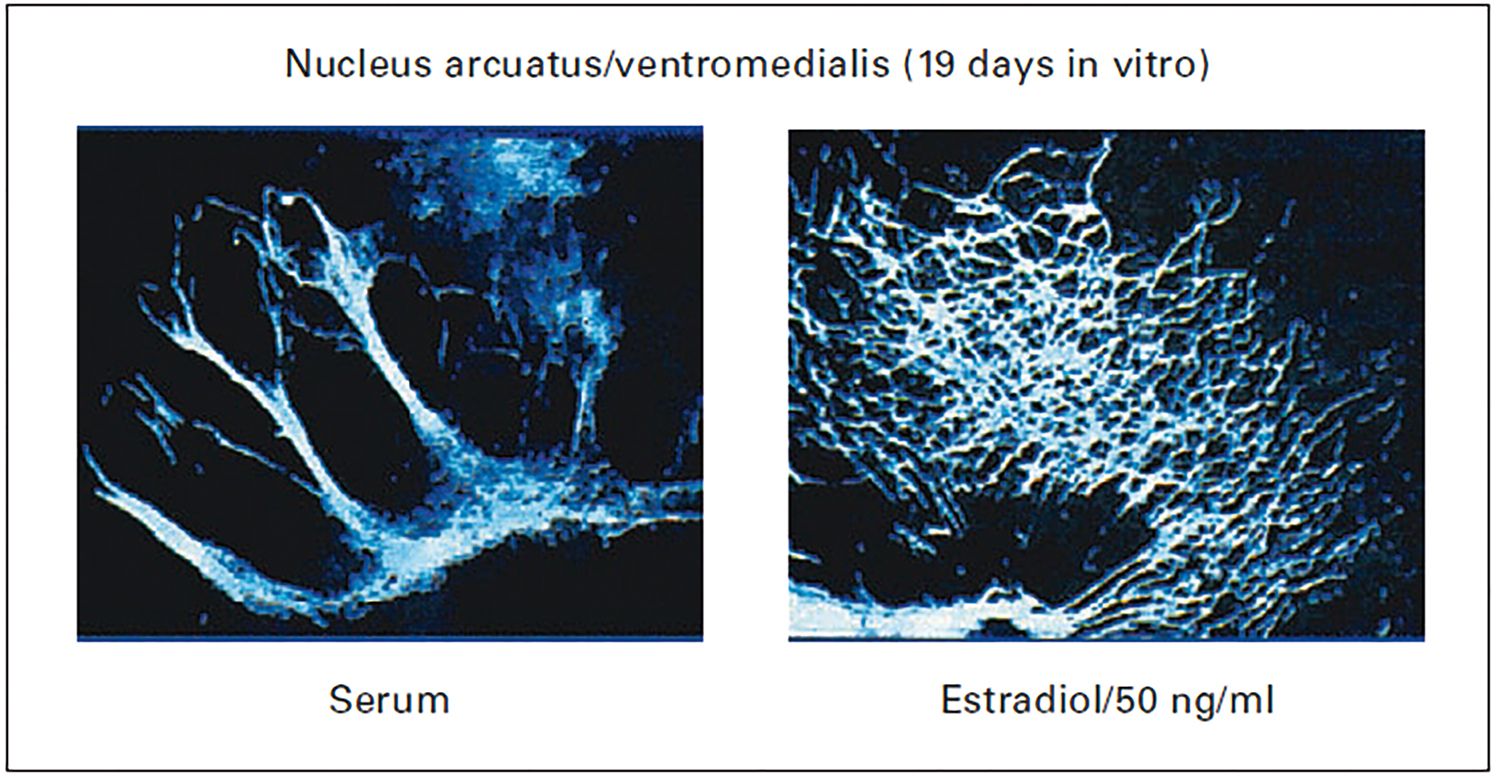
Estradiolul este considerat un factor de stimulare a celulelor progenitoare (Carreau, 2003) la nivelul hipocampului. Or, lipsa acestor celule pare a sta la baza patogeniei bolii Parkinson şi a bolii Alzheimer. Se pare că aceste efecte protective apar prin stimularea ER de tip a (Shekhar, 2017).
Un alt mecanism de neuroprotecţie este cel prin care E2 produce vasodilataţie cerebrală (Shekhar, 2017) (Figura 5). Tot la nivelul unui ţesut pericerebral are loc şi procesul de feedback dintre gonadotropi şi estradiol. La nivelul hipofizei, estradiolul blochează activitatea celulelor hipofizare gonadotrope (producătoare de LH şi FSH), prin intermediul ER.
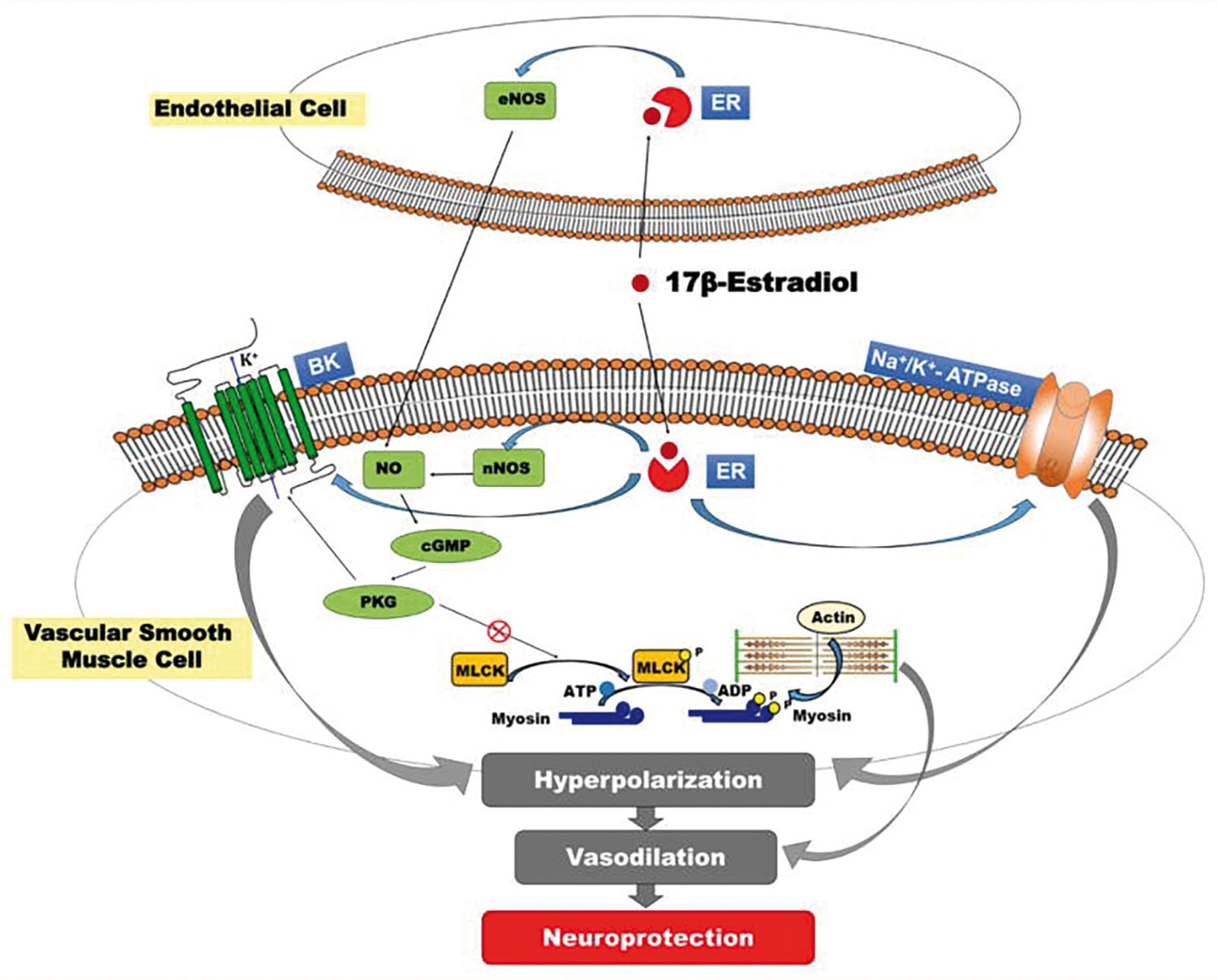
Tot aici, lipsa aromatizării de la testosteron la estradiol conduce la creşterea gonadotropilor. De aceea, creşterea LH/FSH înseamnă hipoproducţie estrogenică, fie generală, fie locală. Mucoasele sunt un important ţesut-ţintă, mai ales la nivelul limfocitelor B de la acest nivel. E2 stimulează preferenţial IgA de tip secretor (Pereţianu, 1996).
Cercetări recente (Lu, 2019) demonstrează că memoria și cogniţia sunt susţinute, la nivel neuronal, de procesul de aromatizare locală a estradiolului, cel mai frecvent din testosteron.
Blocarea aromatizării cu medicamente anticancer de sân, precum anastrozolul, scade puternic memoria. În plus, scăderea testosteronemiei prin blocarea chimică a testiculului în cancerul de prostată conduce la depresie (Patasius, 2019) tot prin intermediul scăderii aromatizării neuronale la estradiol.
Este hipoestrogenismul un sindrom, aşa cum este hipotiroidismul? Răspunsul este „Da!”. Atunci când apare înaintea vârstei de
50-55 ani, se numeşte „insuficienţă ovariană” (Committee on Gynecologic Practice, 2017) și beneficiază de tratament adecvat. Manifestarea „finală” a sindromului este de fapt „menopauza”.
Hipotiroidismul evidenţiat la vârstnici nu este „o stare”, ci un sindrom, în timp ce hipoestrogenismul de vârstă (menopauza) este considerat „o stare”? Ceva nu este în regulă. Un alt exemplu este hiposomatotropismul de vârstă, care este considerat un sindrom, nu „o stare”.
Din aceste puncte de vedere, există terapii anti-aging care folosesc hormoni somatotropi, hormoni tiroidieni, şi mai nou, hormoni sexuali. Cu alte cuvinte, menopauza este manifestarea unui sindrom, și anume a hipoestrogenismului.
Întrebarea a fost şi este: „În ce moment apare sindromul numit hipoestrogenism?”. Se ştie că nivelul de estrogeni scade cu vârsta. Comparăm din nou cu ceea ce se întâmplă în organism în cazul sindromului hipotiroidism: se consideră că dacă FT4 scade sub 10 pmol/l şi TSH creşte la peste 4 UI/ml, diagnosticul de hipotiroidism clinic este valid; în caz că FT4 nu a scăzut sub 10 pmol/l, diagnosticul de sindrom este hipotiroidism subclinic.
Evident că aceste sindroame sunt de fapt biologice, şi nu clinice, întrucât este posibil să nu existe semne de hipotiroidism. Care este nivelul la care se poate considera hipoestrogenism? Evident, elementul definitoriu al sindromului este nivelul de gonadotropi, corelativ semantic ca nivelul de tireotrop pentru hipotiroidism (Figura 6).
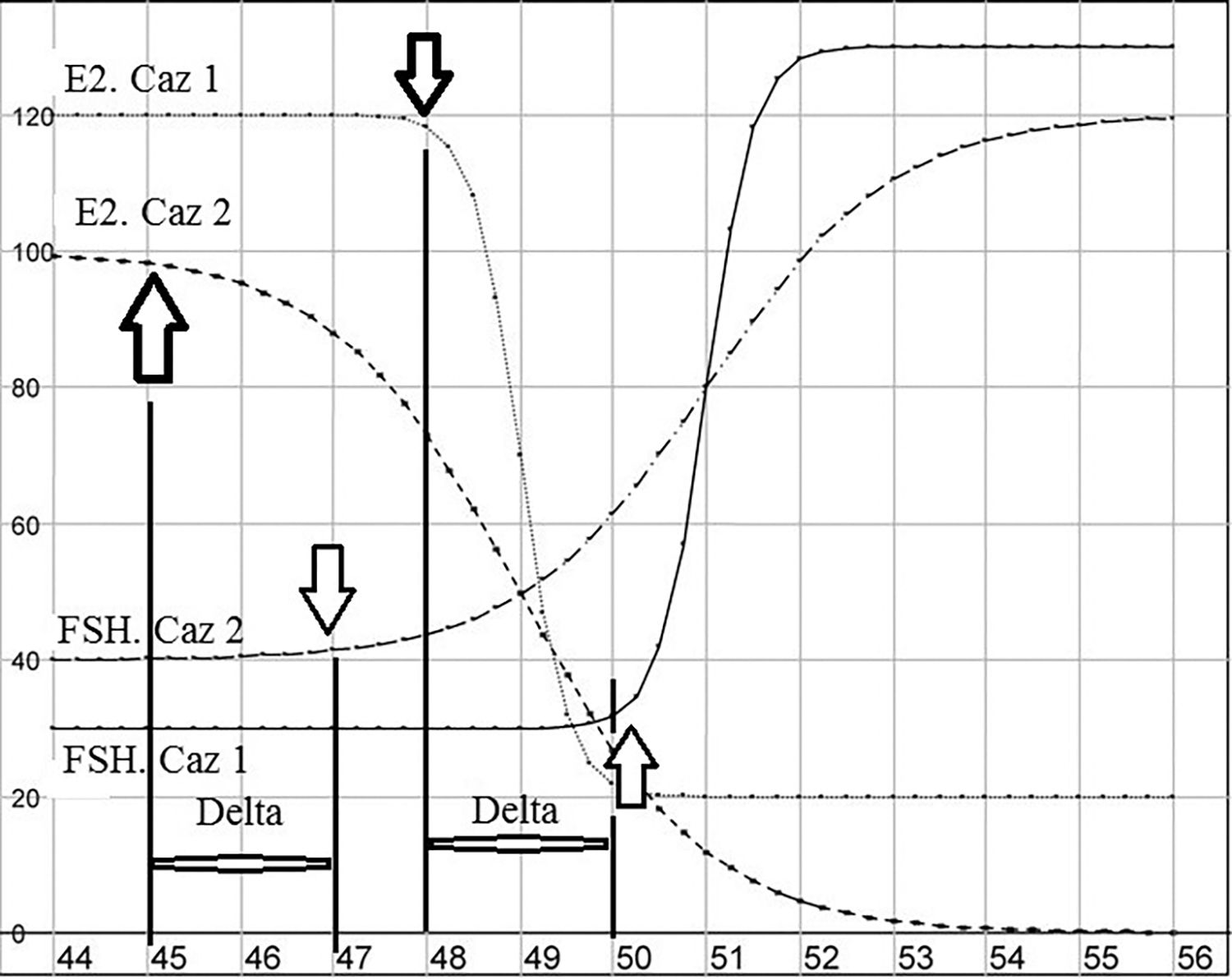
Relaţia E2-FSH pare a fi puţin diferită de cea dintre FT4 şi TSH. În hipotiroidism, mai întâi creşte TSH, FT4 rămâne o perioadă normal; fenomenul se numeşte hipotiroidism subclinic. Relaţia E2-FSH este inversă: FSH creşte după ce E2 este evident scăzut.
Dar, din figura anterioară mai rezultă un fenomen: scăderea este extrem de individuală, atât în ceea ce priveşte cantitatea de la care se scade, cât şi modelul scăderii. Intervalul între inflexiunea de scădere a E2 şi inflexiunea de creştere a FSH este de aproximativ doi ani (Dennerstein, 2007).
Dacă LH/FSH sunt crescuţi peste 12 UI/ml, atunci organismul este în hipogonadism primar de cauză ovariană (evident, în afara ovulaţiei, unde LH/FSH cresc). Sau, cu alte cuvinte, interpretarea clinică este următoarea: dacă o femeie în „premenopauză” este diagnosticată cu hiper-LH-emie şi hiper-FSH-emie, ea este în hipoestrogenism, chiar dacă estradiolemia este „normală”. Corelativ cu terminologia folosită pentru tiroidă, în acest caz ar trebui să vorbim de hipoestrogenism subclinic!
Sindromul numit „menopauză” nu trebuie privit ca apanajul uterului, ci trebuie luate în considerare manifestările clinice ale tuturor organelor considerate ţintă pentru estrogeni, corelate cu nivelul biologic al gonadotropilor.
Suferinţa acestor organe asociată cu hipoestrogenismul (relativ) trebuie afirmată în cadrul sindromului numit „menopauză”. În „premenopauză” mecanismul patogenic este acelaşi: hipoestrogenismul ovarian. Ceea ce trebuie să ne facă să susţinem poziţia definirii patogenice, şi nu temporale.
În ce moment scad cogniţia şi memoria, corelativ cu nivelul estradiolului, pentru a putea afirma că fenomenul este asociat menopauzei? S-a arătat că fenomenul apare cu 3-4 ani înainte de oprirea (pauza) menstrei. În ce moment începe osul să piardă masă osoasă, fenomen pus acum pe seama scăderii estradiolului?
S-a arătat că fenomenul apare cu circa 2-3 ani înainte de oprirea menstrei. În ce moment pielea începe să se deshidrateze şi hiperpigmentarea de vârstă să se evidenţieze, fenomen legat de hipoestrogenism? Semnul clinic apare cu 5-6 ani înainte de oprirea menstrei.
De altfel, toate semnele şi simptomele legate de menopauză apar atunci când nivelul estradiolului scade sub limita de inflexiune (vezi mai sus). Corelaţia clinică este valabilă numai pentru E2, nu şi pentru gonadotropi (Dennerstein, 2007). Însă gonadotropii sunt importanţi în a afirma diagnosticul de sindrom numit hipoestrogenism primar – de exemplu, de cauză ovariană.
Privind empiric problema, în final apar întrebările:
- este valabil tratamentul cu estrogenice atunci când ovarul îşi sistează activitatea estrogenică?
- când se începe tratamentul cu estrogeni? Poate fi corelat momentul introducerii estroterapiei cu momentul în care apar primele semne ale hipoestrogenismului?
Citește și: Rolul hormonilor sexuali feminini la menopauză (2)
Bibliografie articol versiunea integrală:
Anderson GL, Judd HL, Kaunitz AM, et al. Effects of estrogen plus progestin on gynecologic cancers and associated diagnostic procedures: the Women's Health Initiative randomized trial. JAMA, 2003, 290: 1739–1748.
Barakat R, Oakley O, Kim H, Jin J, Ko CJ. Extra-gonadal sites of estrogen biosynthesis and function. BMB Rep., 2016, Sep; 49, 9: 488-496.
Bardia A, Olson JE, Vachon CM et al. Effect of aspirin and other nsaids on postmenopausal breast cancer incidence by hormone receptor status: results from a prospective cohort study. Breast Cancer Res Treat., 2011, Feb; 126, 1: 149–155.
Basaria S, Dobs AS. Clinical review: Controversies regarding transdermal androgen therapy in postmenopausal women. J Clin Endocrinol Metab., 2006 91, 12: 4743–4752.
Blake J. Menopause: evidence-based practice. Best Pract Res Clin Obstet Gynaecol., 2006, Dec; 20, 6: 799-839.
Braunstein GD. Commentary: The Endocrine Society Clinical Practice Guideline and The North American Menopause Society position statement on androgen therapy in women: another one of Yogi’s forks. J Clin Endocrinol Metab., 2007, 92, 11: 4091-4093.
Carreau S, Lambard S, Delalande C, et al. Aromatase expression and role of estrogens in male gonad : a review. Reprod Biol Endocrinol., 2003, Apr 11; 1: 35.
Comité de l’évolution des pratiques en oncologie (CEPO). Traitement pharmacologique et non hormonal des bouffées de chaleur chez les femmes atteintes d’un cancer du sein. Juin 2012, nr. 3. Bibliothèque et Archives nationales du Québec (Canada), 2012.
Chlebowski RT, Hendrix SL, Langer RD, et al as WHI Investigators. Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women: the Women's Health Initiative Randomized Trial. JAMA, 2003, Jun 25; 289, 24: 3243-3253.
Cobin RH, Goodman NF; AACE Reproductive Endocrinology Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology position statement on menopause-2017 update. Endocr Pract., 2017, Jul; 23, 7: 869-880.
Coker LH, Hogan PE, Bryan NR,et al. For the Women's Health Initiative Memory Study. Postmenopausal hormone therapy and subclinical cerebrovascular disease. The WHIMS-MRI Study. Neurology, 2009, 72, 2: 125-134.
Committee on Gynecologic Practice. Committee Opinion No. 698: Hormone therapy in primary ovarian insufficiency. Obstet Gynecol., 2017, May; 129, 5: e134-e141.
Danforth KN, Tworoger SS, Hecht JL,Rosner BA, Colditz GA, Hankinson SE. A prospective study of postmenopausal hormone use and ovarian cancer risk. Br J Cancer, 2007, Jan 15; 96, 1: 151–156.
Delaney J, Lupton MJ, Toth E. The Curse: A cultural history of menstruation. University of Illinois Press. Urbana & Chicago. 1988.
Dennerstein L, Lehert P, Burger HG, Guthrie JR. New findings from non-linear longitudinal modelling of menopausal hormone changes. Human Reproduction Update, 2007, 13, 6: 551–557.
Fagerholm R, Faltinova M, Aaltonen K, et al. Family history influences the tumor characteristics and prognosis of breast cancers developing during postmenopausal hormone therapy. Fam Cancer, 2017, Oct 10; 1-11.
Grady D, Herrington D, Bittner V, et al; HERS Research Group. Cardiovascular disease outcomes during 6.8 years of hormone therapy: Heart and Estrogen/progestin Replacement Study follow-up (HERS II). JAMA, 2002, Jul 3; 288, 1: 49-57.
Gurney EP, Nachtigall MJ, Nachtigall LE, Naftolin F. The Women's Health Initiative trial and related studies: 10 years later: a clinician's view. J Steroid Biochem Mol Biol., 2014, Jul; 142: 4-11.
Henderson VW, St John JA, Hodis HN, et al. Cognitive effects of estradiol after menopause: A randomized trial of the timing hypothesis. Neurology, 2016, Aug 16; 87, 7: 699-708.
Hodis HN, Mack WJ. Postmenopausal hormone therapy and cardiovascular disease in perspective. Clin Obstet Gynecol., 2008, Sep; 51, 3: 564–580.
Hodis HN, Mack WJ. The timing hypothesis and hormone replacement therapy: a paradigm shift in the primary prevention of coronary heart disease in women. Part 1: comparison of therapeutic efficacy. J Am Geriatr Soc., 2013, Jun; 61, 6: 1005-1010.
Hodis HN, Collins P, Mack WJ, Schierbeck LL. The timing hypothesis for coronary heart disease prevention with hormone therapy: past, present and future in perspective. Climacteric, 2012, Jun; 15, 3: 217-228.
Imtiaz B, Tuppurainen M, Rikkonen T, et al. Postmenopausal hormone therapy and Alzheimer disease: A prospective cohort study. Neurology, 2017, Mar 14; 88, 11: 1062-1068.
Iorga A, Cunningham CM, Moazeni S, et al. The protective role of estrogen and estrogen receptors in cardiovascular disease and the controversial use of estrogen therapy. Biol Sex Differ., 2017, Oct 24; 8, 1: 33.
Jakiel G, Makara-Studzińska M, Ciebiera M, Słabuszewska-Jóźwiak A. Andropause - state of the art 2015 and review of selected aspects. Prz Menopauzalny., 2015, Mar;14, 1: 1-6.
Javed AA, Mayhew AJ, Shea AK, Raina P. Association between hormone therapy and muscle mass in postmenopausal women. A systematic review and meta-analysis. JAMA Network Open, 2019; 2, 8: e1910154.
Johnson J, Bagley J, Skaznik-Wikiel M, et al. Oocyte generation in adult mammalian ovaries by putative germ cells in bone marrow and peripheral blood. Cell, 2005, Jul 29; 122, 2: 303-315.
Kingsberg S. Testosterone treatment for hypoactive sexual desire disorder in postmenopausal women. J Sex Med., 2007, Mar; 4, Suppl 3: 227-234.
Lee JSA, Yaffe K, Lui LY, et al for the Study of Osteoporotic Fractures Group. Prospective study of endogenous circulating estradiol and risk of stroke in older women. Arch Neurol., 2010, Feb; 67, 2: 195–201.
Lobo RA, Bélisle S, Creasman WT, et al. Should symptomatic menopausal women be offered hormone therapy? Med.Gen.Med., 2006, August 16; 8, 3: 40-56.
Lu Y, Sareddy GR, Wang J, Wang R, Li Y, Dong Y, Zhang Q, Liu J, OConnor J, Xu J, Vadlamudi RK, Brann D. J Neurosci. 2019 Feb 6. pii: 1970-18.
Neuron-Derived Estrogen Regulates Synaptic Plasticity and Memory.
Lukes A. Evolving issues in the clinical and managed care settings on the management of menopause following the women's health initiative. J Manag Care Pharm., 2008, Apr; 14, 3 Suppl: 7-13.
MacGregor EA. Migraine, menopause and hormone replacement therapy. Post Reprod Health, 2017, Jan 1: 2053369117731172.
Manson JE, Hsia J, Johnson KC, et al. Estrogen plus progestin and the risk of coronary heart disease. N Eng J Med., 2003, 349, 6: 523–534.
Manson JE, Aragaki AK, Rossouw JE, et al as WHI Investigators. Menopausal Hormone Therapy and Long-term All-Cause and Cause-Specific Mortality: The Women's Health Initiative Randomized Trials. JAMA, 2017, Sep 12; 318, 10: 927-938.
Marjoribanks J, Farquhar C, Roberts H, Lethaby A, Lee J. Long-term hormone therapy for perimenopausal and postmenopausal women. Cochrane Database Syst Rev., 2017, Jan 17; 1: CD004143.
Martinelli I, Lensing AW, Middeldorp S, et al. Recurrent venous thromboembolism and abnormal uterine bleeding with anticoagulant and hormone therapy use. Blood, 2016, Mar 17; 127, 11: 1417-25.
Milcu SM, Dănilă-Muster A. Endocrinologie ginecologică. Edit. Academiei RSR (Buc.), 1968.
Miyamoto M, Kotani K, Taniguchi N. Effect of non-antihypertensive drugs on endothelial function in hypertensive subjects evaluated by flow-mediated vasodilation. Curr Vasc Pharmacol., 2015, 13, 1: 121-127.
Monda V, Salerno M, Fiorenzo M, et al. Role of sex hormones in the control of vegetative and metabolic functions of middle-aged women. Front Physiol., 2017, Oct 4; 8: 773.
Nelson HD. Commonly used types of postmenopausal estrogen for treatment of hot flashes. Scientific review. JAMA, 2004, April 7; 291, 13: 1610-1620
Notelovitz M. Clinical Opinion: The biologic and pharmacologic principles of estrogen therapy for symptomatic menopause. Med GenMed., 2006, 8, 1: 85.
Ojanlatva A, Mäkinen J, Helenius H, Korkeila K, Sundell J, Rautava P. Sexual activity and perceived health among Finnish middle-aged women. Health Qual Life Outcomes, 2006, May 10; 4: 29-39.
Parish SJ, Gillespie JA. The evolving role of oral hormonal therapies and review of conjugated estrogens/bazedoxifene for the management of menopausal symptoms. Postgrad Med., 2017, Apr; 129, 3: 340-351.
Patasius A, Kincius M, Kazlauskas E, Smailyte G. The role of androgen-deprivation therapy on suicide among patients with advanced prostate cancer: A nationwide population-based cohort study. Psychooncology. 2019 Jul 30.
Pereţianu D, Saragea M. Imunitatea în teoria şi practica medicinii. Vol.I. Editura ALL, Bucureşti, 1996.
Pereţianu D. Viagra – o viziune integratoare. Viaţa Medicală (Buc.), 2003, Partea I-a: 15, 39: 8. Partea II-a: 40: 8. Partea III-a: 15, 41: 8.
Pereţianu D., Poiană C., Carşote M. Controversele iodului din sare. Viaţa Medicală (Buc.), 2015, 27, 37 (1339): 3.
Pereţianu D, Aurelian Grigorescu. Unitatea operatională hormon-receptor. Criteriul pentru clasificarea fiziopatologică a bolilor endocrine. Medica Academica (Buc), 2016, Partea I-a: 8, 64 (1): 28-36. Partea a II-a: 8, 65 (2): 32-38. Partea a III-a: 8, 66 (3): 32-37.
Pereţianu D, Poiană C. Controverse legate de DEXA. Viaţa Medicală (Buc.), 2016, 28, 7 (1361): 3.
Pereţianu D, Mara Carşote, Matei Pisoschi, Dan Cristina Staicu, Bogdan Oprişan. Testosteronul. O apreciere după 10 ani de observaţii de tratament depot 1000 mg. Medica Academica (Buc.), Partea I-a: 2017, 9, 76 (4): 20-25. Partea II-a: 2017, 9, 77 (5): 24-34.
Pereţianu D. Comportamentul sexual, definit la naştere şi condiţionat biochimic. Viaţa Medicală (Buc.), 2017, 29, 34 (1440): 6.
Peters GN, Fodera T, Sabol J, Jones S, Euhus D. Estrogen replacement therapy after breast cancer: a 12-year follow-up. Ann.Surg.Oncol., 2001, 8, 10: 828–832.
Pu D, Tan R, Yu Q, Wu J. Metabolic syndrome in menopause and associated factors: a meta-analysis. Climacteric, 2017, Oct 24: 1-9.
Qaseem A, Forciea MA, McLean RM, Denberg TD; Clinical Guidelines Committee of the American College of Physicians. Treatment of low bone density or osteoporosis to prevent fractures in men and women: a clinical practice guideline update from the American College of Physicians. Ann Intern Med., 2017, Jun 6; 166, 11: 818-839.
Reid BM, Permuth JB, Sellers TA. Epidemiology of ovarian cancer: a review. Cancer Biol Med., 2017, Feb; 14, 1: 9–32.
Rennert G, Rennert HS, Pinchev M, Lavie O, Gruber SB. Use of hormone replacement therapy and the risk of colorectal cancer. J Clin Oncol., 2009, Sep 20; 27, 27: 4542–4547.
Resnick SM, Espeland MA, Jaramillo SA, et al. Postmenopausal hormone therapy and regional brain volumes. The WHIMS-MRI Study. Neurology, January 13; 2009, 72, 2: 135-142.
Riecher-Rössler A, de Geyter C. The forthcoming role of treatment with oestrogens in mental health. Swiss Med Wkly, 2007, 137: 565–572.
Seelig, MS, Altura BM, Altura BT. Benefits and risks of sex hormone replacement in postmenopausal women. J. Amer. College Nutrition, 2004, 23, 5, 482S–496S.
Shekhar S, Travis OK, He X, Roman RJ, Fan F. Menopause and ischemic stroke: a brief review. MOJ Toxicol., 2017; 3, 4. pii: 00059.
Simin J, Tamimi R, Lagergren J, Adami HO, Brusselaers N. Menopausal hormone therapy and cancer risk: An overestimated risk? Eur J Cancer, 2017, Oct; 84: 60-68.
Simon J, Braunstein G, Nachtigall L, et al. Testosterone patch increases sexual activity and desire in surgically menopausal women with hypoactive sexual desire disorder. J Clin Endocrinol Metab, 2005, 90, 9: 5226–5233.
Simon J, Nachtigall L, Ulrich LG, Eugster-Hausmann M, Gut R. Endometrial safety of ultra-low-dose estradiol vaginal tablets. Obstet Gynecol., 2010, Oct; 116, 4: 876-883.
Singh A, Kaur S, Walia I. A historical perspective on menopause and menopausal age. Bull Indian Inst Hist Med Hyderabad, 2002, Jul-Dec; 32, 2: 121-135.
Spencer CP, Cooper AJ, Whitehead MI. Management of abnormal bleeding in women receiving hormone replacement therapy. BMJ, 1997, Jul 5; 315, 7099: 37–42.
Stachowiak G, Pertyński T, Pertyńska-Marczewska M. Effect of transdermal hormone therapy on platelet haemostasis in menopausal women. Ann Agric Environ Med., 2015, 22, 1: 167-71.
Taylor HS, Tal A, Pal L, et al. Effects of Oral vs Transdermal Estrogen Therapy on Sexual Function in Early Postmenopause: Ancillary Study of the Kronos Early Estrogen Prevention Study (KEEPS). JAMA Intern Med., 2017, Oct 1; 177, 10: 1471-1479.
Topi G, Ehrnström R, Jirström K, Palmquist I, Lydrup ML, Sjölander A. Association of the oestrogen receptor beta with hormone status and prognosis in a cohort of female patients with colorectal cancer. Eur J Cancer, 2017, Sep; 83: 279-289.
Vickers MR, MacLennan AH, Lawton B, et al. Main morbidities recorded in the women's international study of long duration oestrogen after menopause (WISDOM): a randomised controlled trial of hormone replacement therapy in postmenopausal women. BMJ, 2007, Aug 4; 335, 7613: 239-250.
Viuff MH, Berglund A, Juul S, Andersen NH, Stochholm K, Gravholt CH. Sex hormone replacement therapy in Turner Syndrome - impact on morbidity and mortality. J Clin Endocrinol Metab., 2019, Sep 23. pii: dgz039. doi: 10.1210.
White RE, Han G, Dimitropoulou C, Zhu S, Miyake K, Fulton D, Dave S, Barman SA. Estrogen-induced contraction of coronary arteries is mediated by superoxide generated in vascular smooth muscle. Am J Physiol Heart Circ Physiol., 2005, Oct; 289, 4: H1468-75.
Williams MS, Vaidya D, Kickler T, Ouyang P. Long-term hormone replacement therapy does not cause increased platelet activation. Am Heart J., 2005, Sep; 150, 3: 434-438.
Women's Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy. The Women's Health Initiative randomized controlled trial. JAMA, 2004; Apr 14; 291, 14: 1701–1712.
Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA, 2002; 288: 321-333.
Wylie KR. Sexuality and the menopause. J Br Menopause Soc., 2006, Dec; 12, 4: 149-152.
Yang FL, Hu KQ, Wang X, Liu ZM, Hu Q, Li JF, He H. Combination of raloxifene, aspirin and estrogen as novel paradigm of hormone replacement therapy in rabbit model of menopause. Acta Pharmacol Sin., 2011, Aug; 32, 8: 1031–1037.
Ycaza Herrera A, Hodis HN, et al. Estradiol therapy after menopause mitigates effects of stress on cortisol and working memory. J.Clin.Endocrinol.Metab., 2017, Nov 2; DOI: 10.1210/jc.2017-00825.
http://www.menopause.org/docs/default-source/default-document-library/cardiac-risk-from-discontinuing-ht-11-8-17.pdf.
www.menopause.org/docs/default-source/agm/nams18-regular-and-late-breaking-abstracts.
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe