Impactul pandemiei asupra planificării și derulării studiilor clinice a fost analizat de specialiști români și străini în cadrul recentului Simpozion de Studii Clinice, desfășurat în mediul online.
Simpozionul a fost organizat de Avantyo Institute of Clinical Research la 20 noiembrie, pentru al doilea an consecutiv sub patronajul EUCROF* și ACCSCR**. Prima dezbatere a zilei a vizat posibilele strategii de accelerare a procesului de aprobare a studiilor clinice în România, în contextul reorganizării ANMDM prin legea 134 din august 2019.
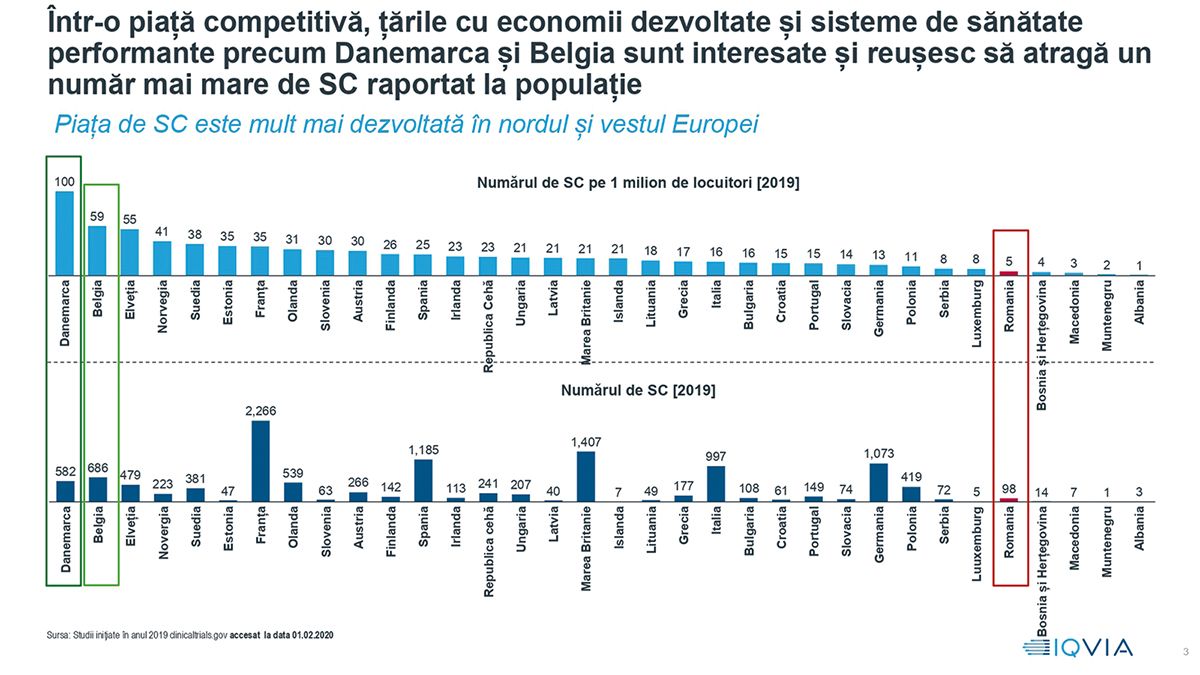
Începând cu anul 2008, ţara noastră participă la tot mai puţine studii clinice, ca urmare a timpilor lungi de aprobare din partea autorităţii de reglementare, Agenţia Naţională a Medicamentului și Dispozitivelor Medicale. Potrivit raportului de ţară privind studiile clinice realizat de IQVIA în 2020, România înregistrează un număr de studii clinice (SC) raportat la populaţie la jumătatea valorii înregistrate de Polonia, de patru ori mai mic decât Ungaria și de trei ori mai mic decât Bulgaria (vezi figura). Rapoartele de ţară – anteriorul fiind realizat de KPMG în 2016 – au rolul de a evalua situaţia curentă, progresele înregistrate în domeniu și ariile ce necesită îmbunătăţiri.

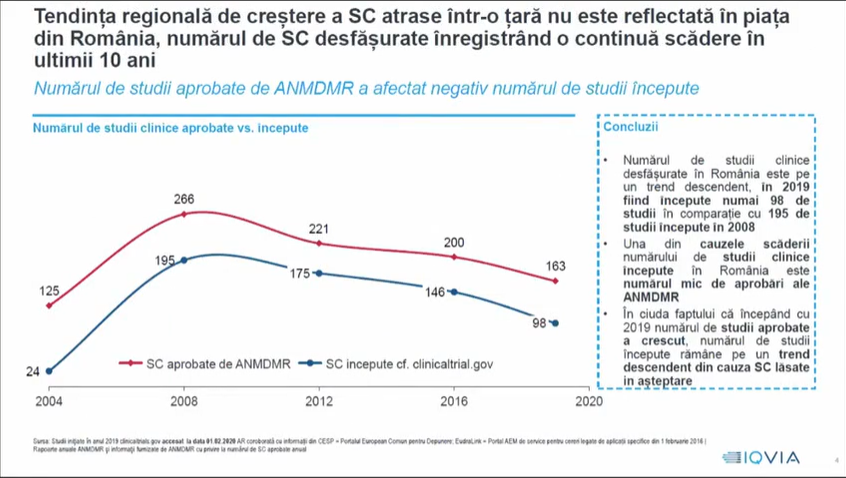
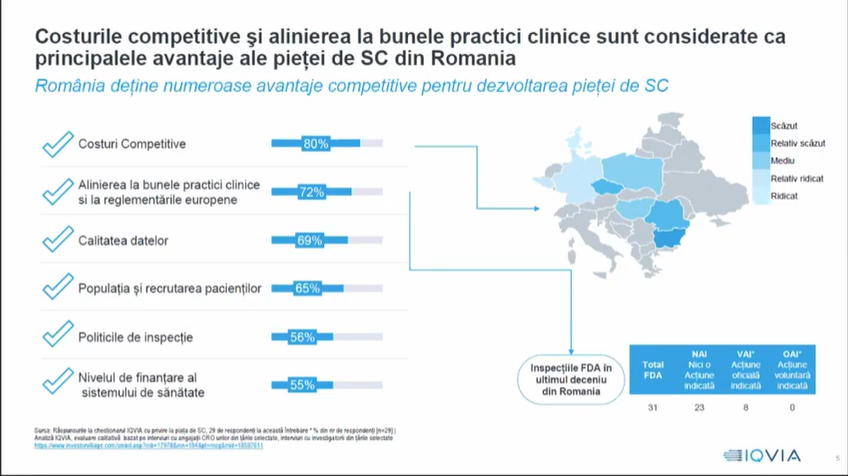
Sorin Petcu, director general IQVIA România, a subliniat că studiile clinice sunt o parte importantă din strategia de sănătate a ţărilor. S-au implementat, în acest sens, măsuri pentru creșterea sectorului și pentru sporirea atractivităţii lor, cum ar fi aprobarea rapidă, optimizarea fluxurilor de aprobare a documentaţiei, facilitarea înrolării pacienţilor, o comunicare cât mai bună – astfel încât percepţia să fie cea corectă – și, mai ales, creșterea capacităţii site-urilor de a gestiona aceste studii clinice. România nu reflectă tendinţa regională de creștere a numărului de SC implementate la nivel de ţară, acest număr înregistrând la noi o continuă scădere în ultimii zece ani. În plus, ne aflăm într-un cerc vicios, a mai spus Sorin Petcu, în care aprobarea întârziată face ca studiul să nu se mai iniţieze în România, deoarece numărul de pacienţi este atins deja în celelalte ţări implicate în respectivul studiu. Această lipsă de predictibilitate face ca, pe termen lung, sponsorii – companiile care au dezvoltat un nou medicament, de exemplu – să nu mai fie interesaţi în a propune România ca ţară pentru desfășurarea unui SC.
Una dintre principalele cauze ale întârzierilor ANM în aprobarea acestor studii a fost lipsa cronică de personal în cadrul Agenţiei, a explicat dr. Nicolae Fotin, fost președinte ANMDM. Astfel, în 2009, prin legea 329/2009, o parte dintre instituţiile publice și-au schimbat forma de finanţare și statutul, ceea ce pentru Agenţie a însemnat plecarea a peste 70 de angajaţi înalt calificaţi și scăderea salariilor celorlalţi, a explicat medicul. În perioada 2009-2016, posturile din ANMDM au fost blocate, iar în momentul deblocării, nimeni nu s-a prezentat la concurs, din cauza lipsei de atractivitate salarială. „Conștientă de acest declin”, ANMDM a încercat să găsească soluţii, a adăugat doctorul Fotin, iar pentru o perioadă a externalizat o parte dintre evaluări, prin semnarea unor protocoale de colaborare cu specialiști din UMF „Carol Davila”. În 2017 însă, autorităţile au considerat că această formă de implicare a unor experţi externi nu este conformă, astfel că aceste colaborări au încetat. Legea 134 din august 2019, cea care adăuga Agenţiei un „R” în acronim – acesta devenind acum ANMDMR, „din România” –, îi permite din nou Agenţiei să colaboreze cu experţi și instituţii din domeniul sanitar pentru realizarea obiectivelor din domeniul său de activitate. Așadar, ANMDMR poate colabora acum cu experţi externi, cu respectarea prevederilor legale în domeniu. Condiţia de bază este ca această lege să fie pusă în aplicare, lucru care nu s-a realizat până acum.
Aceasta este de altfel și modalitatea de funcţionare a Comisiei Naţionale de Bioetică, după cum a confirmat prof. dr. Constantin Mircioiu, secretar al Comisiei, autoritate de control importantă în aprobarea și implementarea studiilor clinice. Deși înregistrează, la rândul său, deficit de personal, instituţia evaluează în timp optim documentaţia pentru studiile primite, încadrându-se în prevederile legale. Potrivit profesorului Mircioiu, Agenţia ar trebui să organizeze cursuri de evaluatori de studii clinice împreună cu o universitate, iar după ce oamenii sunt formaţi, să li se recunoască aceste competenţe.
O nuanţă interesantă în intervenţia profesorului Mircioiu a fost referirea la faptul că, spre deosebire de Agenţia Europeană pentru Medicamente (EMA), omologul său american, FDA, are și o importantă componentă de cercetare, prin colaborarea cu Center for Drug Evaluation and Research. De altfel, și în România a existat Controlul de Stat al dezvoltării medicamentului și cercetării farmaceutice. Invitat la dezbatere, prof. dr. Viorel Jinga, rectorul UMF „Carol Davila”, a subliniat susţinerea pe care Universitatea o oferă Agenţiei pentru realizarea de internshipuri și pentru recrutarea de personal în scopul evaluării SC.
Provocările pandemiei pot explica doar parţial faptul că legea 134 din august 2019 nu a fost pusă încă în aplicare, au remarcat dr. Cătălina Sârbu, președinte ACCSCR și Associate Director Parexel România, și dr. Cristina Florescu Moraid, CEO Avantyo Institute of Clinical Research, organizatorul conferinţei. În ultimii ani, conducerea ANMDMR a cunoscut numeroase schimbări. După Adriana Cotel în 2019, în luna ianuarie 2020 a fost schimbat din funcţia de președinte Marius Daniel Șișu, interimatul fiind asigurat ulterior de doi profesioniști ai Agenţiei, dr. Roxana Stroe, până în luna mai, și dr. Bujor Almășan. La jumătatea lunii octombrie, ministrul Sănătăţii a numit-o în funcţia de președinte pe dr. Cristina Racoceanu.
Sorin Petcu, IQVIA, a atras atenţia că toate aceste schimbări generează o lipsă de continuitate în proiecte și procese. „Trebuie să ne uităm spre acest continuu provizorat al ANM-ului din ultimii ani. Nerespectarea legii este doar efectul, nu este cauza, cauza este lipsa de stabilitate la conducerea ANM, lucru care nu depinde de Agenţie, ci de autoritatea care guvernează Agenţia, respectiv Ministerul Sănătăţii. (...) Cred că trebuie să avem un plan și din partea Misterului Sănătăţii”, a concluzionat directorul companiei de cercetare.
Din partea ANMDMR, la dezbatere a participat, expunându-se tirului de întrebări, dr. Mirela Vîţă, directorul Departamentului de Studii Clinice. Aceasta a anunţat că în prezent Agenţia asigură analizarea cu prioritate a studiilor cu medicamente pe patologie COVID, iar în luna septembrie au aprobat 16 studii dintre cele depuse anterior.
Un alt subiect analizat a fost comunicarea. Profesorul Jinga consideră că ANMDMR ar trebui să transmită publicului un mesaj clar și că este nevoie de mai multă transparenţă, inclusiv prin publicarea listei studiilor clinice aflate în derulare și a locului unde se desfășoară. Potrivit Mirelei Vîţă, ANMDMR are în vedere organizarea de traininguri media cu jurnaliști, pentru o mai bună înţelegere a domeniului. Jurnalistul Lucian Mândruţă, comoderator al dezbaterii alături de dr. Cristina Florescu Moraid, este adeptul comunicării către publicul larg, prin intermediul paginii de internet și al reţelelor de socializare, după modelul FDA și CDC. Acest lucru este valabil și pentru Ministerul Sănătăţii, care ar trebui să se asigure că mesajele sale sunt clar formulate și înţelese.
În perioada 2009-2015, România și-a pierdut o parte importantă din personalul medical în favoarea ţărilor din vest – aproximativ 14.000 de medici și 28.000 de asistenţi medicali. Studiile clinice pot reprezenta un instrument care să faciliteze retenţia personalului. Ele pun la dispoziţie condiţii controlate de desfășurare a activităţii medicale, dotări cu echipamente medicale și schimb de informaţii știinţifice și de experienţă cu specialiști din afara ţării implicaţi în respectivele SC.
Studiile clinice reprezintă pentru sistemul de sănătate șansa de a face economii, preluând investigaţii costisitoare și oferind tratament pentru afecţiuni ce pot fi descoperite în stadii incipiente. În primul rând, ele reprezintă oportunitatea pentru pacienţi de a primi îngrijire de calitate, în siguranţă, și uneori o nouă șansă la o viaţă activă, în cazul afecţiunilor grave, precum cele oncologice, pentru care medicii apelează la tratamente inovatoare.
*EUCROF – Federaţia Europeană a Companiilor Conducătoare de Studii Clinice
**ACCSCR – Asociaţia Companiilor Conducătoare de Studii Clinice din România clinicaltrialsymposium.com, bit.ly/2VjugZD
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe