Hepatita alcoolică și ciroza hepatică, două consecințe ale consumului de alcool asupra ficatului, sunt analizate de specialiști.
Consumul de alcool rămâne singura adicție față de o substanță psihoactivă nereglementată de instituții de control. Alături de tutun și de alimentele bogate în sare și zahăr, alcoolul este principala cauză a creșterii incidenței bolilor necontagioase. În plus, este asociat cu apariția cirozei hepatice și a hepatocarcinomului, boli al căror diagnostic se face în peste 75% dintre cazuri tardiv și în stadii avansate.

Hepatita alcoolică (HA) reprezintă un sindrom clinic caracterizat prin icter cu debut recent cu sau fără alte semne de decompensare hepatică (ascită sau encefalopatie), la pacienţi cu consum de alcool în ultimele trei săptămâni (20).
Diagnostic şi evaluarea severităţii
Diagnosticul de certitudine este histologic, având ca elemente definitorii necroza extinsă și infiltratul polimorfonuclear, pe fondul steatohepatitei. Un scor AHHS >7 (cuantificarea Alcoholic Hepatitis Histologic Score) indică severitatea leziunilor. Cu toate acestea, biopsia hepatică nu este indicată decât în aproximartiv 25% dintre cazuri, mai ales când există probleme de diagnostic diferențial (47). Atunci când se indică, se preferă calea transjugulară pentru evitarea complicațiilor hemoragice. Există însă semne înalt sugestive pentru diagnostic.
Clinic, manifestarea principală este icterul cu debut progresiv, frecvent asociat cu febră, prostraţie, scădere ponderală şi malnutriţie. Biologic, există o neutrofilie, hiperbilirubinemie (bilirubină totală >2,5 mg/dL), AST >50 UI/ml rareori cu valori peste 300 UI/ml , cu raport ASAT/ALAT de obicei >1,5-2. În formele severe sau la pacienţii cirotici, timpul de protrombină este prelungit, există frecvent hipoalbuminemie şi trombocitopenie (20). Combinarea elementelor clinice și biologice poate duce la un diagnostic de HA probabil (consum crescut de alcool în ultimii cinci ani, consum activ documentat cu trei-patru săptămâni anterior prezentării, icter cu debut recent sau accentuarea icterului preexistent, hipertransaminazemie – nu mai mare de 400 UI cu raport AST/ALT >1,5 și absența altor cauze de decompensare hepatică) sau posibil (criterii incerte din cauza unei posibile alte etiologii sau a imposibilității demonstrării consumului de alcool) (16).
Odată stabilit diagnosticul, este importantă evaluarea severităţii și a prognosticului. Se utilizează mai multe modele care încorporează variabile statice şi dinamice (vezi tabel), toate având drept scop comun identificarea pacienţilor cu risc crescut de deces.
Tabel. Variabilele încorporate în cele mai utilizate cinci scoruri prognostice în HA
|
Scor |
Bilirubină |
TP/INR |
Creatinină/uree |
Leucocite |
Vârstă |
Albumină |
bilirubină |
|
mDF |
+ |
+ |
- |
+ |
- |
- |
- |
|
MELD |
+ |
+ |
+ |
- |
- |
- |
- |
|
GAHS |
+ |
+ |
+ |
+ |
+ |
- |
- |
|
ABIC |
+ |
+ |
+ |
- |
+ |
+ |
- |
|
Lille |
+ |
+ |
+ |
- |
+ |
+ |
+ |
mDF – funcție discriminativă modificată (scor Maddrey); MELD – model for end stage liver disease; GAHS – Glasgow alcoholic hepatitis score; ABIC – vârstă, bilirubină serică, INR şi creatinină serică.
Scorul Maddrey (mDF) a fost primul care a stratificat corect pacienţii cu risc crescut de mortalitate pe termen scurt şi rămâne cel mai utilizat în practica clinică curentă. O valoare a mDF ≥32 identifică pacienţii cu hepatită alcoolică severă (HAS) și indică oportunitatea inițierii terapiei specifice (48,49).
Scorul MELD (model for end stage liver disease), un model prognostic validat la pacienţii cu ciroză, a fost recent evaluat pentru prognosticul pe termen scurt în HA. O valoare peste 20 a acestui scor prezice o mortalitate crescută la 90 de zile (50).
Scorul GAHS, derivat din cinci variabile asociate independent cu prognosticul (vârstă, bilirubină serică, uree serică, timp de protrombină şi leucocitoză), identifică pacienţii cu risc crescut de deces în absenţa tratamentului. GAHS are valori cuprinse între 5 şi 12, iar pacienţii cu GAHS ≥ 9 şi FDM ≥ 32 au prognostic rezervat şi o îmbunătățire a supravieţuirii la 84 de zile atunci când este iniţiată corticoterapia (51).
Scorul ABIC clasifică pacienţii cu AH în trei categorii de risc crescut de mortalitate la 90 de zile: scăzut, intermediar şi crescut (52). Modificarea precoce a valorii bilirubinei serice la ziua a șaptea de tratament a fost propusă ca un marker fiabil pentru identificarea pacienţilor sub corticoterapie la risc crescut de mortalitate la şase luni.
Modelul Lille (valori între 0 şi 1) este un scor dinamic ce foloseşte date marker serici pretratament plus răspunsul bilirubinei serice la ziua a șaptea de tratament cu corticosteroizi. Un scor ≥0.45 indică un nonrăspuns la tratament şi sugerează stoparea corticoterapiei (33,53).
Recent, există tendința de a combina scorurile noninvazive pentru a obține o discriminare mai corectă a pacienților care pot beneficia de tratament și pentru a obține o estimare mai bună a riscului de deces. Una dintre posibilități este utilizarea combinată a scorurilor MELD și Lille. Astfel se permite stratificarea pacienților ca având risc de deces scăzut (MELD <11), intermediar (MELD 11-20) sau crescut (MELD>20)(54), iar calcularea scorului Lille după șapte zile de tratament permite estimarea mai exactă, continuă, a riscului de deces la două și șase luni (55).
Tratament
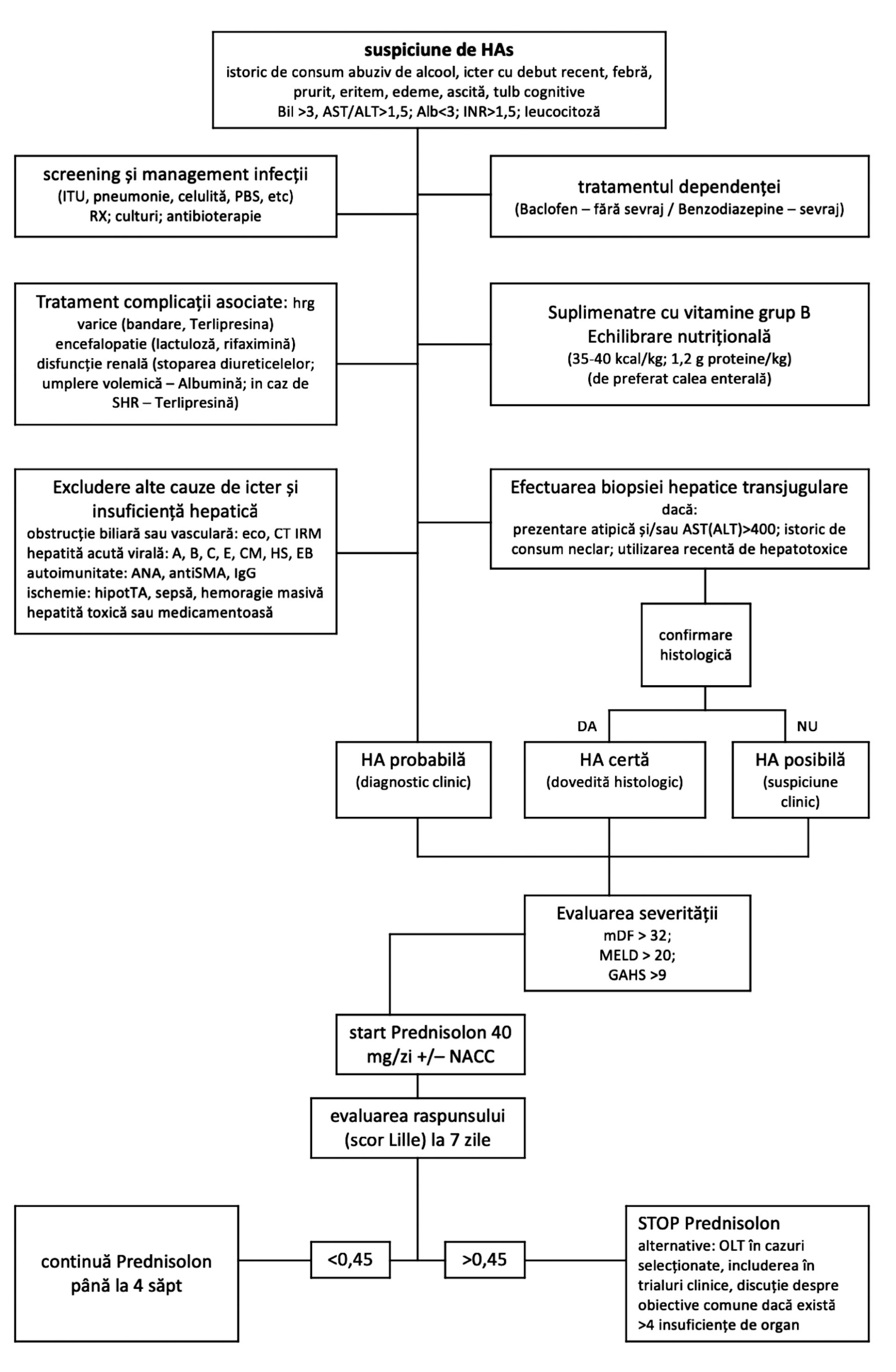
Algoritmul de decizie a inițierii terapiei și de apreciere a răspunsului este sintetizat în figura următoare.

Tratamentul HA severe implică următoarele:
Măsuri generale
Indiferent de stadiul de severitate, abstinenţa la alcool este principala măsură în managementul bolii hepatice alcoolice. Luând în considerare riscul crescut pentru a dezvolta encefalopatia Wernicke, se recomandă suplimentarea cu vitamine din complexul B. Alte măsuri generale cuprind tratamentul encefalopatiei hepatice (lactuloză, rifaximină) şi al ascitei (restricţie de sare).
Pacienţii cu HA severă prezintă risc crescut de a dezvolta injurie renală acută, ce reprezintă factor negativ de pronostic, astfel încât este recomandată utilizarea cu precauţie a diureticelor, a betablocantelor și evitarea utilizării nefrotoxicelor (56). Din cauza riscului crescut de malnutriție, pentru acești pacienți se recomandă nutriția hipercalorică (35-40 kcal/kg) și hiperproteică (1,2-1,5 g/kg), de preferință pe cale orală, sau pe căi artificiale (sondă jejunală sau nazogastrică), în caz de intoleranță digestivă. Administrarea parenterală a fost corelată cu un risc crescut de sepsis, cu punct de plecare la nivelul CVC (20).
Corticosteroizii
Tratamentul de elecție al HAs constă în administrarea de corticosteroizi (prednison 40 mg/zi sau metilprednisolonă 32 mg/zi) timp de 28 zile. Prednisolonul este preferat față de prednison, cu toate că nu i s-a demonstrat superioritatea, având în vedere faptul că prednisonul are nevoie de un pasaj hepatic pentru a se genera metabolitul activ (57). Este singura terapie care a dovedit beneficii de supraviețuire pe termen scurt (56), dar nu există evidențe care să demonstreze un beneficiu de supraviețuire la 90 de zile sau la un an (48).
Limita acestui tratament este reprezentată de riscul crescut de sepsis şi hemoragie gastrointestinală, astfel încât se impune identificarea precoce a responderilor (scor Lille după șapte zile de tratament <0,45) (58). O nuanțare a acestui aspect clasifică pacienții astfel: responderi compleți (scor Lille <0.16), responderi parțiali (scor Lille 0,16–0,56) și nonresponderi (scor Lille >0.56) (20). Screeningul sistematic pentru infecţii este recomandat înaintea inițierii corticoterapiei, din moment ce infecţiile sunt cele mai frecvente şi severe complicaţii la pacienţii cu HAs şi una dintre cauzele principale de deces (59). Infecţiile bacteriene reprezintă aproximativ 90% din totalul infecţiilor asociate HAs (60), peritonita bacteriană spontană şi bacteriemia spontană având o incidenţă de 44%, infecţii urinare pretratament – 33%, cu o virare către infecţiile de tract respirator (40% din toate episoadele) în timpul sau după tratament (60).
N-acetilcisteina (N-ACC)
Există dovezi ce demonstrează că stresul oxidativ reprezintă un mecanism-cheie în hepatotoxicitatea alcool-mediată, prin depleția sistemelor antioxidante (61). N-ACC restaurează nivelul de glutation şi limitează stresul oxidativ hepatic, justificându-se astfel utilizarea în HAs. Un trial multicentric francez ce a comparat efectul N-ACC administrat iv pentru cinci zile vs. placebo la pacienți cu HAs tratați cu prednisolon a demonstrat scăderea mortalităţii la o lună faţă de grupul de control, precum şi reducerea incidenței sindromului hepatorenal şi a infecţiilor (62).
Pentoxifilina
Efectul anti TNFα al pentoxifilinei stă la baza raționamentului utilizării în tratamentul HAs. Indicația administrării pentoxifilinei se bazează pe observarea reducerii incidenței sindromului hepatorenal (17), dar nu au fost demonstrate efecte pozitive în ceea ce privește supraviețuirea (48), astfel încât în prezent nu mai este recomandată de ghidurile de specialitate (16,20).
Ciroza hepatică apărută ca o consecință a evoluției naturale a bolii hepatice alcoolice (BHA) nu prezintă particularități de diagnostic sau tratament, comparativ cu alte etiologii. Trebuie efectuat screeningul hepatocarcinomului și, în cazul în care apar, trebuie manageriate complicațiile (ascita, sângerarea variceală, encefalopatia) conform ghidurilor de specialitate.
Pentru un management eficient, este importantă reducerea sau oprirea consumului de alcool, alături de managementul dependenței. În acest sens, este de dorit abordarea pacienților în echipe multidisciplinare care să includă și un specialist în adicții (16). Foarte importantă se dovedește îndrumarea pacienților spre terapii motivaționale de grup (alcoolici anonimi) (63). Din partea hepatologului se așteaptă o intervenție minimală în această direcție, care să conțină cel puțin următoarele cinci elemente: (i) investigarea folosirii alcoolului, (ii) sfatul de a opri sau reduce consumul, precum și (iii) asistența în această direcție, (iv) evaluarea dorinței de recuperare și (v) programarea unei vizite de evaluare (16).
Nu există un tratament medicamentos care să garanteze renunțarea la consumul de alcool. Totuși, date încurajatoare provin din studiile care au utilizat baclofen (un agonist al receptorilor B ai GABA), atât în ceea ce privește ratele de obținere a abstinenței, cât și profilul de siguranță, chiar și la pacienți cu boală hepatică avansată sau HAs (64).
De interes este înțelegerea particularităților sindromului de insuficiență hepatică cronică acutizată (ACLF) în contextul BHA, precum și diferențele față de HAs și investigarea ipotezei conform căreia HAs este o formă particulară de ACLF.
ACLF în contextul BHA
ACLF este un sindrom ce implică o decompensare a unei boli hepatice cronice avansate, cu apariția disfuncției de organ și caracterizată de o mortalitate pe termen scurt ridicată (65). Din punct de vedere clinic, ACLF se supune conceptului PIRO (Predispoziție, Injurie, Răspuns inflamator și insuficiență de Organ) (66). Nu există însă un consens legat de definiția acestei entități, persistând diferențe mari între criteriile propuse în Europa, SUA sau regiunea Asia-Pacific. Afecțiunea este de obicei precipitată (40-50%) de factori neidentificați (67), dar studiul CANONIC a demonstrat că abuzul de alcool este a doua cauză (aproximativ 25%) de ACLF la pacienții cu ciroză alcoolică, după infecții (68). În prezent nu se cunoaște însă dacă ACLF indusă de consumul de alcool este o formă particulară de manifestare a BHA sau o modalitate de evoluție a HAs (69). La pacienții cu BHA, alte cauze posibile de ACLF (demonstrate mai ales în studii pe populații asiatice) pot fi reprezentate de: hepatite acute virale A sau E, o exacerbare a infecției VHB sau o injurie hepatică indusă de medicamente sau droguri (cocaină)(69).
La baza procesului fiziopatologic din ACLF stă inflamația sistemică. Aceasta este declanșată de injuriile hepatice precipitante (în cazul BHA cele mai frecvente fiind sepsa sau consumul abuziv de alcool în ultimele trei luni). Markerii inflamației sistemice sunt, în cazul ACLF asociată cu HAs, leucocitoza și valorile crescute ale proteinei C reactive (CRP). Studiul CANONIC a demonstrat o corelație între numărul de leucocite și mortalitatea pe termen scurt, astfel încât acest parametru a fost adăugat la scorul CLIF-ACLF de prognostic al mortalității (65). De asemenea, se constată o disfuncție imună pe toate liniile celulare, caracterizată atât de ineficiența celulelor de a face clearance-ul bacterian, cât și de secreția de molecule proinflamatorii (65). Statusul proinflamtor la pacienții cu HAs și ACLF este demonstrat prin nivelurile crescute de citokine (IL-6, IL-8 și IL-1beta), element care poate deveni ținta unor terapii specifice (70). Moartea celulară, prin unul dintre cele trei mecanisme implicate (apoptoza, necroptoza sau piroptoza), duce la eliberarea în circulație a numeroși factori imunogeni ce declanșează răspunsul inflamator sistemic. În prezent, se consideră că distrucția hepatocitelor este mai degrabă factorul declanșator decât un efect al SIRS (65). Pacienții cu consum abuziv de alcool au o permeabilitate intestinală mai crescută, ceea ce favorizează translocația bacteriană (71). Studii recente au demonstrat o corelație între concentrațiile plasmatice de lipopolizaharid (LPZ), răspunsul inflamator sistemic și riscul de deces (72).
Stratificarea prognostică și estimarea riscului de mortalitate la pacienții cu ACLF și BHA se realizează prin scorul CLIF-C ACLF, dependent de parametrii ce evaluează insuficiențele de organ – renal, hepatic, cardiovascular, pulmonar, neurologic –, prin modificarea scorului SOFA (system for organ failure assessment). Un studiu recent a demonstrat sensibilitate și specificitate scăzute ale acestui scor pentru identificarea pacienților cu risc crescut de deces la 28, respectiv 168 de zile (73). Alte scoruri utilizate sunt MELD, GAHS și ABIC.
Tratamentul ACLF din BHA se suprapune în bună măsură peste cel al HAs. Pe lângă corticosteroizi, N-ACC sau pentoxifilină, mai intră în discuție și câțiva alți compuși sau metode. G-CSF – datorită efectului de mobilizare a neutrofilelor și celulelor stem CD34+ de la nivelul măduvei hematoformatoare – facilitează regenerarea hepatocitelor. Studiile au demonstrat date neconvingătoare în ceea ce privește G-CSF ca terapie în HAs (74), astfel încât nu este recomandat în HAs (16,56). Factorii anti TNF-α studiați în tratamentul HAs (infliximab, etanercept) au crescut riscul de infecții severe și deces (18). Procedurile de epurare hepatică extracorporeală (MARS, Prometheus) nu și-au dovedit eficacitatea în trialuri randomizate (69), dar diverse forme de dializă cu albumină au dus la îmbunătățirea probelor funcționale hepatice, a funcției renale și cerebrale și au atenuat circulația hiperdinamică (75). Transplantul hepatic este recomandat (grad A1) la pacienții nonreponderi la corticoterapie atent selectați (20). Transplantul de microbiotă fecală, justificat prin rolul patogenetic important al translocației bacteriene, s-a dovedit eficient într-un studiu necontrolat, îmbunătățind supraviețuirea la pacienți neeligibili pentru corticoterapie (76).
Text preluat din lucrarea „Bolile hepatice în 2019”, editată de „Viața medicală”
(1) Hydes T, Gilmore W, Sheron N, Gilmore I. Treating alcohol-related liver disease from a public health perspective. vol. 70. 2019. doi:10.1016/j.jhep.2018.10.036.
(2) WHO. World Health Organisation., Organisation. WWH, Who. Global status report on noncommunicable diseases. World Health 2010. doi:ISBN 978 92 4 156422 9.
(3) WHO. Global status report on alcohol and health. World Heal Organ 2014. doi:/entity/substance_abuse/publications/global_alcohol_report/en/index.html.
(4) Griswold MG, Fullman N, Hawley C, Arian N, M Zimsen SR, Tymeson HD, et al. Alcohol use and burden for 195 countries and territories, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016 2018. doi:10.1016/S0140-6736(18)31310-2.
(5) Stein E, Cruz-Lemini M, Altamirano J, Ndugga N, Couper D, Abraldes JG, et al. Heavy daily alcohol intake at the population level predicts the weight of alcohol in cirrhosis burden worldwide. J Hepatol 2016. doi:10.1016/j.jhep.2016.06.018.
(6) Anderson P, Chisholm D, Fuhr DC. Effectiveness and cost-effectiveness of policies and programmes to reduce the harm caused by alcohol. Lancet 2009;373:2234–46. doi:10.1016/S0140-6736(09)60744-3.
(7) Corrao G, Bagnardi V, Zambon A, Torchio P. Meta-Analysis Of Alcohol Intake In Relation To Risk Of Liver Cirrhosis. Alcohol Alcohol 1998;33:381–92. doi:10.1093/oxfordjournals.alcalc.a008408.
(8) Alcohol units - NHS n.d. https://www.nhs.uk/live-well/alcohol-support/calculating-alcohol-units/ (accessed February 25, 2019).
(9) You M, Arteel GE. Effect of ethanol on lipid metabolism. 2019. doi:10.1016/j.jhep.2018.10.037.
(10) Ishak KG, Zimmerman HJ, Ray MB. Alcoholic Liver Disease: Pathologic, Pathogenetic and Clinical Aspects. Alcohol Clin Exp Res 1991;15:45–66. doi:10.1111/j.1530-0277.1991.tb00518.x.
(11) Day CP, James OFW. Hepatic steatosis: Innocent bystander or guilty party? Hepatology 1998;27:1463–6. doi:10.1002/hep.510270601.
(12) Clugston RD, Yuen JJ, Hu Y, Abumrad NA, Berk PD, Goldberg IJ, et al. CD36-deficient mice are resistant to alcohol- and high-carbohydrate-induced hepatic steatosis. J Lipid Res 2014;55:239–46. doi:10.1194/jlr.M041863.
(13) Cai Y, Jogasuria A, Yin H, Xu M-J, Hu X, Wang J, et al. The Detrimental Role Played by Lipocalin-2 in Alcoholic Fatty Liver in Mice. Am J Pathol 2016;186:2417–28. doi:10.1016/J.AJPATH.2016.05.006.
(14) Thomes PG, Trambly CS, Fox HS, Tuma DJ, Donohue TM. Acute and Chronic Ethanol Administration Differentially Modulate Hepatic Autophagy and Transcription Factor EB. Alcohol Clin Exp Res 2015;39:2354–63. doi:10.1111/acer.12904.
(15) Stärkel P, Schnabl B. Bidirectional Communication between Liver and Gut during Alcoholic Liver Disease. Semin Liver Dis 2016;36:331–9. doi:10.1055/s-0036-1593882.
(16) Singal AK, Bataller R, Ahn J, Kamath PS, Shah VH. ACG Clinical Guideline: Alcoholic Liver Disease. Am J Gastroenterol 2018. doi:10.1038/ajg.2017.469.
(17) O'Shea R, Dasarathy S, McCulloough AJ APC. AASLD Practice Guidelines Alcoholic Liver Disease 2009. doi:10.1002/hep.23258.
(18) Gao B. Alcoholic Liver Disease: Pathogenesis and New Therapeutics Targets. Gastroenterology 2011;141:1572–85. doi:10.1053/j.gastro.2011.09.002.Alcoholic.
(19) Gao B, Ahmad MF, Nagy LE, Tsukamoto H. Inflammatory pathways in alcoholic steatohepatitis. J Hepatol 2019. doi:10.1016/j.jhep.2018.10.023.
(20) Thursz M, Gual A, Lackner C, Mathurin P, Moreno C, Spahr L, et al. EASL Clinical Practice Guidelines: Management of alcohol-related liver disease. J Hepatol 2018. doi:10.1016/j.jhep.2018.03.018.
(21) Gough G, Heathers L, Puckett D, Westerhold C, Ren X, Yu Z, et al. The Utility of Commonly Used Laboratory Tests to Screen for Excessive Alcohol Use in Clinical Practice. Alcohol Clin Exp Res 2015;39:1493–500. doi:10.1111/acer.12780.
(22) Dunn W, Angulo P, Sanderson S, Jamil LH, Stadheim L, Rosen C, et al. Utility of a New Model to Diagnose an Alcohol Basis for Steatohepatitis. Gastroenterology 2006;131:1057–63. doi:10.1053/j.gastro.2006.08.020.
(23) Mueller S, Millonig G, Sarovska L, Friedrich S, Reimann FM, Pritsch M, et al. Increased liver stiffness in alcoholic liver disease: differentiating fibrosis from steatohepatitis. World J Gastroenterol 2010;16:966–72. doi:10.3748/wjg.v16.i8.966.
(24) Castera L, Pinzani M. Biopsy and non-invasive methods for the diagnosis of liver fibrosis: does it take two to tango? Gut 2010;59:861–6.
(25) Stickel F, Datz C, Hampe J BR. Pathophysiology and Management of Alcoholic Liver Disease: Update 2016. Gut Liver 2017;11:173–88.
(26) Mueller S, Englert S, Seitz HK, Badea RI, Erhardt A, Bozaari B, et al. Inflammation-adapted liver stiffness values for improved fibrosis staging in patients with hepatitis C virus and alcoholic liver disease. Liver Int 2015;35:2514–21. doi:10.1111/liv.12904.
(27) Mueller S, Seitz HK, Rausch V. Non-invasive diagnosis of alcoholic liver disease. World J Gastroenterol 2014. doi:10.3748/wjg.v20.i40.14626.
(28) Filingeri V, Francioso S, Sforza D, Santopaolo F, Oddi FM TG. A retrospective analysis of 1.011 percutaneous liver biopsies performed in patients with liver transplantation or liver disease: ultrasonography can reduce complications? Eur Rev Med Pharmacol Sci 2016;20:3609–17.
(29) R. N .M. MacSween ADB. Histologic Spectrum of Alcoholic Liver Disease. Semin Liver Dis 1986;6:221–32.
(30) P Mathurin, V Duchatelle, MJ Ramond, C Degott, P Bedossa, S Erlinger, JP Benhamou, JC Chaput, B Rueff TP. Survival and prognostic factors in patients with severe alcoholic hepatitis treated with prednisolone. Gastroenterology 1996;110:1847–53.
(31) Helena Cortez-Pinto, Amélia Baptista, Maria Ermelinda Camilo MC de M. Nonalcoholic Steatohepatitis—A Long-Term Follow-Up Study: Comparison with Alcoholic Hepatitis in Ambulatory and Hospitalized Patients. Dig Dis Sci 2003;48:1909–1913.
(32) Carolin Lackner, Andrea Berghold, Ramon Bataller RES. Histological parameters and alcohol abstinence determine long-term prognosis in patients with alcoholic liver disease. J Hepatol 2017;66:610–8.
(33) J Altamirano, R Miquel, A Katoonizadeh, JG Abraldes, A Duarte-Rojo AL. A histologic scoring system for prognosis of patients with alcoholic hepatitis. Gastroenterology 2014;146:1231–9.
(34) Lupşor-Platon M, Stefǎnescu H, Muresçan D, Florea M, Erzsébet Szász M, Maniu A, et al. Noninvasive assessment of liver steatosis using ultrasound methods. Med Ultrason 2014;16. doi:10.11152/mu.2013.2066.163.1mlp.
(35) Strauss S, Gavish E, Gottlieb P, Katsnelson L. Interobserver and Intraobserver Variability in the Sonographic Assessment of Fatty Liver. Am J Roentgenol 2007;189:W320–3. doi:10.2214/AJR.07.2123.
(36) Noureddin M, Lam J, Peterson MR, Middleton M, Hamilton G, Le T-A, et al. Utility of magnetic resonance imaging versus histology for quantifying changes in liver fat in nonalcoholic fatty liver disease trials. Hepatology 2013;58:1930–40. doi:10.1002/hep.26455.
(37) Thiele M, Rausch V, Fluhr G, Kjærgaard M, Piecha F, Mueller J, et al. Controlled attenuation parameter and alcoholic hepatic steatosis: Diagnostic accuracy and role of alcohol detoxification. J Hepatol 2018;68:1025–32. doi:10.1016/J.JHEP.2017.12.029.
(38) Mueller S, Nahon P, Rausch V, Peccerella T, Silva I, Yagmur E, et al. Caspase‐cleaved keratin‐18 fragments increase during alcohol withdrawal and predict liver‐related death in patients with alcoholic liver disease. Hepatology 2017;66:96–107.
(39) Moreno C, Mueller S, Szabo G. Non-invasive diagnosis and biomarkers in alcohol-related liver disease. 2019. doi:10.1016/j.jhep.2018.11.025.
(40) HK S. Additive effects of moderate drinking and obesity on serum gamma-glutamyl transferase. Am J Clin Nutr 2006;83:1252–3.
(41) Hock B. Validity of carbohydrate‐deficient transferrin (%CDT), γ‐glutamyltransferase (γ‐GT) and mean corpuscular erythrocyte volume (MCV) as biomarkers for chronic alcohol abuse: a study in patients with alcohol dependence and liver disorders of non‐alcoholic and. Addiction 2005;100:1477–86.
(42) Thierry Poynard, Alain Aubert, Pierre Bedossa, Annie Abella, Sylvie Naveau, Francois Paraf JCC. A simple biological index for detection of alcoholic liver disease in drinkers. Gastroenterology 1991;100:1397–402.
(43) Anders Helander, Jos Wielders, Raymond Anton, Torsten Arndt, Vincenza Bianchi, Jean Deenmamode, Jan-Olof Jeppsson, John B. Whitfield, Cas Weykamp FS. Reprint of Standardisation and use of the alcohol biomarker carbohydrate-deficient transferrin (CDT). Clin Chim Acta 2017;467:15–20.
(44) P Cabarcos, I Alvarez, MJ Tabernero AB. Determination of direct alcohol markers: a review. Anal Bioanal Chem 2015;407:4907–4925.
(45) K Staufer, H Andresen, E Vettorazzi, N Tobias, B Nashan Ms. Urinary ethyl glucuronide as a novel screening tool in patients pre- and post-liver transplantation improves detection of alcohol consumption. Hepatology 2011;54:1640–1649.
(46) BM Appenzeller, R Agirman, P Neuberg, M Yegles RW. Segmental determination of ethyl glucuronide in hair: a pilot study. Forensic Sci Int 2007;173:87–92.
(47) Tiniakos DG. Liver biopsy in alcoholic and non-alcoholic steatohepatitis patients. Gastroentérologie Clin Biol 2009;33:930–9. doi:10.1016/J.GCB.2009.05.009.
(48) Thursz MR, Richardson P, Allison M, Austin A, Bowers M, Day CP, et al. Prednisolone or Pentoxifylline for Alcoholic Hepatitis. N Engl J Med 2015;372:1619–28. doi:10.1056/NEJMoa1412278.
(49) Maddrey WC, Boitnott JK, Bedine MS, Weber FL, Mezey E, White RI. Corticosteroid therapy of alcoholic hepatitis. Gastroenterology 1978.
(50) Dunn W, Jamil LH, Brown LS, Wiesner RH, Kim WR, Menon KVN, et al. MELD accurately predicts mortality in patients with alcoholic hepatitis. Hepatology 2005. doi:10.1002/hep.20503.
(51) Forrest EH, Morris AJ, Stewart S, Phillips M, Oo YH, Fisher NC, et al. The Glasgow alcoholic hepatitis score identifies patients who may benefit from corticosteroids. Gut 2007. doi:10.1136/gut.2006.099226.
(52) Dominguez M, Rincón D, Abraldes JG, Miquel R, Colmenero J, Bellot P, et al. A new scoring system for prognostic stratification of patients with alcoholic hepatitis. Am J Gastroenterol 2008. doi:10.1111/j.1572-0241.2008.02104.x.
(53) Louvet A, Naveau S, Abdelnour M, Ramond MJ, Diaz E, Fartoux L, et al. The Lille model: A new tool for therapeutic strategy in patients with severe alcoholic hepatitis treated with steroids. Hepatology 2007;45:1348–54. doi:10.1002/hep.21607.
(54) Kamath PS, Shah VH. MELDing the Lille Score to More Accurately Predict Mortality in Alcoholic Hepatitis HHS Public Access. Gastroenterology 2015;149:281–3. doi:10.1053/j.gastro.2015.06.020.
(55) Louvet A, Labreuche J, Artru F, Boursier J, Kim DJ, O’Grady J, et al. Combining data from liver disease scoring systems better predicts outcomes of patients with alcoholic hepatitis. Gastroenterology 2015. doi:10.1053/j.gastro.2015.04.044.
(56) Thursz M, Morgan TR. Treatment of Severe Alcoholic Hepatitis. Gastroenterology 2016;150:1823–34. doi:10.1053/j.gastro.2016.02.074.
(57) Singal AK, Walia I, Singal A, Soloway RD. Corticosteroids and pentoxifylline for the treatment of alcoholic hepatitis: Current status. World J Hepatol 2011;3:205–10. doi:10.4254/wjh.v3.i8.205.
(58) Mathurin P, O’Grady J, Carithers RL, Phillips M, Louvet A, Mendenhall CL, et al. Corticosteroids improve short-term survival in patients with severe alcoholic hepatitis: Meta-analysis of individual patient data. Gut 2011. doi:10.1136/gut.2010.224097.
(59) Hmoud BS, Patel K, Bataller R, Singal AK. Corticosteroids and occurrence of and mortality from infections in severe alcoholic hepatitis: A meta-analysis of randomized trials. Liver Int 2016. doi:10.1111/liv.12939.
(60) Louvet A, Wartel F, Castel H, Dharancy S, Hollebecque A, Canva-Delcambre V, et al. Infection in Patients With Severe Alcoholic Hepatitis Treated With Steroids: Early Response to Therapy Is the Key Factor. Gastroenterology 2009. doi:10.1053/j.gastro.2009.04.062.
(61) Dey A, Cederbaum AI. Alcohol and oxidative liver injury. Hepatology 2006. doi:10.1002/hep.20957.
(62) Nguyen-Khac E, Thevenot T, Piquet MA, Benferhat S, Goria O, Chatelain D, et al. Glucocorticoids plus N-acetylcysteine in severe alcoholic hepatitis. N Engl J Med 2011. doi:10.1056/NEJMoa1101214.
(63) Foxcroft DR, Coombes L, Wood S, Allen D, Almeida Santimano NML. Motivational interviewing for alcohol misuse in young adults. Cochrane Database Syst Rev 2015. doi:10.1002/14651858.CD007025.pub3.
(64) Addolorato G, Mirijello A, Barrio P, Gual A. Treatment of alcohol use disorders in patients with alcoholic liver disease. J Hepatol 2016;65:618–30. doi:10.1016/J.JHEP.2016.04.029.
(65) Gustot T, Jalan R. Acute-on-chronic liver failure in patients with alcoholic liver disease. J Hepatol 2018;70:319–27. doi:10.1016/j.jhep.2018.12.008.
(66) Jalan R, Stadlbauer V, Sen S, Cheshire L, Chang Y-M, Mookerjee RP. Role of predisposition, injury, response and organ failure in the prognosis of patients with acute-on-chronic liver failure: a prospective cohort study. Crit Care 2012;16:R227. doi:10.1186/cc11882.
(67) Solé C, Solà E. Update on acute-on-chronic liver failure. Gastroenterol Hepatol 2018;41:43–53. doi:10.1016/j.gastrohep.2017.05.012.
(68) Moreau R, Jalan R, Gines P, Pavesi M, Angeli P, Cordoba J, et al. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis. Gastroenterology 2013;144:1426–1437.e9. doi:10.1053/j.gastro.2013.02.042.
(69) Gustot T, Jalan R. Acute-on-chronic liver failure in patients with alcohol-related liver disease The concept of ACLF. vol. 70. 2019. doi:10.1016/j.jhep.2018.12.008.
(70) Singal AK, Shah VH. Current trials and novel therapeutic targets for alcoholic hepatitis. 2019. doi:10.1016/j.jhep.2018.10.026.
(71) Sarin SK, Pande A, Schnabl B. Microbiome as a therapeutic target in alcoholic liver disease. J Hepatol 2018;70:260–72. doi:10.1016/j.jhep.2018.10.019.
(72) Michelena J, Altamirano J, Abraldes JG, Affò S, Morales-Ibanez O, Sancho-Bru P, et al. Systemic inflammatory response and serum lipopolysaccharide levels predict multiple organ failure and death in alcoholic hepatitis. Hepatology 2015;62:762–72. doi:10.1002/hep.27779.
(73) Sersté T, Cornillie A, Njimi H, Pavesi M, Arroyo V, Putignano A, et al. The prognostic value of acute-on-chronic liver failure during the course of severe alcoholic hepatitis. J Hepatol 2018;69:318–24. doi:10.1016/j.jhep.2018.02.022.
(74) Singh V, Sharma AK, Narasimhan RL, Bhalla A, Sharma N, Sharma R. Granulocyte Colony-Stimulating Factor in Severe Alcoholic Hepatitis: A Randomized Pilot Study. Am J Gastroenterol 2014;109:1417–23. doi:10.1038/ajg.2014.154.
(75) Laleman W, Wilmer A, Evenepoel P, Elst I Vander, Zeegers M, Zaman Z, et al. Effect of the molecular adsorbent recirculating system and Prometheus devices on systemic haemodynamics and vasoactive agents in patients with acute-on-chronic alcoholic liver failure. Crit Care 2006;10:1–13. doi:10.1186/cc4985.
(76) Philips CA, Pande A, Shasthry SM, Jamwal KD, Khillan V, Chandel SS, et al. Healthy Donor Fecal Microbiota Transplantation in Steroid-Ineligible Severe Alcoholic Hepatitis: A Pilot Study. Clin Gastroenterol Hepatol 2017;15:600–2. doi:10.1016/j.cgh.2016.10.029.
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe