Noi abordări permit identificarea pacienţilor ce prezintă risc crescut de efecte secundare tratamentului prin radioterapie și, deci, ghidarea lor către alte metode terapeutice.
Radiomica este o abordare bazată pe analiza rezultatelor imagistice convenţionale, menită a oferi clinicianului date importante legate de diagnostic, prognostic și răspuns la tratament (1).
Radiogenomica cercetează asocierile posibile între variaţiile genetice și răspunsul la iradiere. Modificări genetice detectabile prin noile proceduri, ca de exemplu „single nucleotide polymorphisms” (SNP), sunt studiate în legătură cu riscul pacientului de a dezvolta reacţii secundare exagerate la iradiere. Radiogenomica mai este folosită și în scopul elucidării rolului genomicii în răspunsul tumorii la radioterapie (2).
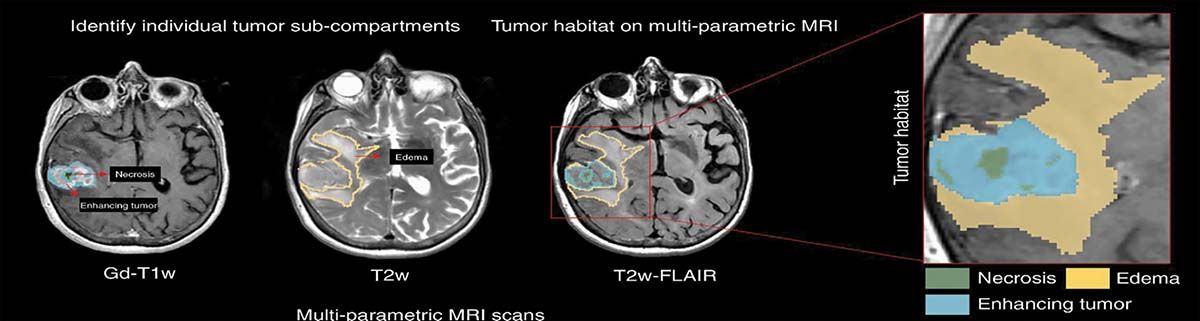
În Figura 1 se poate observa cum o examinare IRM a unui pacient cu o tumoră cerebrală oferă informaţii importante în scopul alegerii tratamentului optim, în special al celui radiologic. Azi, în practica clinică, niciun asemenea factor ca necroza, zona ce acumulează substanţa de contrast (proliferativă) sau edemul peritumoral nu are vreo consecinţă asupra planului de tratament, deci nu va duce la modificarea dozei totale ori la fracţionarea ei în vreun fel.
Fig. 1. Rezonanţă magnetică multiparametrială pentru identificarea unei tumori cerebrale, GBM (glioblastom multiform). Zona centrală reprezintă partea de necroză înconjurată de ţesutul tumoral ce acumulează substanţa de contrast, care este înconjurată de un edem cerebral. Examinarea permite evidenţierea acestor trei componente tumorale prin aplicarea secvenţelor: Gd – T1w, T2w și T2w – Flair

Astăzi, protocoalele NCCN (National Comprehensive Cancer Network) aplicate tumorilor cerebrale, în special glioblastomului multiform (GBM), indică folosirea unei doze totale de 60 Gy în 30 de fracţiuni, în combinaţie cu Temodal. Rezultatul final este că la cinci ani, mai puţin de 10% dintre pacienţi sunt în viaţă. Rata de recidivă locală este maximală. Nu există nicio deosebire în recomandări pentru cazurile în care tumora a fost extirpată sau nu ori dacă există un rest tumoral macroscopic evidenţiat imagistic înainte de începerea radioterapiei sau dacă vorbim de o rezecţie R0, lucru aproape imposibil la GBM.
Dacă ar fi aplicată procedura de dose painting cu utilizarea unei doze mai mari de 60 Gy pe zona cu necroză sau pe cea cu substanţă de contrast și de minimum 60 Gy pe edemul peritumoral, nu este exclus să se obţină rezultate mai promiţătoare decât cele raportate azi.
La GBM, dar și la glioamele cerebrale de grad redus (low grade glioma) a fost identificat un factor de prognostic, și anume prezenţa izocitratului dehidrogenazei (NADPH) (IDH). Acesta ar fi un factor favorabil și ar indica pacienţii la care se așteaptă un răspuns favorabil faţă de pacienţii ce au tipul IDH wild (sălbatic), la care lipsește mutaţia IDH-1. În cadrul analizei edemului peritumoral și a intensităţii texturii în examinarea imagistică, a putut fi făcută o corelaţie cu prezenţa mutaţiei IDH-1. Studiul a fost efectuat pe un grup de 78 de pacienţi (3).
În orice grup de pacienţi supuși radioterapiei există mai multe subgrupuri, în funcţie de radiosensibilitatea tumorilor, dar și de riscul de a dezvolta efecte secundare la nivelul ţesuturilor normale din vecinatate. Radiogenomica, prin procedurile sale, face posibilă determinarea radiosensibilităţii individuale, pe baza profilului stabilităţii evidenţiabil cu ajutorul investigaţiilor SNPs (Procedura Single Nucleotide Polimorfism). Această procedură face posibilă evidenţierea modificărilor la nivelul secvenţelor genelor – prezente la mai mult de 1% din populaţie – ce sunt răspunzătoare de 80% din heterogenitatea interindividuală.
În Figura 2 este prezentat lanţul examinărilor genetice de analiză la nivelul ADN-ului de tipul SNPs ce permit identificarea radiosensibilităţii tumorii, dar și a ţesutului normal la radioterapie.
Fig. 2. Rolul tehnicilor genomice în determinarea radiosensibilităţii tumorilor și a ţesuturilor normale la iradiere (4)
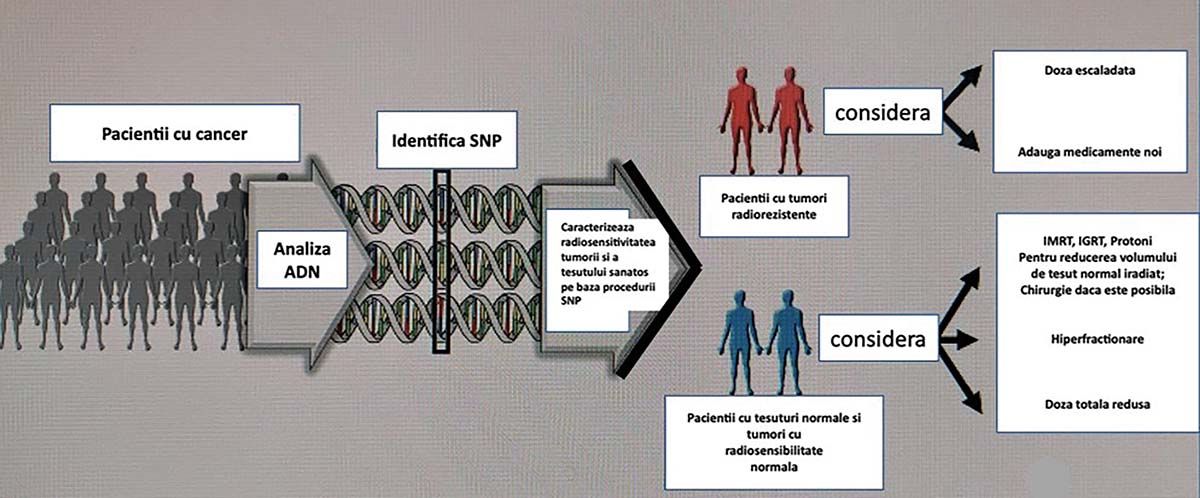
Efectuând analiza ADN-ului pacienţilor și utilizând procedura de SNPs, se pot identifica, din punctul de vedere al radiosensibilităţii la radioterapie, două mari grupe de pacienţi. Prima grupă este cea cu tumori radiorezistente (grupa maro), caz în care trebuie aplicate doze mai mari sau trebuie utilizate substanţe radiosensibilizatoare. Grupa a doua (albastră) include pacienţii cu tumori radiosensibile. La acești pacienţi se utilizează fie tehnicile moderne de iradiere cu intensitate modulată de tipul IMRT (intensity-modulated radiation therapy: VMAT, adică volumetric modulated arc therapy, rapid arc, tomoterapie), cu ghidarea imagistică IGRT, fie protonoterapia, pentru a iradia cât mai puţin ţesut normal. Se poate utiliza și hiperfracţionarea, iar la tumorile radiorezistente trebuie efectuată o escaladare a dozei totale, pentru a obţine un control tumoral local adecvat.
Radioterapia poate induce efecte nedorite la nivelul ţesuturilor normale, care se manifestă prin așa-zise efecte acute, dacă apar în primele trei luni de la terminarea radioterapiei. Un impact sever îl are radioterapia și la nivelul sistemului imunitar, efecte care se manifestă ceva mai târziu, după terminarea radioterapiei (după una sau mai multe luni de la terminarea radioterapiei).
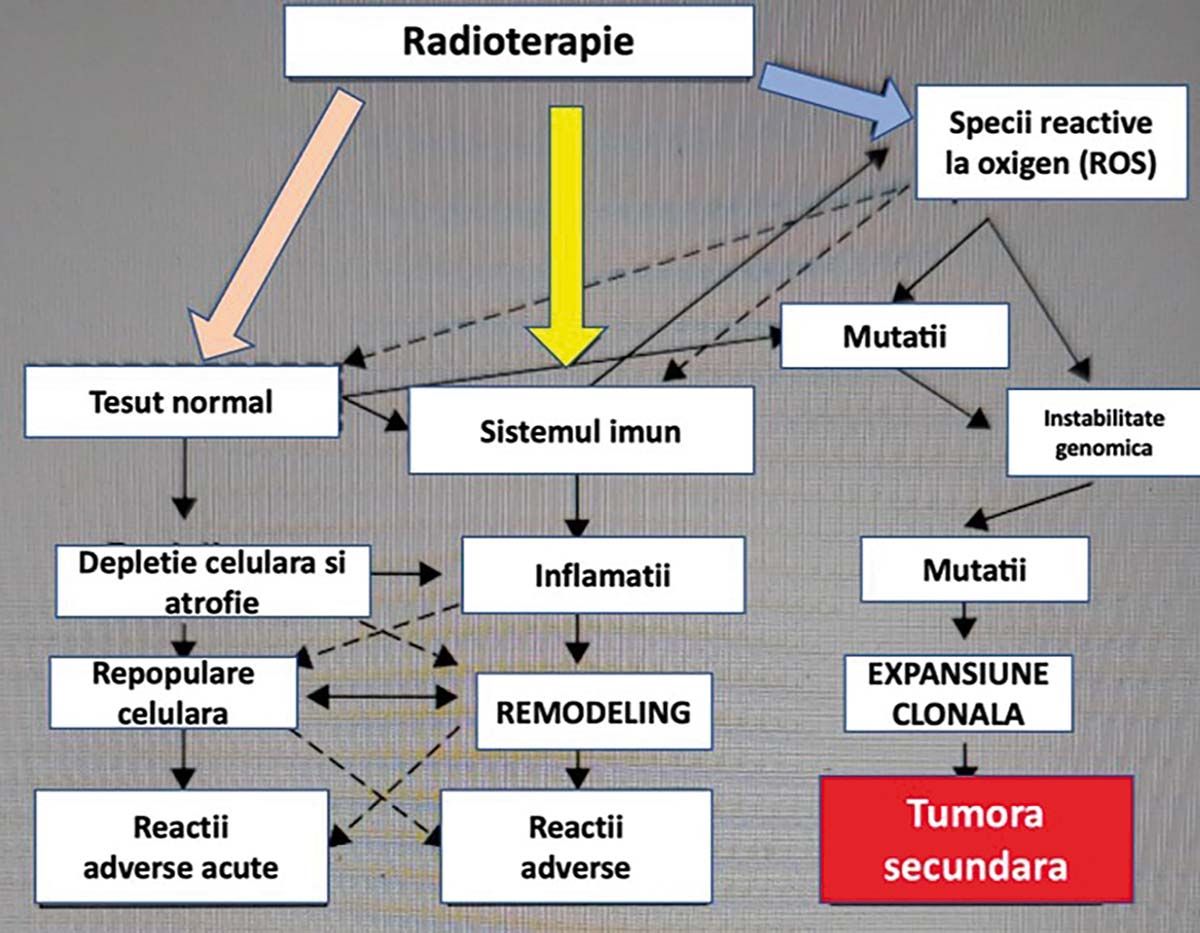
O altă grupă de efecte secundare induse, produse chiar de o singură expunere la radiaţii (în scop diagnostic și terapeutic), poate duce la apariţia mutaţiilor cromozomiale, care mai târziu pot induce tumori secundare, în special la copii (Figura 3).
Fig. 3. Efectele iniţiate de o expunere la radiaţiile ionizante la nivelul ţesutului normal, la nivelul sistemului imunitar și posibilitatea inducerii de tumori secundare (radioinduse), în special în oncopediatrie, unde se aplică o radio-chimioterapie
Probabilitatea inducerii tumorilor secundare la copii este foarte crescută, putând ajunge chiar la 25%. La cei care supravieţuiesc și ating vârsta de 50 de ani, probabilitatea ajunge la 15%. Consecinţa este că în oncopediatrie nu mai este acceptată aplicarea unei radioterapii cu acceleratorul liniar, indiferent de procedura folosită: IMRT, rapid arc, VMAT sau tomoterapie. Este acceptată numai o radioterapie cu protoni.
În România nu există această posibilitate și niciun decident nu a avut sau susţinut o asemenea iniţiativă, deși anual sunt diagnosticate 500 de cazuri noi de cancer la copii. Dintre aceștia, aproximativ 150-160 necesită la un moment dat în evoluţia bolii și o secvenţă de radioterapie.
Efectele secundare, în special apariţia tumorilor radioinduse, reprezintă o problemă majoră, ce ar putea fi redusă prin protonoterapie.
Prevenirea tumorilor secundare (radioinduse)
În oncopediatrie, radioterapia trebuie efectuată în majoritatea cazurilor numai cu ajutorul protonilor. Avantajele majore rezultă din faptul ca doza necesară vindecării locale se poate aplica cu maximă precizie și cu o protecție majoră a țesuturilor normale din jurul tumorii. Această technică face posibilă reducerea incidenței tumorilor secundare radioinduse, care astăzi ajunge la până la 25% dintre copiii iradiați supraviețuitori. În plus, tumorile radioinduse sunt mult mai agresive decât tumora inițială tratată anterior.
Bibliografie
1. Beig et al Neuro-Oncology Advances 2020
2. Sarah L. Kerns, Radiogenomics: Using Genetics to Identify Cancer Patients at Risk for Development of Adverse Effects Following Radiotherapy. Cancer Discov; 4(2); 155–65. ©2014
3. Beig et al. Neuro Oncol.2016;18: 124
4. The Role of Genomic Techniques în Predicting Response to Radiation Therapy, July 15, 2017, Noelle L. (cancerne39twork.com)
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe