Relația alcoolului cu bolile hepatice este particulară, pentru că alcoolul este asociat cu apariția cirozei hepatice și a hepatocarcinomului, boli al căror diagnostic se face în peste 75% dintre cazuri tardiv și în stadii avansate.
 Consumul de alcool rămâne în România și la nivel global singura adicție față de o substanță psihoactivă nereglementată de instituții de control (1). Alături de tutun și de alimentele bogate în sare și zahăr, alcoolul este principala cauză a creșterii incidenței bolilor necontagioase (2).
Consumul de alcool rămâne în România și la nivel global singura adicție față de o substanță psihoactivă nereglementată de instituții de control (1). Alături de tutun și de alimentele bogate în sare și zahăr, alcoolul este principala cauză a creșterii incidenței bolilor necontagioase (2).
Deși consumul de alcool în context social se consideră a fi nedăunător sănătății, date recente demonstrează contrariul (3), mai ales în rândul populației tinere și de vârstă mijlocie (15-49 de ani), unde este principala cauză de mortalitate (aproximativ 12% în cazul bărbaților și 4% în cel al femeilor). Pe lângă implicarea ca factor de risc pentru 23 de boli, consumul de alcool este răspunzător și de un număr semnificativ de violențe în familii și în comunități și de scăderea productivității muncii.
Bolile hepatice sunt răspunzătoare de 2,3% din totalul deceselor (1,25 milioane de persoane decedate anual), proporție în creștere cu peste 50% în ultimii 30 de ani. Datele OMS demonstrează pentru România cel mai mare număr de decese prin boli hepatice la nivel european (40/100.000 de locuitori), dar, dintre acestea, peste jumătate sunt catalogate ca având etiologie neprecizată. Atât tiparul consumului de alcool (moderat vs. abuziv, constant vs. ocazional), cât și tipul (bere, vin sau tărie) și calitatea băuturilor influențează progresia spre stadii avansate ale bolii hepatice alcoolice (BHA).
Lipsa reglementării, disponibilitatea crescută a băuturilor (mai ales de calitate proastă) și producția domestică (asociată cu o cultură a beției) sunt elemente care explică incidența crescută și mortalitatea ridicată a BHA în România și reprezintă tot atâtea posibile direcții de acțiune pentru politici de sănătate publică orientate spre reducerea impactului negativ al consumului de alcool.
Afectarea hepatică este dependentă de cantitatea de alcool. Majoritatea pacienților cu boală hepatică avansată sunt băutori abuzivi (>120 de unități de alcool/săptămână în cazul bărbaților și >80 de unități în cazul femeilor; 1 sticlă de bere 330 ml = 1,5 unități; 1 pahar (175 ml) de vin = 2 unități; 25 ml tărie = 1 unitate) (7,8). Deși bărbații suferă și decedează mai frecvent decât femeile din cauza bolilor asociate consumului de alcool, nu există dovezi clare care să demonstreze un determinism genetic legat de sexul pacienților. Cu toate acestea, femeile expuse aceluiași consum dezvoltă mai frecvent tulburări asociate alcoolului decât bărbații (1).
Patogeneza BHA este strâns legată de apariția steatozei hepatice. Consumul de alcool este răspunzător de perturbarea tuturor proceselor responsabile de menținerea homeostaziei lipidice: expresia, oxidarea și secreția grăsimilor la nivel hepatic (9). Steatoza hepatică apare rapid la toți subiecții cu consum abuziv de alcool și este o condiție reversibilă odată cu întreruperea consumului (10).
Depunerea lipidică intrahepatocitară poate fi micro- sau macroveziculară, iar intensitatea ei poate sugera severitatea per ansamblu și modelul evolutiv al BHA (11). Apariția steatozei în BHA este, în parte, consecința efectului direct al alcoolului (reducerea beta-oxidării acizilor grași și creșterea sintezei de trigliceride), dar și consecința unor procese metabolice și celulare declanșate de consumul de alcool (9). Astfel, sunt afectate:
a) moleculele transportatoare de acizi grași (AG), în primul rând sistemul CD36/FAT (9,12);
b) sinteza de AG și trigliceride prin (i) stimularea lipogenezei via SREBP-1c și ChREBP – sistem de control influențat în cazul consumului de alcool de activarea TNF-alfa, a PPAR-alfa și a proteinelor de șoc termic, (ii) inhibarea controlului lipogenezei prin AMPK și SIRT1 și prin (iii) inhibiția sintezei de adiponectină și a expresiei hepatice a receptorilor acesteia, alături de inhibiția sintezei FGF15 la nivelul ileonului terminal;
c) beta-oxidarea mitocondrială a AG, prin influențarea la nivel transcripțional sau posttranscripțional a sintezei și activității carnitin-palmitoil transferazei I (9).
d) balanța nutrițională, prin înlocuirea cu etanol a subtratului energetic în proporție de 50% și prin generarea și menținerea unor tulburări malabsorbtive, în primul rând a carnitinei (9);
e) sinteza și secreția de colesterol (9);
f) stimularea lipocalinei-2 (13) și perturbarea autofagiei (14);
g) inducerea dezechilibrului microbiomului intestinal (15).
Steatoza hepatică este consecința obligatorie a consumului de alcool și este 100% reversibilă odată cu oprirea consumului (10). Această situație reprezintă BHA incipientă (16). Aproximativ 30% dintre pacienți, prin persistența consumului, progresează spre steatohepatita alcoolică (SHA), condiție caracterizată de inflamație și fibroză, cu debut în zona perivenulară și progresie spre spațiile porte (17).
Aproximativ 20% dintre pacienții cu SHA progresează spre BHA avansată, concept care include hepatita alcoolică (HA) și ciroza alcoolică, cu complicațiile cunoscute: ascită, sângerare variceală sau apariția hepatocarcinomului (16). Progresia spre stadiile avansate este influențată, pe lângă consumul de alcool, și de factori genetici (sexul feminin, descendența hispanică, variante ale genei PNPLA3) sau de mediu (asocierea infecției virale, obezitatea, fumatul, încărcarea cu fier sau consumul de cafea) (18).
Progresia spre SHA și BHA cu fibroză avansată, precum și apariția HA sunt rezultatul implicării mai multor populații celulare, interconectării mai multor căi de acțiune din diverse organe și sisteme (19).
Evaluarea consumului dăunător de alcool trebuie să fie preocuparea constantă a hepatologului atunci când consultă un pacient cu teste funcționale hepatice modificate. Pacienții cu consum de alcool crescut (>3 unități/zi în cazul bărbaților și >2 unități/zi în cel al femeilor) prezintă risc crescut de a dezvolta BHA avansată (16). Astfel, utilizarea chestionarului AUDIT (Alcohol Use Disorders Inventory Test – http://auditscreen.org/using-audit) poate selecta persoanele cu risc crescut de a avea BHA și este recomandat ca metodă de screening atât în medicina primară, cât și de către hepatologi (16,20). Ca alternativă care să contrabalanseze consumul de timp, se recomandă utilizarea AUDIT-c, care implică evaluarea doar a primilor trei itemi ai chestionarului:
1) cât de des se întâmplă să consumați băuturi alcoolice;
2) câte unități consumați de obicei atunci când beți;
3) cât de des se întâmplă să beți mai mult de 5 unități.
Un scor peste 5 la AUDIT-c impune efectuarea întregului chestionar și evalurea pentru BHA.
Pentru evaluare, se efectuează testele de rutină care verifică funcția hepatică – bilirubina, ALT, AST, GGT, fosfataza alcalină, hemoleucograma și coagulograma. Dintre acestea, AST, ALT, raportul AST/ALT supraunitar, GGT și VEM pot reprezenta markeri direcți ai consumului de alcool, dar cu specificitate joasă, mai ales față de steatohepatita nonalcoolică (NASH) (21). Pentru o diferențiere mai corectă a BHA față de NASH, a fost propus un model ce include raportul AST/ALT, VEM, indicele de masă corporală și sexul (22). Desigur că este necesară excluderea altor cauze de boală hepatică, astfel că se vor testa: AgHBs, antiHCV, anticorpii antinucleari, antimitocondriali, anti-mușchi neted, anti-LKM, ceruloplasmina, transferina, alfa-1 antitripsina.
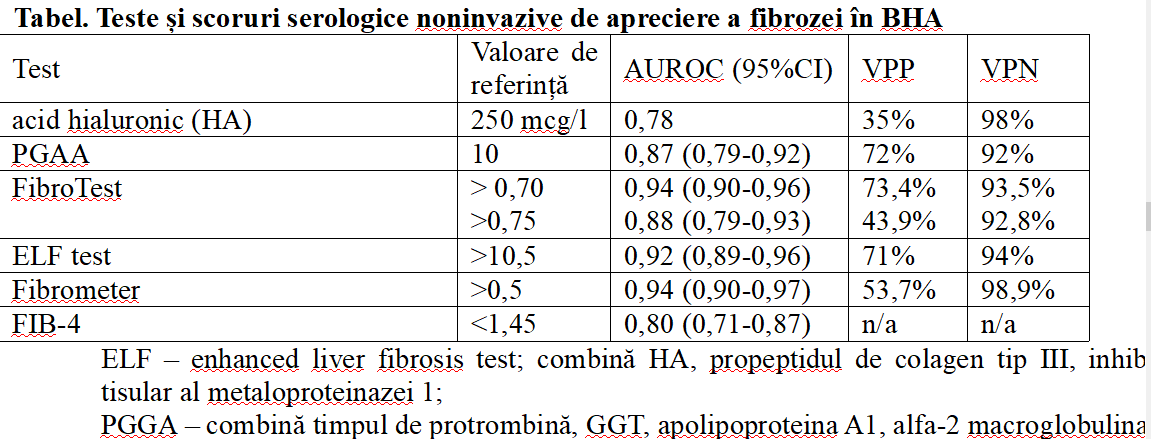
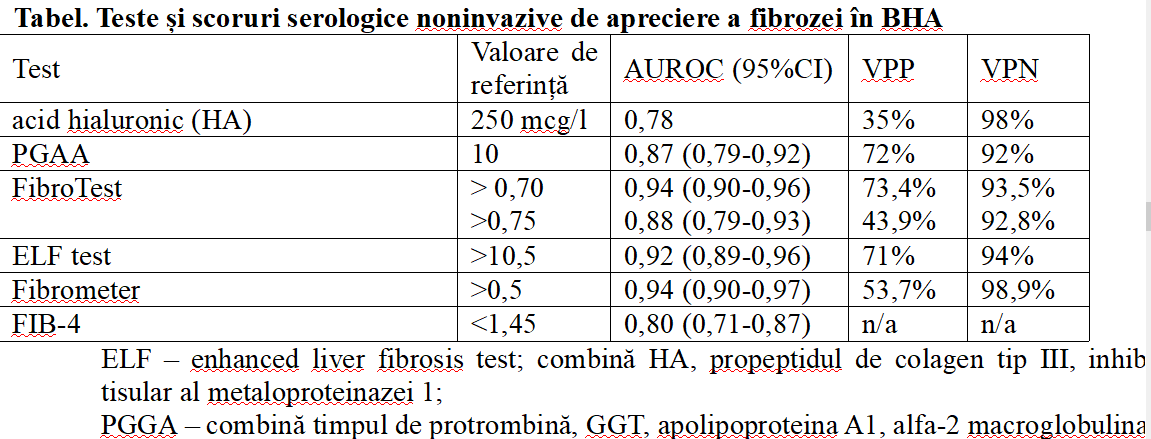
Cuantificarea fibrozei hepatice este relevantă, deoarece reprezintă principalul element de progresie a bolii, iar aceasta poate fi prezentă chiar și atunci când testele funcționale hepatice rămân nemodificate. Pentru acest scop avem la dispoziție teste serologice sau imagistice. Testele serologice cu aplicabilitate în cadrul BHA sunt sumarizate în tabel (20). Performanțele diagnostice ale testelor sunt asemănătoare, iar alegerea unuia în defavoarea altuia depinde de experiența locală și de costurile asociate.
Fibroza hepatică se evaluează și folosind metode imagistice, cele mai utilizate fiind elastografia ultrasonoră, folosind fie tehnica impulsională tranzitorie, fie undele de forfecare cu intensitate mare. În acest mod se calculează rigiditatea hepatică, un parametru puternic asociat cu fibroza. În interpretarea rezultatelor trebuie să se țină cont de prezența factorilor de eroare, precum inflamația hepatică, balonizarea hepatocitară sau staza biliară, care pot genera valori fals crescute (23,24). Trebuie ținut cont că elastografia este mai performantă în excluderea fibrozei avansate sau a cirozei, iar acuratețea metodei este mai redusă în cazul prezenței fibrozei într-un grad intermediar sau redus (25).
Datorită acestui fapt, pentru cuantificarea corectă a fibrozei la pacienții cu BHA se recomandă reexaminarea elastografică după o perioadă de abstinență (de obicei de două săptămâni) (26). O valoare >8 kPa după retestare ridică suspiciunea fibrozei avansate și necesită evaluare de specialitate; valori >12 kPa ridică suspiciunea unei boli avansate, iar valori >20 kPa impun screeningul pentru varice esofagiene (27).
Standardul pentru diagnosticul BHA rămâne unul morfologic, astfel încât biopsia hepatică trebuie să se mențină printre opțiunile de investigație. Se indică atunci când celelalte teste sunt neconcludente sau atunci când este suspicionată (și) o altă etiologie a bolii hepatice. Indicația este mai importantă în cazul suspiciunii de hepatită alcoolică (16,20). Riscurile manoperei sunt reprezentate de sângerarea intrahepatică și de pneumotorace, incidența lor fiind de 2% (28). Biopsia se poate realiza percutan sau transjugular pentru pacienții cu risc de sângerare crescut.
Caracteristicile histologice ale BHA sunt prezența steatozei (macro-, microveziculară sau mixtă), balonizarea și necroza celulară, prezența infiltratului inflamator (predominant neutrofilic), a fibrozei perivenulare, a colestazei intra- sau periductulare, a megamitocondriilor sau a corpilor hialini (Mallory-Denk) (29). Aspectele histologice sunt factori predictivi pentru supraviețuirea pe termen lung și scurt a pacienților și pentru răspunsul la corticoterapie (30,31).
Fibroza este singurul factor independent care prezice supraviețuirea pe termen lung la pacienții cu BHA (32). În mod particular, în cazul hepatitei alcoolice (HA) se folosește cuantificarea Alcoholic Hepatitis Histologic Score (AHHS), care combină și punctează elementele histologice menționate, astfel încât un punctaj >7 este diagnostic pentru HA severă și reprezintă un factor predictiv al mortalității la 90 de zile (33).
Atunci când biopsia nu este disponibilă sau nu se poate efectua din cauza riscurilor crescute asociate, trebuie apelat la metode noninvazive surogat. Pentru aprecierea steatozei avem la îndemână metode imagistice, cea mai utilizată fiind ecografia abdominală (US), care, datorită caracterului noninvaziv, repetitiv și a disponibilității crescute, reprezintă prima modalitate de evaluare a pacienților cu suspiciune de BHA. Sensibilitatea și specificitatea pentru detecția steatozei sunt bune, variind între 60% și 94% și, respectiv, 88% și 95% (34).
Caracterul operator și dependent de echipament fac US mai puțin performantă pentru detecția steatozei ușoare (35), iar metoda nu permite diferențierea steatozei de fibroză. Spectroscopia prin rezonanță magnetică este o alternativă costisitoare de apreciere a steatozei, care are însă avantajul de a avea o acuratețe mare (în jur de 90%, pentru încărcarea grasă de cel puțin 5%) și o putere discriminativă superioară (36).
De un real folos în practică este utilizarea parametrului de atenuare controlată (CAP), disponibil alături de elastografia impulsională în cadrul FibroScan-ului. CAP s-a dovedit superior US în aprecierea steatozei la pacienții cu BHA și prezintă o specificitate mare (88%) pentru detecția oricărui grad de încărcare grasă la valori >290 dB/m (37).
Aprecierea noninvazivă a fibrozei se face prin metode serologice sau prin elastografie, așa cum s-a detaliat mai sus. Trebuie menționat faptul că pentru a evita dificultățile de interpretare a valorilor crescute ale rigidității hepatice în contextul hepatocitolizei, s-a dezvoltat un algoritm de interpretare a rezultatelor ca funcție exponențială a valorilor AST (26).
Pentru diagnosticul noninvaziv al celorlalte modificări histologice, opțiunile sunt mai limitate. Una dintre acestea este citokeratina 18 (epitopii M30 și M65), care se asociază cu HA și se corelează bine cu extensia necrozei hepatice demonstrată histologic, fiind un marker al apoptozei (38). Mai mult decât atât, citokinele proinflamatorii (TNF-alfa, IL-8 sau 1-alfa) se asociază cu leziunile histologice de hepatită alcoolică, iar variațiile micro-ARN în celulele Kupffer (crește miR-155), hepatocite (scade miR-122) sau circulație (cresc miR-192 și 30a) pot, de asemenea, sugera un tablou serologic specific pentru HA (39).
Aprecierea și obiectivarea consumului de alcool reprezintă un aspect important la pacienții cu anamneză negativă sau cu BHA pentru obiectivarea abstinenței. Testele cel mai frecvent utilizate pentru obiectivarea consumului de alcool sunt ALT, AST, GGT și volumul eritrocitar mediu, în principal GGT având valori semnificativ mai mari la pacienții cu BHA decât la cei cu patologie hepatică de alte etiologii (40). Aceste teste sunt indicatori indirecți și nu sunt specifice sau sensibile pentru detectarea consumului de alcool (41).
GGT poate avea valori mult crescute în prezența fibrozei avansate, iar utilizarea raportului AST/ALT nu este adecvată în contextul cirozei (41,42). O altă metodă este măsurarea nivelului seric al transferinei deficitare în carbohidrat (CDT), însă aceasta se indică doar în cazul suspiciunii unui consum masiv de alcool (50-80 g/zi timp de una-două săptămâni pentru ca testul să fie pozitiv), iar testul poate fi fals-negativ la pacienții cirotici (41,43).
Metodele directe de evaluare sunt reprezentate de etil-glucuronid (EtG), etil-sulfat, fosfatidil-etanol și esteri ai etanolului cu acizi grași. Ei sunt produși prin metabolizarea nonoxidativă a etanolului, sunt înalt specifici și prezintă avantajul de a fi detectabili pentru mai mult timp decât etanolul din sânge sau din aerul expirat (44). EtG-ul urinar, detectabil până la 80 de ore de la încetarea consumului, este utilizat ca metodă standard în monitorizarea abstinenței în cadrul programelor pentru pacienți dependenți de alcool, pentru pacienții care se înrolează pe lista de transplant hepatic și în diverse cazuri juridice.
Acest test poate fi pozitiv și în cazul consumului accidental de alcool (ciocolată cu lichior, apă de gură etc.) (45). EtG poate fi măsurat și în firul de păr, metodă ce permite monitorizarea pe termen lung a consumului, dar interpretarea trebuie făcută cu atenție în cazul în care fragmentul analizat este de sub 3 cm (un consum recent de alcool poate da rezultate fals-negative) sau peste 6 cm (nivelurile de EtG pot fi reduse prin tratare sau vopsire) (46).
(1) Hydes T, Gilmore W, Sheron N, Gilmore I. Treating alcohol-related liver disease from a public health perspective. vol. 70. 2019. doi:10.1016/j.jhep.2018.10.036.
(2) WHO. World Health Organisation., Organisation. WWH, Who. Global status report on noncommunicable diseases. World Health 2010. doi:ISBN 978 92 4 156422 9.
(3) WHO. Global status report on alcohol and health. World Heal Organ 2014. doi:/entity/substance_abuse/publications/global_alcohol_report/en/index.html.
(4) Griswold MG, Fullman N, Hawley C, Arian N, M Zimsen SR, Tymeson HD, et al. Alcohol use and burden for 195 countries and territories, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016 2018. doi:10.1016/S0140-6736(18)31310-2.
(5) Stein E, Cruz-Lemini M, Altamirano J, Ndugga N, Couper D, Abraldes JG, et al. Heavy daily alcohol intake at the population level predicts the weight of alcohol in cirrhosis burden worldwide. J Hepatol 2016. doi:10.1016/j.jhep.2016.06.018.
(6) Anderson P, Chisholm D, Fuhr DC. Effectiveness and cost-effectiveness of policies and programmes to reduce the harm caused by alcohol. Lancet 2009;373:2234–46. doi:10.1016/S0140-6736(09)60744-3.
(7) Corrao G, Bagnardi V, Zambon A, Torchio P. Meta-Analysis Of Alcohol Intake In Relation To Risk Of Liver Cirrhosis. Alcohol Alcohol 1998;33:381–92. doi:10.1093/oxfordjournals.alcalc.a008408.
(8) Alcohol units - NHS n.d. https://www.nhs.uk/live-well/alcohol-support/calculating-alcohol-units/ (accessed February 25, 2019).
(9) You M, Arteel GE. Effect of ethanol on lipid metabolism. 2019. doi:10.1016/j.jhep.2018.10.037.
(10) Ishak KG, Zimmerman HJ, Ray MB. Alcoholic Liver Disease: Pathologic, Pathogenetic and Clinical Aspects. Alcohol Clin Exp Res 1991;15:45–66. doi:10.1111/j.1530-0277.1991.tb00518.x.
(11) Day CP, James OFW. Hepatic steatosis: Innocent bystander or guilty party? Hepatology 1998;27:1463–6. doi:10.1002/hep.510270601.
(12) Clugston RD, Yuen JJ, Hu Y, Abumrad NA, Berk PD, Goldberg IJ, et al. CD36-deficient mice are resistant to alcohol- and high-carbohydrate-induced hepatic steatosis. J Lipid Res 2014;55:239–46. doi:10.1194/jlr.M041863.
(13) Cai Y, Jogasuria A, Yin H, Xu M-J, Hu X, Wang J, et al. The Detrimental Role Played by Lipocalin-2 in Alcoholic Fatty Liver in Mice. Am J Pathol 2016;186:2417–28. doi:10.1016/J.AJPATH.2016.05.006.
(14) Thomes PG, Trambly CS, Fox HS, Tuma DJ, Donohue TM. Acute and Chronic Ethanol Administration Differentially Modulate Hepatic Autophagy and Transcription Factor EB. Alcohol Clin Exp Res 2015;39:2354–63. doi:10.1111/acer.12904.
(15) Stärkel P, Schnabl B. Bidirectional Communication between Liver and Gut during Alcoholic Liver Disease. Semin Liver Dis 2016;36:331–9. doi:10.1055/s-0036-1593882.
(16) Singal AK, Bataller R, Ahn J, Kamath PS, Shah VH. ACG Clinical Guideline: Alcoholic Liver Disease. Am J Gastroenterol 2018. doi:10.1038/ajg.2017.469.
(17) O'Shea R, Dasarathy S, McCulloough AJ APC. AASLD Practice Guidelines Alcoholic Liver Disease 2009. doi:10.1002/hep.23258.
(18) Gao B. Alcoholic Liver Disease: Pathogenesis and New Therapeutics Targets. Gastroenterology 2011;141:1572–85. doi:10.1053/j.gastro.2011.09.002.Alcoholic.
(19) Gao B, Ahmad MF, Nagy LE, Tsukamoto H. Inflammatory pathways in alcoholic steatohepatitis. J Hepatol 2019. doi:10.1016/j.jhep.2018.10.023.
(20) Thursz M, Gual A, Lackner C, Mathurin P, Moreno C, Spahr L, et al. EASL Clinical Practice Guidelines: Management of alcohol-related liver disease. J Hepatol 2018. doi:10.1016/j.jhep.2018.03.018.
(21) Gough G, Heathers L, Puckett D, Westerhold C, Ren X, Yu Z, et al. The Utility of Commonly Used Laboratory Tests to Screen for Excessive Alcohol Use in Clinical Practice. Alcohol Clin Exp Res 2015;39:1493–500. doi:10.1111/acer.12780.
(22) Dunn W, Angulo P, Sanderson S, Jamil LH, Stadheim L, Rosen C, et al. Utility of a New Model to Diagnose an Alcohol Basis for Steatohepatitis. Gastroenterology 2006;131:1057–63. doi:10.1053/j.gastro.2006.08.020.
(23) Mueller S, Millonig G, Sarovska L, Friedrich S, Reimann FM, Pritsch M, et al. Increased liver stiffness in alcoholic liver disease: differentiating fibrosis from steatohepatitis. World J Gastroenterol 2010;16:966–72. doi:10.3748/wjg.v16.i8.966.
(24) Castera L, Pinzani M. Biopsy and non-invasive methods for the diagnosis of liver fibrosis: does it take two to tango? Gut 2010;59:861–6.
(25) Stickel F, Datz C, Hampe J BR. Pathophysiology and Management of Alcoholic Liver Disease: Update 2016. Gut Liver 2017;11:173–88.
(26) Mueller S, Englert S, Seitz HK, Badea RI, Erhardt A, Bozaari B, et al. Inflammation-adapted liver stiffness values for improved fibrosis staging in patients with hepatitis C virus and alcoholic liver disease. Liver Int 2015;35:2514–21. doi:10.1111/liv.12904.
(27) Mueller S, Seitz HK, Rausch V. Non-invasive diagnosis of alcoholic liver disease. World J Gastroenterol 2014. doi:10.3748/wjg.v20.i40.14626.
(28) Filingeri V, Francioso S, Sforza D, Santopaolo F, Oddi FM TG. A retrospective analysis of 1.011 percutaneous liver biopsies performed in patients with liver transplantation or liver disease: ultrasonography can reduce complications? Eur Rev Med Pharmacol Sci 2016;20:3609–17.
(29) R. N .M. MacSween ADB. Histologic Spectrum of Alcoholic Liver Disease. Semin Liver Dis 1986;6:221–32.
(30) P Mathurin, V Duchatelle, MJ Ramond, C Degott, P Bedossa, S Erlinger, JP Benhamou, JC Chaput, B Rueff TP. Survival and prognostic factors in patients with severe alcoholic hepatitis treated with prednisolone. Gastroenterology 1996;110:1847–53.
(31) Helena Cortez-Pinto, Amélia Baptista, Maria Ermelinda Camilo MC de M. Nonalcoholic Steatohepatitis—A Long-Term Follow-Up Study: Comparison with Alcoholic Hepatitis in Ambulatory and Hospitalized Patients. Dig Dis Sci 2003;48:1909–1913.
(32) Carolin Lackner, Andrea Berghold, Ramon Bataller RES. Histological parameters and alcohol abstinence determine long-term prognosis in patients with alcoholic liver disease. J Hepatol 2017;66:610–8.
(33) J Altamirano, R Miquel, A Katoonizadeh, JG Abraldes, A Duarte-Rojo AL. A histologic scoring system for prognosis of patients with alcoholic hepatitis. Gastroenterology 2014;146:1231–9.
(34) Lupşor-Platon M, Stefǎnescu H, Muresçan D, Florea M, Erzsébet Szász M, Maniu A, et al. Noninvasive assessment of liver steatosis using ultrasound methods. Med Ultrason 2014;16. doi:10.11152/mu.2013.2066.163.1mlp.
(35) Strauss S, Gavish E, Gottlieb P, Katsnelson L. Interobserver and Intraobserver Variability in the Sonographic Assessment of Fatty Liver. Am J Roentgenol 2007;189:W320–3. doi:10.2214/AJR.07.2123.
(36) Noureddin M, Lam J, Peterson MR, Middleton M, Hamilton G, Le T-A, et al. Utility of magnetic resonance imaging versus histology for quantifying changes in liver fat in nonalcoholic fatty liver disease trials. Hepatology 2013;58:1930–40. doi:10.1002/hep.26455.
(37) Thiele M, Rausch V, Fluhr G, Kjærgaard M, Piecha F, Mueller J, et al. Controlled attenuation parameter and alcoholic hepatic steatosis: Diagnostic accuracy and role of alcohol detoxification. J Hepatol 2018;68:1025–32. doi:10.1016/J.JHEP.2017.12.029.
(38) Mueller S, Nahon P, Rausch V, Peccerella T, Silva I, Yagmur E, et al. Caspase‐cleaved keratin‐18 fragments increase during alcohol withdrawal and predict liver‐related death in patients with alcoholic liver disease. Hepatology 2017;66:96–107.
(39) Moreno C, Mueller S, Szabo G. Non-invasive diagnosis and biomarkers in alcohol-related liver disease. 2019. doi:10.1016/j.jhep.2018.11.025.
(40) HK S. Additive effects of moderate drinking and obesity on serum gamma-glutamyl transferase. Am J Clin Nutr 2006;83:1252–3.
(41) Hock B. Validity of carbohydrate‐deficient transferrin (%CDT), γ‐glutamyltransferase (γ‐GT) and mean corpuscular erythrocyte volume (MCV) as biomarkers for chronic alcohol abuse: a study in patients with alcohol dependence and liver disorders of non‐alcoholic and. Addiction 2005;100:1477–86.
(42) Thierry Poynard, Alain Aubert, Pierre Bedossa, Annie Abella, Sylvie Naveau, Francois Paraf JCC. A simple biological index for detection of alcoholic liver disease in drinkers. Gastroenterology 1991;100:1397–402.
(43) Anders Helander, Jos Wielders, Raymond Anton, Torsten Arndt, Vincenza Bianchi, Jean Deenmamode, Jan-Olof Jeppsson, John B. Whitfield, Cas Weykamp FS. Reprint of Standardisation and use of the alcohol biomarker carbohydrate-deficient transferrin (CDT). Clin Chim Acta 2017;467:15–20.
(44) P Cabarcos, I Alvarez, MJ Tabernero AB. Determination of direct alcohol markers: a review. Anal Bioanal Chem 2015;407:4907–4925.
(45) K Staufer, H Andresen, E Vettorazzi, N Tobias, B Nashan Ms. Urinary ethyl glucuronide as a novel screening tool in patients pre- and post-liver transplantation improves detection of alcohol consumption. Hepatology 2011;54:1640–1649.
(46) BM Appenzeller, R Agirman, P Neuberg, M Yegles RW. Segmental determination of ethyl glucuronide in hair: a pilot study. Forensic Sci Int 2007;173:87–92.
(47) Tiniakos DG. Liver biopsy in alcoholic and non-alcoholic steatohepatitis patients. Gastroentérologie Clin Biol 2009;33:930–9. doi:10.1016/J.GCB.2009.05.009.
(48) Thursz MR, Richardson P, Allison M, Austin A, Bowers M, Day CP, et al. Prednisolone or Pentoxifylline for Alcoholic Hepatitis. N Engl J Med 2015;372:1619–28. doi:10.1056/NEJMoa1412278.
(49) Maddrey WC, Boitnott JK, Bedine MS, Weber FL, Mezey E, White RI. Corticosteroid therapy of alcoholic hepatitis. Gastroenterology 1978.
(50) Dunn W, Jamil LH, Brown LS, Wiesner RH, Kim WR, Menon KVN, et al. MELD accurately predicts mortality in patients with alcoholic hepatitis. Hepatology 2005. doi:10.1002/hep.20503.
(51) Forrest EH, Morris AJ, Stewart S, Phillips M, Oo YH, Fisher NC, et al. The Glasgow alcoholic hepatitis score identifies patients who may benefit from corticosteroids. Gut 2007. doi:10.1136/gut.2006.099226.
(52) Dominguez M, Rincón D, Abraldes JG, Miquel R, Colmenero J, Bellot P, et al. A new scoring system for prognostic stratification of patients with alcoholic hepatitis. Am J Gastroenterol 2008. doi:10.1111/j.1572-0241.2008.02104.x.
(53) Louvet A, Naveau S, Abdelnour M, Ramond MJ, Diaz E, Fartoux L, et al. The Lille model: A new tool for therapeutic strategy in patients with severe alcoholic hepatitis treated with steroids. Hepatology 2007;45:1348–54. doi:10.1002/hep.21607.
(54) Kamath PS, Shah VH. MELDing the Lille Score to More Accurately Predict Mortality in Alcoholic Hepatitis HHS Public Access. Gastroenterology 2015;149:281–3. doi:10.1053/j.gastro.2015.06.020.
(55) Louvet A, Labreuche J, Artru F, Boursier J, Kim DJ, O’Grady J, et al. Combining data from liver disease scoring systems better predicts outcomes of patients with alcoholic hepatitis. Gastroenterology 2015. doi:10.1053/j.gastro.2015.04.044.
(56) Thursz M, Morgan TR. Treatment of Severe Alcoholic Hepatitis. Gastroenterology 2016;150:1823–34. doi:10.1053/j.gastro.2016.02.074.
(57) Singal AK, Walia I, Singal A, Soloway RD. Corticosteroids and pentoxifylline for the treatment of alcoholic hepatitis: Current status. World J Hepatol 2011;3:205–10. doi:10.4254/wjh.v3.i8.205.
(58) Mathurin P, O’Grady J, Carithers RL, Phillips M, Louvet A, Mendenhall CL, et al. Corticosteroids improve short-term survival in patients with severe alcoholic hepatitis: Meta-analysis of individual patient data. Gut 2011. doi:10.1136/gut.2010.224097.
(59) Hmoud BS, Patel K, Bataller R, Singal AK. Corticosteroids and occurrence of and mortality from infections in severe alcoholic hepatitis: A meta-analysis of randomized trials. Liver Int 2016. doi:10.1111/liv.12939.
(60) Louvet A, Wartel F, Castel H, Dharancy S, Hollebecque A, Canva-Delcambre V, et al. Infection in Patients With Severe Alcoholic Hepatitis Treated With Steroids: Early Response to Therapy Is the Key Factor. Gastroenterology 2009. doi:10.1053/j.gastro.2009.04.062.
(61) Dey A, Cederbaum AI. Alcohol and oxidative liver injury. Hepatology 2006. doi:10.1002/hep.20957.
(62) Nguyen-Khac E, Thevenot T, Piquet MA, Benferhat S, Goria O, Chatelain D, et al. Glucocorticoids plus N-acetylcysteine in severe alcoholic hepatitis. N Engl J Med 2011. doi:10.1056/NEJMoa1101214.
(63) Foxcroft DR, Coombes L, Wood S, Allen D, Almeida Santimano NML. Motivational interviewing for alcohol misuse in young adults. Cochrane Database Syst Rev 2015. doi:10.1002/14651858.CD007025.pub3.
(64) Addolorato G, Mirijello A, Barrio P, Gual A. Treatment of alcohol use disorders in patients with alcoholic liver disease. J Hepatol 2016;65:618–30. doi:10.1016/J.JHEP.2016.04.029.
(65) Gustot T, Jalan R. Acute-on-chronic liver failure in patients with alcoholic liver disease. J Hepatol 2018;70:319–27. doi:10.1016/j.jhep.2018.12.008.
(66) Jalan R, Stadlbauer V, Sen S, Cheshire L, Chang Y-M, Mookerjee RP. Role of predisposition, injury, response and organ failure in the prognosis of patients with acute-on-chronic liver failure: a prospective cohort study. Crit Care 2012;16:R227. doi:10.1186/cc11882.
(67) Solé C, Solà E. Update on acute-on-chronic liver failure. Gastroenterol Hepatol 2018;41:43–53. doi:10.1016/j.gastrohep.2017.05.012.
(68) Moreau R, Jalan R, Gines P, Pavesi M, Angeli P, Cordoba J, et al. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis. Gastroenterology 2013;144:1426–1437.e9. doi:10.1053/j.gastro.2013.02.042.
(69) Gustot T, Jalan R. Acute-on-chronic liver failure in patients with alcohol-related liver disease The concept of ACLF. vol. 70. 2019. doi:10.1016/j.jhep.2018.12.008.
(70) Singal AK, Shah VH. Current trials and novel therapeutic targets for alcoholic hepatitis. 2019. doi:10.1016/j.jhep.2018.10.026.
(71) Sarin SK, Pande A, Schnabl B. Microbiome as a therapeutic target in alcoholic liver disease. J Hepatol 2018;70:260–72. doi:10.1016/j.jhep.2018.10.019.
(72) Michelena J, Altamirano J, Abraldes JG, Affò S, Morales-Ibanez O, Sancho-Bru P, et al. Systemic inflammatory response and serum lipopolysaccharide levels predict multiple organ failure and death in alcoholic hepatitis. Hepatology 2015;62:762–72. doi:10.1002/hep.27779.
(73) Sersté T, Cornillie A, Njimi H, Pavesi M, Arroyo V, Putignano A, et al. The prognostic value of acute-on-chronic liver failure during the course of severe alcoholic hepatitis. J Hepatol 2018;69:318–24. doi:10.1016/j.jhep.2018.02.022.
(74) Singh V, Sharma AK, Narasimhan RL, Bhalla A, Sharma N, Sharma R. Granulocyte Colony-Stimulating Factor in Severe Alcoholic Hepatitis: A Randomized Pilot Study. Am J Gastroenterol 2014;109:1417–23. doi:10.1038/ajg.2014.154.
(75) Laleman W, Wilmer A, Evenepoel P, Elst I Vander, Zeegers M, Zaman Z, et al. Effect of the molecular adsorbent recirculating system and Prometheus devices on systemic haemodynamics and vasoactive agents in patients with acute-on-chronic alcoholic liver failure. Crit Care 2006;10:1–13. doi:10.1186/cc4985.
(76) Philips CA, Pande A, Shasthry SM, Jamwal KD, Khillan V, Chandel SS, et al. Healthy Donor Fecal Microbiota Transplantation in Steroid-Ineligible Severe Alcoholic Hepatitis: A Pilot Study. Clin Gastroenterol Hepatol 2017;15:600–2. doi:10.1016/j.cgh.2016.10.029.
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe