Tromboembolismul venos (TEV) – termen ce
cuprinde tromboza venoasă profundă şi embolia pulmonară – este una din cauzele
importante de mortalitate şi morbiditate la nivel global. Astfel, unul-doi
pacienţi din 1.000 suferă un episod de TEV în decursul unui an. Pacienţii
spitalizaţi au un risc crescut de a dezvolta tromboembolism venos, risc ce
variază între 10% la pacienţii din secţiile medicale, până la 40–60% la pacienţi
la care s-a efectuat înlocuire completă de genunchi.
Tromboembolismul venos ar trebui considerat mai mult o boală cronică decât una
acută, din cauza riscului crescut de recurenţă, aceasta ajungând la 18% la doi
ani, 25% la cinci ani şi 30% la opt ani. Recurenţa trombozei venoase profunde
se asociază cu dezvoltarea sindromului postrombotic, iar recurenţa tromboembolismului
pulmonar determină apariţia hipertensiunii pulmonare tromboembolice cronice.
Sindromul postrombotic, complicaţie pe termen lung a trombozei venoase profunde
(TVP), se caracterizează prin durere cronică, edem, tulburări trofice tegumentare,
ajungând până la ulcere venoase la nivelul membrului afectat. Apare în general în
unul-doi ani de la episodul iniţial (1).
Tromboprofilaxia are rolul de a preveni
recurenţa evenimentelor trombotice şi, astfel, de a reduce morbiditatea şi
mortalitatea acestor pacienţi.
Factorii de risc recunoscuţi pentru recurenţă
sunt reprezentaţi de imobilizare, neoplazie, boala pulmonară obstructivă cronică,
sexul masculin, obezitate, HDL-colesterol scăzut, istoricul familial de
tromboembolism, trombofilie (anticorpi anticardiolipinici, deficienţa de
proteină C sau S), tromboembolismul pulmonar simptomatic, nivelul crescut de D
dimeri după oprirea anticoagulării, lipsa recanalizării venei după
anticoagulare (4).
Este clar că pacienţii care primesc
anticoagulare sunt protejaţi împotriva recurenţei, fiind nevoie să fie tratate
nouă persoane pe toată durata vieţii pentru a preveni un eveniment
tromboembolic venos (1).
Baza terapiei tromboembolismului venos este
reprezentată de anticoagulante, respectiv heparină nefracţionată (descoperită în
1916), heparine cu greutate moleculară mică (dezvoltate în anii ’80) sau
fondaparinux pentru faza acută (în medie cinci zile), cu trecere ulterioară la
anticoagulare orală. Aceasta din urmă era, până de curând, apanajul solitar al
antagoniştilor de vitamină K (warfarină, acenocumarol).
Antagoniştii de vitamină K
Warfarina a fost descoperită încă din 1941.
Efectul antagoniştilor de vitamină K (AVK) se datorează blocării secvenţei de
gamma-carboxilare a factorilor de coagulare care depind de vitamina K
(factorii II, VII, IX, X). Deşi eficienţa AVK este dovedită în condiţii
„optime“, utilizarea lor în practica clinică aduce probleme multiple, aceste
condiţii „optime“ fiind greu de atins. Prima problemă e urmarea debutului lent
al efectului. De asemenea, prezintă un interval terapeutic extrem de îngust
(INR de obicei între 2 şi 3), care este dificil de menţinut din cauza faptului
că diferite alimente (mai ales vegetale) schimbă în mod semnificativ atât
farmacocinetica, cât şi farmacodinamica AVK. În plus, numeroase medicamente
precum inductorii şi inhibitorii izoenzimelor citocromului P450 (care
metabolizează antagoniştii de vitamină K) scad sau cresc într-un mod puţin
predictibil efectul anticoagulant al acestor medicamente. Acestora li se
asociază şi o variabilitate importantă interindividuală a răspunsului la
terapie (date fiind polimorfismele frecvente ale CYP2C9 şi VKORC1). Utilizarea
lor necesită monitorizare frecventă, obligatorie pe toată durata terapiei, din
cauza riscului crescut de sângerare în caz de supradozare şi, pe de altă parte,
a ineficienţei protecţiei în caz de anticoagulare ineficientă. Astfel, chiar şi
în trialurile controlate în care pacienţii sunt urmăriţi îndeaproape, INR optim
este obţinut doar la puţin peste jumătate din cazuri.
Dezvoltarea de noi terapii
Neajunsurile prezentate anterior au determinat
căutarea de noi agenţi, mai uşor de utilizat de către medic şi pacient şi care
să se apropie cât mai mult de ipoteticul „anticoagulant ideal“. În ciuda cunoştinţelor
acumulate în domeniul coagulării, complexitatea acestui proces a pus probleme
serioase în descoperirea şi dezvoltarea de noi anticoagulante care să fie atât
eficiente, cât şi sigure. Cercetarea s-a axat pe substanţe care să interfereze
cu un anumit factor sau o anumită etapă din procesul coagulării, de la
inhibitori ai complexului factor VII (factor tisular), inhibitori de factor IX şi
XI, inhibitori direcţi de trombină, inhibitori sintetici indirecţi şi direcţi
de factor X activat (Xa) şi trombomodulina recombinată.
Factorul Xa este o ţintă promiţătoare în
cercetările din ultima perioadă, deoarece este poziţionat la punctul de
convergenţă a căilor de coagulare (intrinsecă şi extrinsecă), având rolul de a
cataliza conversia protrombinei în trombină, o moleculă de factor Xa determinând
generarea a mai mult de 1.000 de molecule de trombină. În acelaşi timp, datorită
faptului că inhibarea factorului Xa nu interferează cu activitatea trombinei
preexistente, hemostaza eficientă poate fi mai puţin afectată, ceea ce se
traduce prin eficienţă şi risc scăzut de sângerare (1).
Inhibarea factorului IIa (trombina) a arătat,
de asemenea, rezultate promiţătoare, după cum vom detalia.
Iată cele mai importante noi anticoagulante
orale care încearcă să îşi găsească locul în practica clinică.
Rivaroxaban
Este un inhibitor direct de factor Xa, înalt
selectiv şi cu administrare orală. Studiile in
vitro au arătat că inhibă în mod competitiv factorul Xa, având o
selectivitate de peste 10.000 de ori mai mare pentru acesta decât pentru alţi
factori de coagulare. S-a dovedit că produce o creştere a permeabilităţii
trombului şi creşte susceptibilitatea acestuia la acţiunea de degradare a
activatorului tisular al plasminogenului. În modele animale, a inhibat formarea
trombului la doze care nu au crescut semnificativ timpul de sângerare.
Farmacologie. Rivaroxabanul are
farmacocinetica şi farmacodinamica favorabile, cu o biodisponibilitate mare
(80–100%) după o doză de 10 mg. Atinge concentraţia maximă la două-patru ore de
la administrare şi concentraţiile sale nu sunt influenţate de alimentaţie.
Inhibiţia maximă a factorului Xa apare la una-patru ore de la administrare, dar
activitatea factorului Xa nu revine complet la normal după 24 ore. Timpul de înjumătăţire
este de trei-nouă ore (6). Două treimi din doză suferă degradare la nivel
hepatic, iar din acestea jumătate se excretă urinar şi jumătate biliar. Restul
de o treime se elimină direct pe cale renală, ca substanţă activă nemodificată.
Metabolizarea hepatică se face de către citocromul P450, dar şi prin mecanisme
independente de acesta (6). Interacţiunile medicamentoase sunt reduse, dar nu
se recomandă asocierea cu antimicotice de tip azoli (ketoconazol, itraconazol)
sau cu inhibitori de protează HIV (ex. ritonavir), aceste două tipuri de
substanţe fiind inhibitori puternici atât ai citocromului P450, cât şi ai glicoproteinei
P, ambele implicate în metabolismul rivaroxabanului. Asocierea acestora
determină creşterea concentraţiilor plasmatice de rivaroxaban şi risc crescut
de sângerare. Alte medicamente care afectează doar una din cele două căi de
metabolizare nu implică astfel de riscuri.
P450, cât şi ai glicoproteinei
P, ambele implicate în metabolismul rivaroxabanului. Asocierea acestora
determină creşterea concentraţiilor plasmatice de rivaroxaban şi risc crescut
de sângerare. Alte medicamente care afectează doar una din cele două căi de
metabolizare nu implică astfel de riscuri.
Dovezi în
tromboembolismul venos. Rivaroxabanul este aprobat în peste 100 de ţări (inclusiv
în Uniunea Europeană) pentru prevenţia TEV la pacienţii adulţi care sunt supuşi
protezării de genunchi sau de şold, ca urmare a rezultatelor programului RECORD (REgulation of Coagulation in
ORthopedic surgery to prevent Deep venous thrombosis and pulmonary embolism), în
care, la peste 12.500 de pacienţi cu astfel de proceduri, a fost comparat cu enoxaparina
40 mg/zi sau 30 mg de două ori pe zi. Studiul de fază III Einstein-DVT (Oral direct factor Xa inhibitor rivaroxaban in
patients with acute symptomatic deep-vein thrombosis without symptomatic
pulmonary embolism) (12), ce a inclus pacienţi cu tromboză venoasă profundă, a
comparat tratamentul cu rivaroxaban (15 mg x 2/zi în primele trei săptămâni,
apoi 20 mg o dată pe zi) cu un regim terapeutic ce iniţial a constat din
enoxaparină sau fondaparinux urmat de terapie cu antagonişti de vitamină K timp
de trei, şase sau 12 luni. Recurenţa a apărut la 2,1% din pacienţii trataţi cu
rivaroxaban, faţă de 3% din cei cu tratament uzual, dovedind non-inferioritatea
rivaroxabanului, dar nereuşind să atingă pragul de superioritate (p = 0,076
pentru superioritate). Sângerările au fost similare în cele două grupuri (8,1% în
ambele). De asemenea, în ceea ce priveşte mortalitatea totală, rivaroxabanul a
fost aproape de a atinge superioritatea (p = 0,06). Studiul Einstein PE (Oral direct factor Xa inhibitor
rivaroxaban in patients with acute symptomatic pulmonary embolism with or
without symptomatic deep-vein thrombosis), care evaluează eficacitatea
rivaroxabanului la pacienţi cu tromboembolism pulmonar, a fost încheiat de curând.
În studiul Einstein Extension (Once-daily
oral direct factor Xa inhibitor rivaroxaban in the long-term prevention of
recurrent symptomatic venous thromboembolism in patients with symptomatic
deep-vein thrombosis or pulmonary embolism), dublu orb, randomizat, au fost
incluşi pacienţi care încheiaseră perioada de anticoagulare prescrisă de medic
pentru TEV (6–12 luni) şi la care s-a administrat în continuare rivaroxaban sau
placebo în medie timp de 190 de zile. Rivaroxabanul a redus cu 82% recurenţele
de TVV faţă de placebo, cu rate similare de sângerare. Acest studiu ce arată
siguranţă şi eficacitatea rivaroxabanului în prevenţia secundară ar putea
influenţa evoluţia ghidurilor în vigoare în sensul prelungirii duratei
anticoagulării după TEV. Studiul MAGELLAN
(Venous thromboembolic event prophylaxis in medically ill patients) a testat
utilitatea rivaroxabanului la pacienţi internaţi în secţii medicale (insuficienţă
cardiacă acută, accident vascular ischemic, cancer, insuficienţă respiratorie
acută, infecţii acute, boli inflamatorii), cărora, pentru prevenirea TEV, li
s-a administrat fie rivaroxaban 10 mg/zi, fie enoxaparină 40 mg, timp de 10 +/–
4 zile. Ulterior, pacienţii au primit fie rivaroxaban, fie placebo, până în
ziua 35 +/–4. La cei peste 5.900 de pacienţi ce au compus ambele grupuri s-au
diagnosticat rate similare de apariţie a TEV la zece zile, cu atingerea
superiorităţii la 35 de zile la cei care au continuat să ia rivaroxaban faţă de
placebo. Pe de altă parte, sângerările sub rivaroxaban au fost crescute faţă de
cele sub enoxaparină (2,8% faţă de 1,2% la zece zile şi, respectiv 4,1% faţă de
1,7% la 35 de zile – diferenţe semnificative statistic). Studiul nu a reuşit
deci să dovedească avantajul rivaroxabanului faţă de enoxaparină în prevenţia
TEV la pacienţi cu afecţiuni medicale internaţi în spital.
Dabigatran
Este un inhibitor direct de trombină, care,
spre deosebire de inhibitorii indirecţi (precum heparinele cu greutate
moleculară mică), are capacitatea de a inactiva trombina care este deja legată
de fibrină, aceasta având rol major în extensia trombului deja format. Din
această clasă, ximelagatranul a fost primul inhibitor oral direct de trombină
testat, inclusiv în studii de fază III. Deşi a demonstrat că previne evenimentele
tromboembolice venoase, a fost retras de pe piaţă din cauza hepatotoxicităţii.
Eficienţa sa a determinat însă cercetări ulterioare, ce au dus la dezvoltarea
dabigatranului etexilat.
Acesta din urmă este un prodrog al
dabigatranului, un inhibitor specific, reversibil, de trombină. Într-un model
de tromboză la şoarece, inhibă formarea trombului. De asemenea la şoareci,
timpul de sângerare nu a fost influenţat de dozele terapeutice.
Farmacologie. Este absorbit rapid şi
complet convertit la dabigatran, cu o biodisponibilitate orală de aproximativ
6%, concentraţia plasmatică maximă fiind atinsă la două ore de la
administrare. Are o durată de viaţă de 14–17 ore, independentă de doză. E
important de menţionat că, în metabolizarea sa, nu intervine semnificativ
citocromul P450. Eliminarea se face predominant renal, nemodificat (80% din
total) (7), fapt ce trebuie luat în considerare la pacienţii cu insuficienţă
renală. Nu are interacţiuni importante cu majoritatea medicamentelor,
singurele care nu ar trebui să fie coadministrate cu dabigatran fiind chinidina
şi amiodaronă, din cauza competiţiei pentru transportorul glicoproteinei P.
Dovezi în
tromboembolismul venos. Agenţia Europeană a Medicamentului a aprobat folosirea
dabigatranului în prevenirea evenimentelor tromboembolice venoase la pacienţii
supuşi intervenţiei chirurgicale pentru protezare totală a genunchiului sau de
protezare de şold, ca urmare a studiilor RE-NOVATE
(Dabigatran etexilate in extended venous thromboembolism prevention after hip
replacement surgery) şi RE-MODEL
(Dabigatran etexilate 150 mg or 220 mg once daily versus enoxaparin 40 mg o.d.
for prevention of thrombosis after knee surgery).
Doza de 150 mg x 2/zi a fost comparată în
trialul RE-COVER (Efficacy and safety
of dabigatran compared to warfarin for 6 month treatment of acute symptomatic
venous thromboembolism) cu warfarina pe durata a şase luni de la un eveniment
tromboembolic venos acut. Rata de recurenţă a fost similară în cele două
grupuri (2,4%, faţă de 2,1%, p < 0,001), la fel şi rata de sângerare (1,6%
pentru dabigatran, faţă de 1,9% pentru warfarină). Efectul advers cel mai
frecvent a fost dispepsia.
Recent, trialul RE-COVER II (cu 2.568 de pacienţi) a confirmat eficienţa
dabigatranului, decelând rate de recurenţă de 2,4%, respectiv 2,2% pentru
warfarină, cu un avantaj nesemnificativ statistic pentru dabigatran în ceea ce
priveşte sângerările majore (15 faţă de 22), dar cu un avantaj semnificativ în
ceea ce priveşte numărul total de sângerări (200 faţă de 289, risc relativ
0,67; 95% CI 0,56–0,81). În trialul RE-MEDY
(Secondary prevention of venous thromboembolism), la 1.856 de pacienţi ce iniţial
au fost trataţi timp de 3–12 luni de la TEV, s-a comparat terapia cu dabigatran
cu cea cu warfarină timp de 6–36 luni. Eficienţa a fost similară în prevenirea
recurenţelor comparativ cu warfarina (1,8% recurenţe la dabigatran, faţă de
1,3% la warfarină), cu reducerea numărului de sângerări (1,9% faţă de 2,6%),
dar cu o creştere uşoară a frecvenţei sindroamelor coronariene acute (SCA)
(0,9% faţă de 0,2%), fără creşterea mortalităţii de orice cauză. Creşterea
frecvenţei SCA a fost observată şi în trialul RE-LY (Randomized evaluation of long term anticoagulant therapy
with dabigatran etexilate), ce a testat dabigatranul în fibrilaţia atrială,
ceea ce sugerează că warfarina ar putea fi mai protectoare pentru SCA decât
dabigatranul.
Apixaban
Este un inhibitor reversibil direct de
factor Xa, cu afinitate înaltă, ce inhibă atât forma liberă de factor Xa, cât şi
protrombinaza şi factorul Xa din constituţia trombului.
Farmacologie. Absorbţia este
relativ rapidă, cu atingerea concentraţiei plasmatice maxime la trei ore de la
administrarea orală. Timpul de înjumătăţire este de 8–15 ore. Eliminarea se
face pe căi multiple (metabolizare oxidativă, eliminare renală şi intestinală):
70% din cantitate se elimină prin fecale, 30% prin urină, în majoritate ca
substanţă neschimbată (21). Se recomandă a se evita administrarea concomitentă
de ketoconazol sau alţi inhibitori potenţi de citocrom P450, din cauza
efectului de creştere a nivelului de apixaban. Inhibitorii moderaţi de P450
(diltiazem, inhibitori de receptori serotoninergici) trebuie utilizaţi cu
prudenţă. Nu se cunoaşte efectul administrării concomitente de statină.
Dovezi în
tromboembolismul venos. Apixabanul a fost testat ca tratament de prevenţie a TEV
la pacienţi supuşi protezării de şold sau genunchi, cu rezultate uşor
conflictuale. În trialul ADVANCE-1
(Study of apixaban for the prevention of thrombosis-related events following
knee replacement surgery) s-a comparat doza de 2,5 mg x 2/zi cu enoxaparina 30
mg x 2/zi, apixabanul neatingând ţinta de non-inferioritate (p = 0,06) (end-point alcătuit din tromboza venoasă
profundă, embolie pulmonară şi mortalitate generală). Ratele de sângerare majoră
au fost similare iar ratele de sângerare generale au fost mai reduse la
apixaban. În ADVANCE-2 (Study of an
investigational drug for the prevention of thrombosis-related events following
knee replacement surgery) s-a comparat aceeaşi doză de apixaban cu enoxaparina
40 mg/zi la cei cu protezare de genunchi, cu demonstrarea, de această dată, a
superiorităţii apixabanului în ceea ce priveşte acelaşi end-point primar (reducere absolută a riscului de 9,3%). Rata de sângerare
a fost similară în cele două grupuri.
ADVANCE-3
(Study of an investigational drug for the prevention of thrombosis-related
events following hip replacement surgery) a fost similar cu ADVANCE-2, dar s-a efectuat după
protezare de şold. El a arătat din nou superioritatea apixabanului faţă de
enoxaparină 40 mg/zi, fără a creşte numărul de sângerări.
Trebuie menţionat, de asemenea, studiul ADOPT (Study of apixaban for the
prevention of thrombosis-related events in patients with acute medical
illness), similar cu MAGELLAN în
cazul rivaroxabanului, ce a comparat utilitatea apixabanului la pacienţi
internaţi în secţii medicale (insuficienţă cardiacă acută, accident vascular
ischemic, cancer, insuficienţă respiratorie acută, infecţii acute, boli
inflamatorii), cărora, pentru prevenirea TEV, li s-a administrat fie apixaban
2,5 mg x 2/zi timp de 30 de zile, fie enoxaparină 40 mg timp de zece zile.
Apixabanul nu a reuşit să îşi dovedească superioritatea în ceea ce priveşte end-point-ul primar, rezultând o rată
similară a TEV în cele două grupuri. Sângerările au fost de 2,5 ori mai multe
la cei ce au luat apixaban (30 de zile) faţă de cei ce au primit enoxaparină
(10 zile), dar totuşi destul de puţine (0,47% faţă de 0,19%). Numărul de sângerări
este similar cu cel ce ar fi de aşteptat dacă profilaxia s-ar face cu aspirină.
Astfel, apixabanul poate să îşi găsească un rol în prevenţia prelungită a TVE
la pacienţii cu afecţiuni medicale.
Studiile AMPLIFY (Efficacy and safety study of apixaban for the treatment of
deep vein thrombosis or pulmonary embolism) şi AMPLIFY Extension (Efficacy and safety study of apixaban for
extended treatment of deep vein thrombosis or pulmonary embolism), legate de
terapia TEV, sunt momentan în desfăşurare.
Edoxaban
Este un inhibitor oral direct, specific, de
factor Xa (sensibilitate de 10.000 ori mai mare pentru Xa decât pentru trombină).
Eficacitatea sa a fost examinată iniţial pe modele animale, unde a produs o
inhibare dependentă de doză a formării trombului. Timpul de sângerare nu a fost
prelungit semnificativ, iar agregarea plachetară nu a fost afectată.
Farmacologie. Concentraţia maximă
plasmatică este atinsă la aproximativ 1,5 ore de la administrarea orală, cu
revenirea la normal a activităţii factorului Xa în decurs de 12 ore. Se pare
că edoxabanul prelungeşte timpul de tromboplastină parţială activată şi
timpul de protrombină în funcţie de doză. Timpul de înjumătăţire a fost între
5,8 şi 10,7 ore în studii. Majoritatea se elimină pe cale renală (36–45% din
doză), neschimbat. Nu există date privind interacţiunile cu alte medicamente.
Alimentaţia nu influenţează semnificativ farmacocinetica şi farmacodinamica
edoxabanului.
Dovezi în
tromboembolismul venos. Edoxabanul a arătat rezultate promiţătoare în studii de
fază II legate de prevenirea tromboembolismului venos la pacienţi care sunt
supuşi înlocuirii totale de şold sau de genunchi. Astfel, compararea
diferitelor doze cu dalteparina a arătat eficienţă superioară a edoxabanului,
cu dovedirea relaţiei doză-răspuns şi fără o incidenţă crescută a sângerărilor
la toate dozele folosite. Un studiu de fază IIb a comparat edoxabanul (15 sau
30 mg, o dată pe zi) cu enoxaparina (20 mg de două ori pe zi) la pacienţi supuşi
protezării de şold sau genunchi, arătând eficacitate similară între cele două
regimuri terapeutice, cu număr comparabil de sângerări (15).
Studiul HOKUSAI
(Comparative investigation of low molecular weight heparin/edoxaban tosylate
versus heparin/warfarin in the treatment of symptomatic deep-vein blood clots
and/or lung blood clots), momentan în fază de recrutare, compară edoxabanul 60
mg/zi (doză unică, precedat de heparină fracţionată sau nefracţionată), cu
warfarina (precedată de heparină fracţionată sau nefracţionată) în tratamentul
TEV. Trebuie menţionat că este cel mai mare studiu cu un nou anticoagulant oral
legat de terapia TEV (7.500 de pacienţi planificaţi).
Prezentăm, în tabelul 1, o comparaţie a caracteristicilor celor patru noi
anticoagulante orale prezentate. Mai există alte câteva anticoagulante orale în
dezvoltare, din care amintim TAK-442, betrixaban, darexaban, ce acţionează pe
factorul Xa, şi un inhibitor direct de trombină, AZD0837.
Discuţii
Anticoagulantul ideal. Ţinta cercetărilor în domeniul medicaţiei anticoagulante
este apropierea, pe cât posibil, de iluzoriul anticoagulant ideal. Prezentăm întabelul 2 felul cum noile
anticoagulante orale şi vechii antagonişti de vitamină K se încadrează în
profilul ideal. Tratamentul TEV se face, în marea majoritate a timpului (cu
excepţia fazei acute), la domiciliu, motiv care creşte necesitatea unei terapii
cu profil bun de siguranţă, dar, în acelaşi timp, eficientă, o terapie unică şi
– de preferat – cu administrare facilă (o doză/zi).
Ce avantaje au noile anticoagulante? Marele avantaj este
faptul că farmacocinetica şi farmacodinamica sunt predictibile. Interacţiunea
cu alimentaţia reprezintă una din problemele majore ale AVK, în timp ce noile
anticoagulante orale nu sunt influenţate semnificativ de aceasta. De asemenea,
interacţiunile medicamentoase sunt reduse, existând puţine terapii ce trebuie
evitate în timpul anticoagulării cu aceste produse. Nu este astfel necesară
modificarea dozelor. Poate părea greu de acceptat că o doză poate fi bună
pentru toţi într-un domeniu în care variabilitatea răspunsului la terapie era până
acum regula. Totuşi, nu trebuie uitat faptul că există deja unele terapii cu
profil similar, cu doză unică pe întreg spectrul de pacienţi şi care şi-au
dovedit eficienţa (fondaparinux). Astfel, unul din beneficiile noilor
anticoagulante este simplitatea terapiei, aspect amplificat şi de rezultatele
programelor EINSTEIN (rivaroxaban) şiAMPLIFY (apixaban), în care pe toată
durata terapiei TEV (faza acută şi cronică) s-a utilizat un singur preparat, cu
administrare orală, fără a mai fi necesară utilizarea iniţială de preparate
parenterale şi trecerea apoi la cele orale, rezultatele fiind promiţătoare şi
ducându-ne cu gândul la reducerea astfel a perioadei de spitalizare. Trebuie
menţionat că, în prima perioadă de terapie (trei săptămâni în programul EINSTEIN şi şapte zile în AMPLIFY), dozele de anticoagulant sunt
crescute (15 mg rivaroxaban x 2/zi şi, respectiv, 10 mg x 2/zi la apixaban).
Programele ce au analizat dabigatranul şi edoxabanul au folosit terapie iniţială
de minimum cinci zile cu o heparină. Studiile prezentate au arătat
non-inferioritatea şi chiar superioritatea câtorva regimuri terapeutice cu
noile anticoagulante orale în relaţie cu terapia uzuală.
Probleme legate de noile anticoagulante. Este evident faptul că noile anticoagulante orale sunt
mai scumpe, totuşi terapia cu acestea poate fi cost-eficientă datorită lipsei
necesităţii de monitorizare constantă a INR şi prin reducerea complicaţiilor
hemoragice. Noile anticoagulante nu sunt, totuşi, ideale. Astfel, lipseşte la
acest moment un antidot specific care să antagonizeze rapid efectul acestora,
la nevoie. Totuşi, timpul de înjumătăţire al acestor medicamente este destul de
redus comparativ cu warfarina, lucru ce face ca efectul lor să dispară relativ
repede la încetarea tratamentului. Se doreşte, de asemenea, găsirea de markeri
ai efectului acestora, care să permită monitorizarea la nevoie a nivelului de
anticoagulare. Trebuie menţionat şi faptul că aceste anticoagulante au fost
testate şi în cazul fibrilaţiei atriale, iar unele şi în sindroame coronariene
acute. Trialurile legate de fibrilaţia atrială, deşi nu sunt subiectul
articolului de faţă, trebuie subliniate deoarece au inclus un număr foarte mare
de pacienţi (de ordinul zecilor de mii) şi ele demonstrează riscul scăzut de sângerare
în decursul terapiei cu noile anticoagulante. Astfel, în trialul RE-LY, dabigatranul în doză de 150 mg x
2/zi a redus sângerările intracraniene cu 74%, fiind în acelaşi timp superior
warfarinei, iar doza de 110 mg x 2/zi a redus numărul total de sângerări majore
cu 20%, fiind la fel de eficient ca warfarina. De asemenea, rivaroxabanul a arătat
în studiul ROCKET-AF( fibrilaţie
atrială) un profil de siguranţă excelent şi non-inferioritate faţă de warfarină,
superioritatea fiind discutabilă. Apixabanul a dovedit în trialul ARISTOTLE (fibrilaţie atrială)
superioritate faţă de warfarină atât în ceea ce priveşte evenimentele embolice,
cât şi în ceea ce priveşte sângerările majore, mai ales hemoragiile cerebrale.
Nu a existat nici o dovadă de hepatotoxicitate a noilor anticoagulante (spre
deosebire de vechiul ximelagatran).
Cine sunt
pacienţii care ar beneficia cel mai mult de pe urma noilor anticoagulante? În cazul pacienţilor
cu control bun al INR, probabil că beneficiul utilizării acestor noi
anticoagulante ar fi redus, cu excepţia cazului în care pacientul doreşte simplificarea
terapiei. Totuşi, reducerea riscului de sângerare (observat mai ales cu
dabigatran şi apixaban) poate fi important în schimbarea terapiei (3). De
asemenea, abordarea cu un singur medicament pe parcursul terapiei TEV
(rivaroxaban, apixaban) poate influenţa adoptarea noilor anticoagulante în
această patologie, la fel şi dovezile de eficienţă cu risc mic de sângerare
atunci când terapia se prelungeşte peste durata specificată de ghiduri.
Atât dabigatranul, cât şi rivaroxabanul au
arătat eficienţă foarte bună în profilaxia TEV la pacienţii ortopedici
(rivaroxabanul fiind chiar superior warfarinei) şi în terapia TEV. Apixabanul
are studii legate de prevenţie la pacienţi internaţi în secţiile medicale şi
studii de terapie a TEV în desfăşurare, iar edoxabanul pare promiţător în din
studiile de fază II, cele de fază III fiind, de asemenea, în desfăşurare.
Dabigatranul porneşte cu avantajul primului venit, cu studii multiple încheiate,
ce au dovedit siguranţa terapiei şi reducerea semnificativă a sângerărilor (cu
reducere semnificativă a celor intracraniene în trialurile din fibrilaţia
atrială şi cu reducere a riscului global de sângerare în trialurile din TEV)
(3). E de menţionat că dabigatranul a dovedit în tratamentul fibrilaţiei
atriale (studiul RE-LY) superioritate
faţă de warfarină, rivaroxabanul nereuşind să dovedească clar decât
non-inferioritate în această indicaţie în trialul ROCKET-HF.
Dispepsia produsă de dabigatran prin pH-ul
acid al acestui preparat pare să fie un „călcâi al lui Ahile“, o proporţie
semnificativă de pacienţi (până la 20%) întrerupând terapia din cauza efectelor
adverse. De asemenea, se pune problema numărului uşor crescut de infarcte la
pacienţi trataţi cu dabigatran faţă de cei trataţi cu warfarină (creştere
nesemnificativă statistic – un caz la 1.000 de pacienţi trataţi). Per total însă,
în RE-LY, cel mai extins trial cu
dabigatran, în ciuda acestei observaţii, mortalitatea globală şi cea de cauză
vasculară au fost, în fapt, reduse. Pe de altă parte, în cazul celorlalte noi
anticoagulante nu s-au făcut observaţii similare, rivaroxabanul reducând numărul
de infarcte în ROCKET-AF (nesemnificativ
statistic – cu 9%). Astfel, ar putea exista o reticenţă a utilizării dabigatranului
la pacienţii coronarieni. Avantajul dozei unice poate fi important pentru
rivaroxaban, acesta putând determina o complianţă superioară a pacientului.
Factorii care trebuie luaţi în considerare în
alegerea anticoagulantului sunt reprezentaţi de riscul individual de sângerare,
de comorbidităti, de complianţă.
Concluzii
Trecerea de la utilizarea unui medicament
vechi de peste 70 de ani, extrem de bine cunoscut atât în ceea ce priveşte părţile
bune, cât şi cele rele, la o terapie nouă, extrem de promiţătoare, dar cu
efecte încă parţial cunoscute, se dovedeşte a fi destul de dificilă dar
inevitabilă.
Majoritatea dintre noi ne-am dorit de mult
un înlocuitor pentru AVK, pe care le-am considerat nu de puţine ori o povară.
Ca medici, mulţi suntem reticenţi în a prescrie o terapie nouă pacienţilor noştri
până când nu există o perioadă suficientă de utilizare a acesteia şi poate pe
bună dreptate. Sau poate, în subconştientul nostru, ne simţim totuşi bine ca
jongleri cu dozele de terapie anticoagulantă.
Ca întotdeauna,
timpul va fi cel care va aduce dovezi în ceea ce priveşte utilitatea şi siguranţa
noilor terapii, iar cercetarea continuă este indispensabilă pentru
identificarea tipului de pacient care ar beneficia de pe urma lor şi a
avantajelor şi dezavantajelor fiecăruia din aceste noi medicamente. 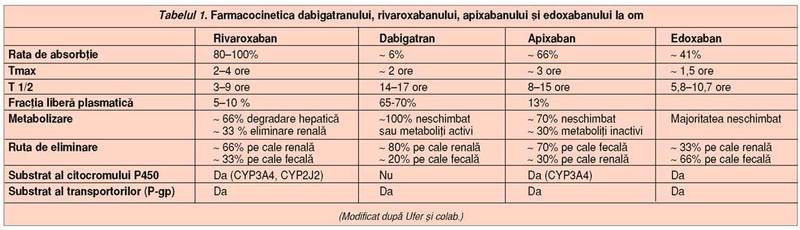
 P450, cât şi ai glicoproteinei
P, ambele implicate în metabolismul rivaroxabanului. Asocierea acestora
determină creşterea concentraţiilor plasmatice de rivaroxaban şi risc crescut
de sângerare. Alte medicamente care afectează doar una din cele două căi de
metabolizare nu implică astfel de riscuri.
P450, cât şi ai glicoproteinei
P, ambele implicate în metabolismul rivaroxabanului. Asocierea acestora
determină creşterea concentraţiilor plasmatice de rivaroxaban şi risc crescut
de sângerare. Alte medicamente care afectează doar una din cele două căi de
metabolizare nu implică astfel de riscuri.