Statusul legislativ şi clarificări în ceea ce priveşte dosarul de depunere a documentației pentru studiile clinice, precum şi durata de aprobarea a acestora în România, în 2022, au fost subiectele abordate în cadrul mesei rotunde organizate la începutul lunii mai de Avantyo Institute of Clinical Research.
20 mai: Ziua Internațională a Studiilor Clinice
Ne-am dorit o discuţie la obiect împreună cu reprezentanţii autorităţilor competente şi ai industriei farma, CRO-uri, asociaţii de pacienţi, medici de diferite specialităţi interesaţi de sau participanţi în studii clinice, în lumina tranziţiei de la vechea Directivă Europeană 2001/20/CE la Noul Regulament European CTR 536/2014. Am avut plăcerea să moderez această discuţie împreună cu invitaţii noştri, farm. dr. Răzvan Prisada, preşedintele ANMDMR, prof. dr. Doina Drăgănescu, decanul Facultăţii de Farmacie din cadrul UMF „Carol Davila” şi reprezentantul Comisiei Naţionale de Bioetică, prof. dr. Adrian Streinu-Cercel, preşedintele Comisiei de Sănătate din Senatul României, conf. dr. Michael Schenker, preşedintele Comisiei de Oncologie din Ministerul Sănatăţii, şi dr. Cătălina Sârbu, preşedinte al ACCSCR.
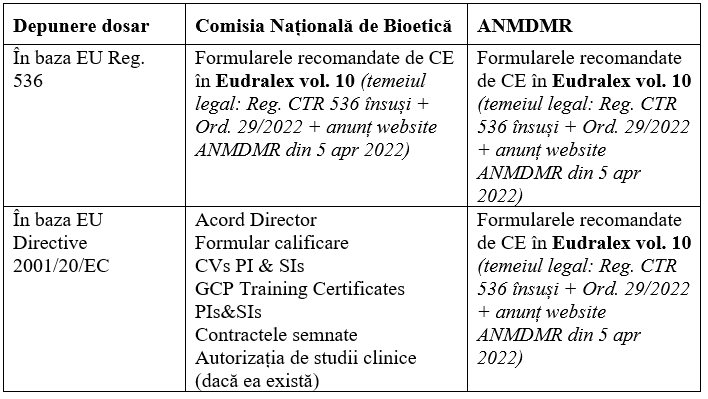
Baza discuţiei noastre a fost, pe de o parte, OUG 29/23 martie 2022 privind stabilirea cadrului instituţional şi măsurile necesare pentru aplicarea prevederilor Regulamentului European 536/2014 şi Legea privind aprobarea Ordonanţei Guvernului nr. 17/2021 pentru modificarea şi completarea Legii 134/2019 privind reorganizarea ANMDMR şi aprobarea tacită, aprobată în 14 martie 2022 în plenul Parlamentului, dar retrimisă către acesta spre revizuire în 12 aprilie de către Preşedinţie. Pe de altă parte, avem depunerile dosarelor de studii clinice făcute de reprezentanţii industriei fie după vechea Directivă 2001/20/CE, fie după noul Regulament.

Dilema analizată a ținut de modul în care trebuie să depunem documentele de aprobare a studiilor clinice în prezent – după modelul vechi (care încă mai este în vigoare și ca rămâne până în 2025) sau după modelul nou. Ce acte, autorizaţii şi alte documente trebuie să folosească investigator/sponsor/CRO? Intervenţia invitaţilor a adus clarificări foarte importante pentru cunoscători, şi anume:
Foarte important de reţinut este că nu există depunere mixtă (nu este permis ca unele ţări să depună în sistem CTIS, iar în alte ţări să existe depunere locală pentru acelaşi studiu).
Ne-au bucurat şi încurajat foarte mult deschiderea preşedintelui Răzvan Prisada de a rezolva blocajele existente la nivelul ANMDMR – privind și personalul dedicat evaluării dosarelor de studii clinice –, deschiderea agenţiei, cât şi a reprezentanţilor Comisiei de Bioetică de a discuta împreună cu reprezentanţii industriei farma documentele la care ambele instituţii lucrează în acest moment, atunci când vor ajunge la un draft comun, în aşa fel încât specialiştii din industria farma să poată aduce exemple practice în discuţie. În felul acesta, se poate ajunge în final la emiterea unor ordine de ministru care să ajute şi să simplifice lucrurile privind transpunerea în legislaţia naţională a cerinţelor europene.
Este nevoie de o simplificare a procedurii de depunere a dosarelor de studii clinice, simplificare care acum există în CTR 536/2014, care este acelaşi pentru toate statele membre europene și trebuie doar urmat ad literam. Deja şi în România există două studii clinice care au fost depuse în noul sistem, iar lucrurile au funcţionat foarte bine.
Avem speranţe de a vedea o apropiere şi mai mare, precum şi lucrul în echipă, cel mai important până la urmă, în ceea ce priveşte comunicarea la nivelul autorităţilor a acestor schimbări, în timp real şi într-o formă cât mai explicită (fie pe website-ul acestor instituţii, fie prin comunicate oficiale utile şi transparente).
Numai timpul ne va dovedi că aceste promisiuni vor deveni o realitate. Domeniul studiilor clinice rămâne foarte important, fiind uneori unica şansă la viaţă pentru mulţi pacienţi aflaţi în stadii avansate de boală şi care nu au acces la altă medicaţie inovativă în afara celei disponibile prin studiile clinice.
La 20 mai 2022 celebrăm Ziua Internaţională a Studiilor Clinice, o zi foarte importantă pentru cercetarea medicală şi pacienţii noştri, pe care nu avem voie să o trecem cu vederea. Astfel că vom urmări îndeaproape toate aceste modificări legislative, precum şi schimbarea în bine, promisă de autorităţi.
Citește mai mule din categoria Studii Clinice
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe