Creierul
este în mod particular vulnerabil la scăderea fluxului sanguin (reacţionând
prin ischemie), ca urmare a consumului relativ crescut de oxigen (3,5 ml/100 g ţesut/min).
Debitul cerebral satisface 15–20% din nevoile bazale totale ale organismului,
iar energia necesară activităţii neuronale depinde aproape în totalitate de
metabolismul aerob al glucozei (peste 90%).
Dacă
oxigenarea arterială, debitul cardiac şi substratul metabolic scad sub nevoile
fiziologice mai mult de patru-cinci minute, afectarea celulei nervoase este
considerată ireversibilă, cu toate că, experimental, aceasta supravieţuieşte
chiar 30–60 de minute în condiţii de hipoxie.
Reducerea
fluxului sanguin cerebral sub valoarea normală de 50 ml/100 g/min determină
modificări biochimice şi electrice în trepte, după cum urmează:
•
la 30-40 ml/100 g/min, undele înregistrate pe electroencefalogramă (EEG)
încetinesc ca frecvenţă;
•
la 20 ml/100 g/min, traseul EEG arată lipsa activităţii electrice spontane, iar
producţia cerebrală de lactat creşte (peste rata metabolică neuronală normală
de 2,3 mg/100 g de ţesut);
•
scăderea sub 15 ml sânge/100 g ţesut/min duce la dispariţia potenţialelor
evocate auditive şi somato-senzoriale; pH-ul scade şi apare metabolismul
anaerob. Încep modificările ionice transmembranare cauzate de acidoză. Această
valoare prag caracterizează aşa-numita „perfuzie marginală“. Ţesutul cerebral
tributar unui asemenea tip de flux, situat în jurul leziunii acute, poartă
numele de „penumbră ischemică“. Neuronii din aceste zone rămân însă fiziologic
complet viabili dacă fluxul sanguin normal se restabileşte rapid;
•
la valori minime, de sub 10 ml sânge/100 g ţesut/min, apare acumulare de apă
intracelulară cu leziuni neuronale definitive.
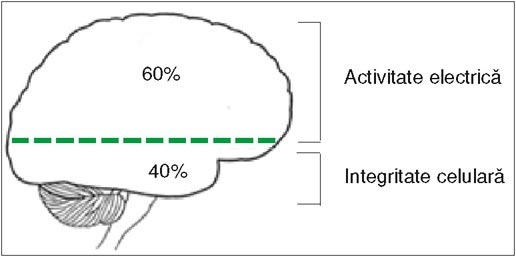
Creierul alocă
doar 40% din energia provenită din metabolism pentru integritatea celulară,
restul de 60% revenindu-i activităţii electrice. Acest tip de distribuţie a
resurselor, „de siguranţă“, limitează pierderile ireversibile de neuroni şi
influenţează decisiv prognosticul neurologic la distanţă.
Ischemia cerebrală instalată ca urmare a
deprivării de flux poate afecta creierul în totalitate (globală) sau numai
anumite teritorii (focală sau regională).
Cauzelecomune de ischemie globală sunt: stopul cardiac; stop circulator asistat
(din chirurgia cardiacă); creşterea brutală a presiunii intracraniene însoţită
de hipotensiune arterială; insuficienţa respiratorie severă. Se citează drept
cauze rare înecul şi hipoxemia accidentală, intraanestezică. Ischemia globală
este urmarea în principal a afectării cerebro-vasculare prin ateroscleroză, dar
şi evenimentelor embolice, hemoragice şi traumatice, incluzând actul
neuro-chirurgical „per se“. La acestea se adaugă proliferarea tumorală însoţită
de obstrucţia completă sau incompletă a lumenului vascular prin ţesut de
neoformaţie.
Efectele fiziologice imediate la nivel cerebral ale fluxului
sanguin inadecvat sunt cauzate în principal de scăderiea rapidă a rezervelor de
energie, cu acumularea serică de deşeuri metabolice (acid lactic, oxid nitric şi
radicali liberi proveniţi din reperfuzie). Se ştie că creierul şi cordul nu pot
funcţiona în regim de „datorie de oxigen“ (similar musculaturii striate).
Glicoliza anaerobă devine astfel furnizorul esenţial de resurse metabolice.
Acidoza se agravează proporţional cu oferta scăzută de glucoză şi în legătură
directă cu ischemia completă a unui anumit teritoriu. Sinteza proteică scade,
iar proteoliza accentuată duce la acumularea de neurotransmiţători, nepreluaţi
postsinaptic, mai ales de tip excitator (glutamat şi aspartat), dar şi
inhibitorul acid gama aminobutiric. Pompele transmembranare, ATP-dependente, de
transport ionic, sunt profund perturbate. Se pierde potasiu şi creşte dramatic
conţinutul intracelular de calciu şi sodiu. Excitabilitatea neuronală se
modifică rapid, receptorii de suprafaţă cuplaţi cu proteina G iniţiază
degradarea acidului arahidonic. Produşii finali ai acestei căi, prostaglandinele,
leucotrienele şi tromboxanii, constituie triggerii clasici ai inflamaţiei.
Nivelul
crescut al calciului intracelular comandă activarea proteazelor şi lipazelor
specifice, cu acţiune membranară. Sub efectul acestora va începe apoptoza celulară
şi se va constitui leziunea structurală
neuronală (brain damage).
Principii terapeutice. Prezervarea fluxului
sanguin cerebral a devenit o dogmă în neuroresuscitare deoarece determină esenţial
atât prognosticul precoce, cât şi pe cel tardiv. S-a dovedit clinic că
hipoxia în condiţii de normovolemie e
mai bine tolerată decât hipotensiunea arterială datorită posibilităţii eliminării
continue a produşilor de metabolism, în pofida „lipsei relative“ de oxigen.
Vasodilataţia cerebrală este cauzată în principal de hipercapnie. Dacă însă se
asociază o leziune morfologică semnificativă, creşterea CO2
accentuează „furtul vascular“ dinspre zonele afectate (deja maximal dilatate) către
teritoriile indemne. Hipocapnia are efect contrar, ducând la vasoconstricţie
generalizată cu creşterea fluxului sanguin provenind din ariile sănătoase către
teritoriile ischemice (fenomenul de „furt invers“). Astfel, intraanestezic,
hipotensiunea indusă de opioide îşi poate combina pasager efectul cu
hiperventilaţia, ducând la vasoconstricţie globală, urmată de ischemie tisulară gravă.
Reologic,
scăderea vâscozităţii sângelui (cu menţinerea unui hematocrit de 30-34%) poate
îmbunătăţi fluxul cerebral fără a afecta eliberarea oxigenului către ţesutul
nervos.
Menţinerea
biochimică a homeostaziei neuronale se alătură factorilor prin care se poate
influenţa terapeutic evoluţia pacienţilor cu brain damage.
Menţinerea
euglicemiei devine esenţială în acest context deoarece variaţiile brutale ale
nivelului seric al glucozei s-au dovedit a fi implicate în patogeneza edemului
cerebral. Hipoglicemia severă are aproape aceleaşi consecinţe funcţionale
defavorabile ca şi hipoxia, privând creierul de substrat. Hiperglicemia
(noncetozică, hiperosmolară) duce la accentuarea acidozei instalate prin
hipoperfuzie şi agravează indirect leziunea neuronală. Efectul său pe ischemia
cerebrală focală e mai puţin clar.
Dintre
diselectrolitemii, variaţiile sodiului plasmatic influenţează cel mai mult
integritatea celulei nervoase. Hipernatremia, frecventă în patologia cerebrală,
este un indicator adiţional al prognosticului nefast. Corecţia rapidă a
hiponatremiei duce la demielinizare osmotică însoţită uneori de mielinoză
centrală pontină sau de afectare extensivă a substanţei albe cerebrale.
patologia cerebrală,
este un indicator adiţional al prognosticului nefast. Corecţia rapidă a
hiponatremiei duce la demielinizare osmotică însoţită uneori de mielinoză
centrală pontină sau de afectare extensivă a substanţei albe cerebrale.
Pentru
a limita pierderea neuronală, terapeutica actuală nu dispune de mijloace de acţiune
la nivel celular. Măsurile de suport ale funcţiilor vitale se combină cu
liniile clasice de intervenţie asupra edemului şi a oxigenării tisulare
cerebrale. Se ameliorează astfel obstrucţia întoarcerii venoase (prin poziţia
capului la 30° faţă de orizontală, sedare) şi disfuncţia respiratorie (de
preferat neinvaziv, dar şi prin ventilaţie mecanică la momentul indicat de
protocoale). Acestora li se adaugă combaterea farmacologică a hiperpirexiei (de
cauză centrală), a hipertensiunii arteriale şi a activităţii convulsivante.
Anemia
şi diselectrolitemiile impun corecţia promptă, în terapie intensivă, pentru a
preveni apariţia leziunii ischemice secundare.
 patologia cerebrală,
este un indicator adiţional al prognosticului nefast. Corecţia rapidă a
hiponatremiei duce la demielinizare osmotică însoţită uneori de mielinoză
centrală pontină sau de afectare extensivă a substanţei albe cerebrale.
patologia cerebrală,
este un indicator adiţional al prognosticului nefast. Corecţia rapidă a
hiponatremiei duce la demielinizare osmotică însoţită uneori de mielinoză
centrală pontină sau de afectare extensivă a substanţei albe cerebrale.