Compoziţia microbiomului pulmonar este determinată de cel puţin trei factori: imigraţia microbiană, eliminarea microbiană și condiţiile de creștere regională.
Tractul respirator reprezintă un singur ecosistem, ce se întinde de la nări și până la alveole, cuprinzând o populaţie microbiană cu topografie continuă, dar care variază permanent. Plămânii și căile aeriene sunt heterogene din punct de vedere al temperaturii, presiunii de oxigen, pH-ului, densităţii nutritive, anatomiei locale și a sistemelor de apărare, toate acestea afectând condiţiile de creștere a microbiotei locale, creând variate comunităţi bacteriene între diferitele regiuni ale aceluiași plămân (compartimentalizare, micronișe, „insule”).
S-a raportat în ultima decadă că microbiota pulmonară este dependentă de modificările florei intestinale, de sex și poate fi modificată prin inflamaţie, utilizarea antibioticelor, corticoizilor, probioticelor etc. (Figura 1).

În ultima decadă s-a infirmat mitul conform căruia la indivizii sănătoși plămânii ar fi sterili. Aberaţia constă în faptul că plămânii erau consideraţi sterili, în pofida: continuităţii cu căile respiratorii superioare, proximităţii cu tractul digestiv, expunerii (inhalatorii) permanente la flora bacteriană din mediul ambiant. La acestea se mai adaugă faptul că toţi indivizii suferă de un grad de microaspiraţie în timpul somnului. Pe de altă parte, noile tehnici moleculare de identificare bacteriană, independent de izolarea prin culturi, au arătat că plămânii, chiar în absenţa infecţiei, conţin comunităţi microbiene diverse și dinamice.
Se știe că mai mulţi factori influenţează compoziţia microbiotei intestinale și/sau pulmonare, cum ar fi dieta, medicamentele și probioticele. Administrarea probioticelor conduce la o expansiune a numărului celulelor T, care vor atenua inflamaţia căilor aeriene și reduce hiperreactivitatea bronșică. Fumatul, la rândul său, ar downregla anumiţi germeni comensali din intestin, care vor avea ca și consecinţă amplificarea răspunsului imun în plămâni, și nu numai.
Conţinutul de fibre fermentabile din dietă ar schimba compoziţia microbiotei intestinale, cât și a microbiotei pulmonare, în special prin modificarea raportului dintre Firmicutes și Bacteroidetes. Microbiota intestinală ar metaboliza fibra, crescând astfel concentraţia acizilor grași cu lanţ scurt circulanţi. Creșterea nivelurilor circulante ale acizilor grași cu lanţ scurt acţionează la nivelul hematopoiezei măduvei osoase, stimulând generarea precursorilor de macrofage și cellule dendritice, cu popularea ulterioară a plămânilor cu un fenotip de celule dendritice cu capacitate fagocitară mare, dar care exercită o acţiune inhibitorie faţă de celulele efectoare Th2 din plămâni. În felul acesta, fibrele fermentabile dietetice și acizii grași cu lanţ scurt pot modela mediul imunologic din plămâni și pot influenţa severitatea inflamaţiei alergice.
Așadar, modularea microbiotei intestinale s-ar repercuta nu numai asupra tubului digestiv, ci ar influenţa și alte teritorii: pulmonar, ţesutul adipos, cardiovascular. Terapiile personalizate trebuie să includă și analiza stării microbiotei pulmonare, alături de datele genetice, profilul biomarkerilor, informaţii imunologice, fenotipul clinic (cum ar fi rapiditatea progresiei bolii), existenţa microaspiraţiei datorită insuficienţei gastroesofagiene etc. Dificultatea în selectarea terapiilor personalizate constă tocmai în numărul mare de modalităţi de grupare a pacienţilor.
Fumatul, poluarea aerică, predispoziţia genetică, status nutriţional precar și infecţiile (dezechilibrul microbiotei pulmonare) sunt principalii factori etiologici implicaţi în patogenia BPOC (Berensohn). Microbiota pulmonară poate contribui la patogeneza BPOC prin modularea procesului inflamator și/sau imunitar. Fenomenele de autoimunitate perpetuează răspunsul imun la autoantigenele rezultate din injuria inflamatorie și stresul oxidativ.
Există o relaţie directă între încărcătura bacteriană și prezenţa markerilor inflamatori din spută. Astfel, neutrofilele, CXCL8, leukotriena B4, mieloperoxidaza, matrix metaloproteinaza, TNF-a, IL-1b, IL-6, IL-12, elastaza neutrofilică sunt prezente în sputa bolnavilor colonizaţi. Încărcătura bacteriană în cadrul colonizării/infecţiei este un fenomen dinamic. Gradul de încărcare bacteriană se corelează cu: frecvenţa exacerbărilor, alterarea calităţii vieţii, precum și cu inflamaţia sistemică.
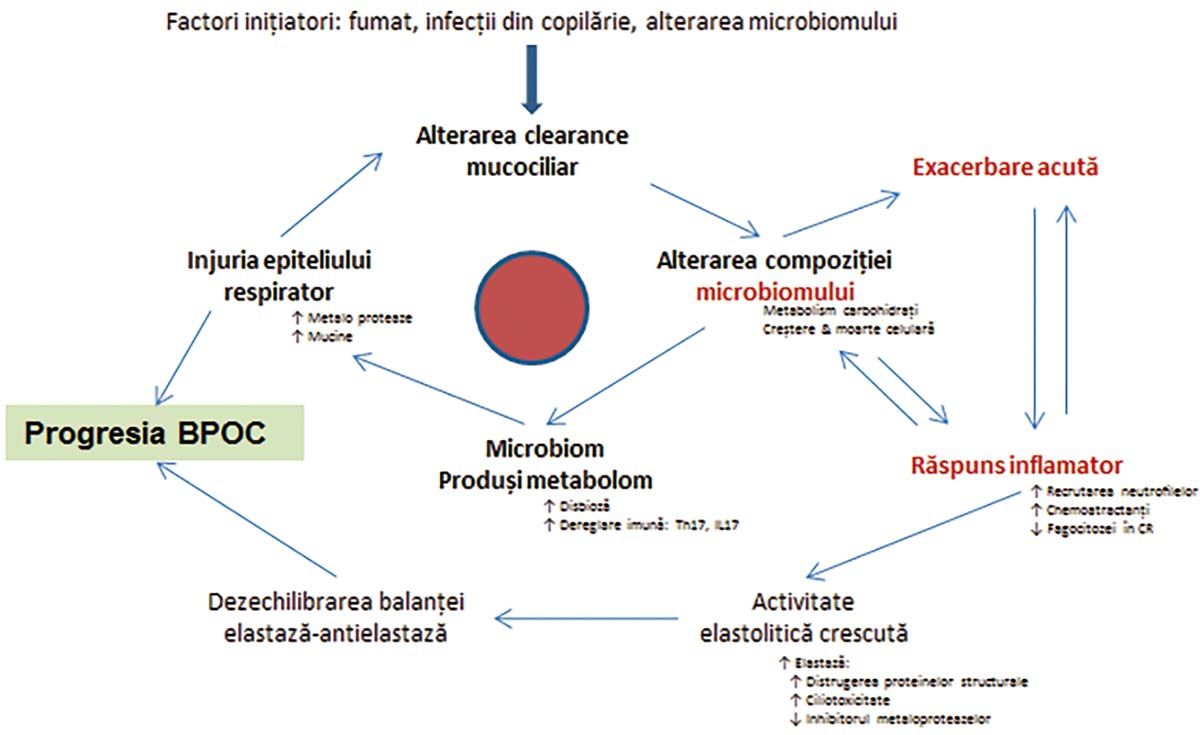
Din aceste motive, s-a propus ciclul disbioză-inflamaţie a microbiomului. Un factor declanșator inflamator (de exemplu, infecţie virală, expunere alergică, inhalare toxică, poluare a aerului) ar iniţia inflamaţia căilor respiratorii, care ar modifica micromediul căilor respiratorii. Alterarea acestor condiţii de creștere s-ar reflecta în dezorganizarea microbiomului pulmonar, care provoacă o inflamaţie suplimentară a căilor respiratorii (Figura 2). Un microbiom disbiotic va asocia o inflamaţie crescută.
A nu se uita relaţia dintre apariţia simptomelor de exacerbare și achiziţia de noi tulpini bacteriene. Există peste 1.200 de specii de bacterii evidenţiate în timpul exacerbărilor, iar comunităţile bacteriene se modifică în decursul unei exacerbări. Totuși, relaţia colonizare-infecţie este însă destul de ambiguă.
Indivizii cu BPOC, indiferent de severitate, au o microbiotă diferită de cei ce nu au BPOC, iar modificarea populaţiilor bacteriene se produce foarte devreme în procesul bolii. Mai trebuie știut că bronhiile și alveolele pacienţilor cu BPOC conţin microbiote distincte; același lucru și între bronhiile distale și cele proximale. Totuși, ar exista un „nucleu” (alcătuit din specii de Pseudomonas, Streptococcus, Prevotella, Fusobacterii, Haemophilus, Veillonella) în cadrul microbiotei, care ar fi comun, dar a căror abundenţă ar diferi între subiecţii sănătoși și cei cu BPOC stabil.
În faza stabilă a bolii există o reprezentare crescută a bacteriilor aparţinând încrengăturii (philum) Proteobacteria, Bacteroidetes, Actinobacteria și Firmicutes, având ca reprezentanţii cei mai comuni la nivel de gen Pseudomonas, Streptococcus, Prevotella și Haemophilus. Bolnavii la care în comunităţile bacteriene domină Firmicutes faţă de Proteobacteria s-ar asocia cu o creștere a diversităţii. O suprareprezentare a Protobacteriilor conduce la o pierdere a diversităţii microbiotei (disbioză), asociate cu creșterea severităţii bolii și a ratei exacerbărilor. Scăderea diversităţii microbiene se asociază cu distrugerea de tip emfizematos, remodelarea epiteliilor bronșiolar și alveolar și cu infiltrarea ţesutului pulmonar cu celulele T CD41.
Nu numai că microbiomul se schimbă în timpul exacerbărilor, dar ar exista diferenţe între cele două fenotipuri de exacerbare (bacteriene și eozinofile). În „fenotipul bacterian”, Proteobacteria a fost crescută, în timp ce în „fenotipul eozinofilic”, se observă creșterea Firmicutes. Se presupune că diferenţele în compoziţia microbiotei iniţiale ar explica și frecvenţa diferită a exacerbărilor la pacienţii cu BPOC. Între microbiom și BPOC există, însă, o interrelaţie reciprocă: la rândul lui, microbiomul respirator la pacienţii cu BPOC clinic stabil variază semnificativ în funcţie de severitatea limitării fluxului de aer, istoricul anterior de exacerbări și nivelurile de eozinofile circulante.
Complexitatea și dinamica microbiotei l-au făcut pe Dickinson să afirme pe drept că „if the microbiome is an organ, acute infection is its decompensated state” (dacă microbiomul este un organ, infecţia acută este starea lui decompensată).
Imigrarea bacteriilor din spaţiul supraglotic în plămâni va declanșa un răspuns inflamator. În cadrul acestui răspuns se edifică și foliculii limfoizi din pereţii căilor aeriene mici, observaţi la pacienţii cu BPOC sever-foarte sever.
Microbiota pulmonară modifică imunitatea mucoasei bronșice și contribuie la toleranţa imună, prin recrutarea neutrofilelor, producerea de citokine pro-inflamatorii mediate de receptorul 2 (TLR2) și eliberarea de peptide antimicrobiene, cum ar fi b-defensina 2 stimulată de celulele T helper 17 (Th17). Pe de altă parte, microbiota pulmonară poate influenţa la rândul ei și sistemul imunitar intestinal (de exemplu, perturbările microbiotei intestinale mediate de celulelor Th17 consecutiv infecţiei pulmonare cu virus gripal).
Material preluat din volumul „Pneumologie 2021 – Provocări în pandemia de COVID-19”, publicat de Viaţa Medicală
Bibliografie
1. Watson RL, de Koff EM, Bogaert D. Characterising the respiratory microbiome. Eur Respir J., 2019
2. Gilbert JA, Lynch SV. Community ecology as a framework for human microbiome research. Nat Med 2019
3. Dickson R P et al., Towards an ecology of the lung: new conceptual models of pulmonary microbiology and pneumonia pathogenesis., Lancet Respir Med, 2, 238-46, 2014
4. John R. Erb-Downward et al., Analysis of the Lung Microbiome in the ‘‘Healthy’’Smoker and in COPD., PLoS ONE., 2020
5. Hollian Richardson, et al., The microbiome in bronchiectasis., Eur Respir Rev., 2019
6. Eduard Monsó., Microbiome in chronic obstructive pulmonary disease., Ann Transl Med 2017
7. Lei Wang et al., Role of the Lung Microbiome in the Pathogenesis of Chronic Obstructive Pulmonary Disease., Chin Med J., 2017
8. Zhang Wang et al., Airway host-microbiome interactions in chronic obstructive pulmonary disease., Respiratory Research., 2019
9. Molyneaux PL, et al., Host-microbial interactions in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2017
10. Faner R, Sibila O, Agustí A, et al. The microbiome in respiratory medicine: current challenges and future perspectives. Eur Respir J 2017
11. Kai Sen Tan et al, Respiratory Viral Infections in Exacerbation of Chronic Airway Inflammatory Diseases: Novel Mechanisms and Insights From the Upper Airway Epithelium., Frontiers in Cell and Developmental Biology., 2020
12. Benedikt Ditz et al., Sputum microbiome profiling in COPD: beyond singular pathogen detection., Thorax., 2020
13. Charles S Berenson et al., Impaired innate immune alveolar macrophage response and the predilection for COPD exacerbations., Thorax., 2014
14. Marc A Sze et al., Bacterial microbiome of lungs in COPD., International Journal of COPD 2014
15. Himanshu Desai et al., Bacterial Colonization Increases Daily Symptoms in Patients with Chronic Obstructive Pulmonary Disease., Ann Am Thorac Soc., 2014
16. Mammen M.J, Sanjay Sethi., COPD and the microbiome., Respirology .,2016
17. Sethi S., Murphy T. Infection in the pathogenesis and course of chronic obstructive pulmonary disease. N Engl J Med., 2008
18. Alexa A. Pragman et al., The Lung Microbiome in Moderate and Severe Chronic Obstructive Pulmonary Disease., PLOS ONE., 2012
19. Zakharkina T, et al. Analysis of the airway microbiota of healthy individuals and patients with chronic obstructive pulmonary disease by T-RFLP and clone sequencing. PLoS One. 2013
20. Marian Garcia-Nuñez et al., Severity-Related Changes of Bronchial Microbiome in Chronic Obstructive Pulmonary Disease., Journal of Clinical Microbiology., 2014
21. Millares L., et al., Bronchial microbiome of severe COPD patients colonised by Pseudomonas aeruginosa., Eur J Clin Microbiol Infect Dis., 2014
22. Carine Gomez and Pascal Chanez., The lung microbiome: the perfect culprit for COPD exacerbations? ., Eur Respir J., 2016
23. Eric Jubinville et al., Exacerbation induces a microbiota shift in sputa of COPD patients., PLOS ONE., 2018
24. Dickson RP, et al., The role of the microbiome in exacerbations of chronic lung diseases. Lancet. 2014
25. Aurélien Trompette et al., Gut microbiota metabolism of dietary fiber influences allergic airway disease and hematopoiesis, Nature Medicine, 2014
26. Rafael Enaud., et al., The Gut-Lung Axis in Health and Respiratory Diseases: A Place for Inter-Organ and Inter-Kingdom Crosstalks, Frontiers in Cellular and Infection Microbiology, 2020
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe