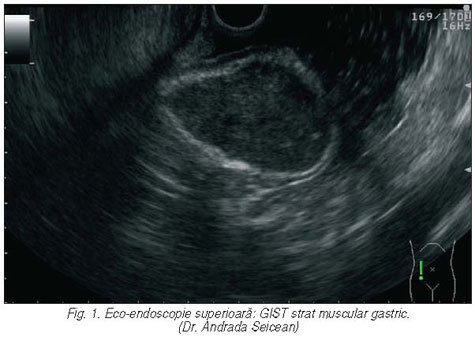
Tumorile gastrointestinale stromale (GIST) constituie o entitate distinctă din punct de vedere clinic şi anatomopatologic. Despre etiologia, tabloul clinic, diagnosticul, tratamentul şi prognosticul acestora aflăm din articolul semnat de dnii dr. Cătălin Nemeş şi prof. dr. Dan Dumitraşcu.
Etiologie
 neuronii intramurali şi
celulele musculare netede ale tubului digestiv. Se asociază cu mutaţii la
nivelul genelor KIT sau PDGFRA (alfa receptorul pentru factorul de creştere
derivat din trombocite), gene care codifică tirozin-kinaza tipul III; unele
dintre acestea sunt consecinţa radioterapiei altor tumori din etajul abdominal
inferior.
neuronii intramurali şi
celulele musculare netede ale tubului digestiv. Se asociază cu mutaţii la
nivelul genelor KIT sau PDGFRA (alfa receptorul pentru factorul de creştere
derivat din trombocite), gene care codifică tirozin-kinaza tipul III; unele
dintre acestea sunt consecinţa radioterapiei altor tumori din etajul abdominal
inferior. Diagnostic
 precum şi PET-scan. Diagnosticul de certitudine este histopatologic şi se obţine
prin prelevarea de biopsii în timpul examinărilor endoscopice.
precum şi PET-scan. Diagnosticul de certitudine este histopatologic şi se obţine
prin prelevarea de biopsii în timpul examinărilor endoscopice. clinică şi
imagistică (eco-endoscopie la 3–6 luni). Excizia este rezervată pacienţilor ale
căror tumori au crescut în dimensiuni, au devenit simptomatice sau când
diagnosticul de GIST este confirmat histopatologic.
clinică şi
imagistică (eco-endoscopie la 3–6 luni). Excizia este rezervată pacienţilor ale
căror tumori au crescut în dimensiuni, au devenit simptomatice sau când
diagnosticul de GIST este confirmat histopatologic. CD 117/c-Kit este un marker diagnostic
definitoriu pozitiv în 95% din GIST (fig.
3). DOG 1 este un nou marker utilizat în diagnosticul GIST, cu
sensibilitate şi specificitate înalte. Alţi markeri pozitivi frecvent în GIST
sunt: CD 34 – marker specific pentru celula mezenchimală sau celula precursoare
hematopoietică (pozitiv în 60%–70% din GIST) (fig. 4), actina – specifică
muşchiului neted (pozitivă în 15%–60%
din cazuri), proteina S-100 – proteină identificată la nivelul tumorilor cu
originea în celulele mezenchimale şi în celulele derivate din creasta neurală
(pozitivă în 10% din GIST), desmina – proteină a filamentelor intermediare
prezente în celula musculară, este rareori exprimată în GIST; Ki67 – proteină
nucleară, marker al proliferării celulare, identificată la nivelul celulelor
neoplazice cu multiplicare intensă, este utilă în evaluarea prognosticului şi în
monitorizare (fig. 5).
CD 117/c-Kit este un marker diagnostic
definitoriu pozitiv în 95% din GIST (fig.
3). DOG 1 este un nou marker utilizat în diagnosticul GIST, cu
sensibilitate şi specificitate înalte. Alţi markeri pozitivi frecvent în GIST
sunt: CD 34 – marker specific pentru celula mezenchimală sau celula precursoare
hematopoietică (pozitiv în 60%–70% din GIST) (fig. 4), actina – specifică
muşchiului neted (pozitivă în 15%–60%
din cazuri), proteina S-100 – proteină identificată la nivelul tumorilor cu
originea în celulele mezenchimale şi în celulele derivate din creasta neurală
(pozitivă în 10% din GIST), desmina – proteină a filamentelor intermediare
prezente în celula musculară, este rareori exprimată în GIST; Ki67 – proteină
nucleară, marker al proliferării celulare, identificată la nivelul celulelor
neoplazice cu multiplicare intensă, este utilă în evaluarea prognosticului şi în
monitorizare (fig. 5). Deoarece aceste tumori au un comportament
imprevizibil, Miettinen şi Lasota, în 2006, au alcătuit un tabel de risc (tabelul 1), bazat pe localizarea
tumorii, mărimea (diametrul maxim exprimat în cm) şi rata mitotică (numărul de celule
aflate în diviziune pe 50 HPF – high
power field). În acest tabel, GIST au fost incluse în mai multe categorii
de risc. Riscul trebuie menţionat în buletinul histopatologic, fiind important
pentru stabilirea managementului terapeutic.
Diagnosticul diferenţial
Diagnosticul
diferenţial al tumorilor stromale
gastrointestinale include tumorile cu origine musculară (leiomiomul şi
leiomiosarcomul), tumorile cu origine neurală (schwanomul), tumorile
fibroblastice (fibromatoza – tumora desmoidă, tumora inflamatorie
miofibroblastică, tumora fibroasă solitară), melanomul malign, carcinomul
sarcomatoid, neuroendocrin şi angiosarcomul.
Tratament
 metastazelor.
metastazelor. pacienţilor cu metastaze hepatice.
pacienţilor cu metastaze hepatice.Prognostic
Riscul de
recurenţă sau metastaze postchirurgie este
dat de clasa de risc (tabelul 2)
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe