Inflamaţia intestinală este un proces important în etiopatogeneza bolilor inflamatorii intestinale (BII)
 Inflamaţia intestinală este un proces important în etiopatogeneza bolilor inflamatorii intestinale (BII) (1, 2). Deși sunt mult studiate, BII au, totuși, o patogeneză incomplet descifrată, fiind incriminaţi însă o multitudine de factori aflaţi în interacţiune: genetici, de mediu, imunologici (1–3). Inflamaţia intestinală a fost bănuită de mult timp ca fiind implicată în apariţia BII, iar datele din literatură au confirmat implicarea acesteia (1, 2). În plus, literatura recentă aduce noi informaţii și schimbă modul de a privi și de a înţelege mecanismul complex care, de fapt, conduce la inflamaţie intestinală (4, 5).
Inflamaţia intestinală este un proces important în etiopatogeneza bolilor inflamatorii intestinale (BII) (1, 2). Deși sunt mult studiate, BII au, totuși, o patogeneză incomplet descifrată, fiind incriminaţi însă o multitudine de factori aflaţi în interacţiune: genetici, de mediu, imunologici (1–3). Inflamaţia intestinală a fost bănuită de mult timp ca fiind implicată în apariţia BII, iar datele din literatură au confirmat implicarea acesteia (1, 2). În plus, literatura recentă aduce noi informaţii și schimbă modul de a privi și de a înţelege mecanismul complex care, de fapt, conduce la inflamaţie intestinală (4, 5).
Deși este recunoscută implicarea inflamaţiei în etiopatogeneza bolii, date mai recent publicate încearcă să descopere lanţul etiopatogenetic complex prin care inflamaţia acţionează, de fapt, pe mai multe căi (2, 3).
Diagnosticul BII se bazează pe caracteristici clinice, explorări complementare de laborator, endoscopice, radiologice (3, 6, 7). Dar acestea nu sunt suficiente, întrucât această entitate trebuie caracterizată complet, în privinţa tipului (boală Crohn sau colită ulcerativă), formei, severităţii, extensiei. Din aceste considerente, se încearcă a se găsi modalităţi noninvazive, rapide, ieftine și accesibile pacienţilor, respectiv markeri, pentru a putea facilita atât diagnosticul, cât și supravegherea pacienţilor cu BII.
Pornind de la mecanismele acestei căi patogenetice, cercetătorii și-au propus să găsească markeri specifici pentru inflamaţie în cazul BII. Dovadă stau multitudinea de articole știinţifice publicate în ultimele două decade care vizează acest subiect.
Pentru a discuta despre markeri, trebuie mai întâi să definim termenii. Un „marker” sau, mai frecvent folosit, un „biomarker” (marker biologic) reprezintă o variabilă obiectivă, cuantificabilă, în general o analiză, o determinare de laborator ca „marcă” a unei boli, iar pentru a vorbi de un marker ideal, acesta ar trebui să îndeplinească anumite caracteristici: sensibilitate și specificitate înaltă, să fie ușor de utilizat și noninvaziv sau microinvaziv, reproductibil, cu o variabilitate inter-observator scăzută, stabilitate, și să fie puţin costisitor (8, 9). Desigur, toate aceste deziderate au stat la baza studiilor care au vizat găsirea unui marker specific pentru BII, a cărui determinare să fie, totodată, și ușor de tolerat de pacient. Dificultatea de a găsi însă un marker specific BII rezidă, de fapt, din mecanismul complex al inflamaţiei intestinale, din faptul că există mai multe căi și sisteme implicate în generarea inflamaţiei intestinale, iar, în plus, markerii pot fi utilizaţi în diferite scopuri: diagnostic, de identificare a unor forme sau subtipuri ale bolii, prognostic, de ajustare a tratamentului (2, 4).
Cercetătorii au studiat nu doar markeri sanguini și fecali, ci și potenţiali markeri urinari, din aerul expirat sau mucozali (5, 9–31) (tabel). 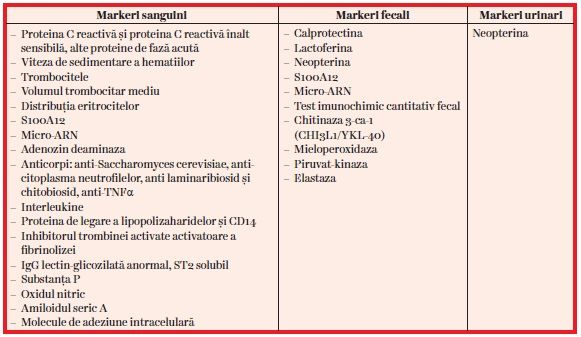
Dintre markerii cercetaţi, cele mai multe studii au fost adresate markerilor sanguini și fecali, aceștia putând fi obţinuţi prin modalităţi non- sau minim invazive, spre deosebire de cei mucozali, care pot fi obţinuţi prin mijloace invazive, îndepărtându-se astfel de caracteristicile unui marker. Direcţiile noi de cercetare vizează descompunerea acestor căi, care conduc la inflamaţie, până la nivel molecular, chiar la căile de semnalizare intracelulară, odată cu utilizarea tehnologiilor „omics” (4). Nu vom trece în revistă markerii genetici sau ai polimorfismelor genice studiate în BII, având în vedere multitudinea de publicaţii adresate acestui subiect.
În încercarea de a găsi un marker specific, s-au studiat mulţi dintre markerii utilizaţi pentru evaluarea activităţii bolii. Cele mai multe studii au evaluat: viteza de sedimentare a hematiilor (VSH), proteina C reactivă (PCR) și proteina C înalt sensibilă (Hs CRP). Din multitudinea de markeri investigaţi, puţini sunt utilizaţi în practica clinică. Dintre aceștia, doar PCR, o proteină de fază acută, și VSH și-au dovedit aplicabilitatea, fiind utilizate în practica clinică (6, 7, 10). VSH și CRP sunt explorări de laborator uzuale, markeri surogat pentru inflamaţie intestinală (7). CRP nu este utilizat doar pentru aprecierea severităţii colitei, făcând parte din diverse scoruri (6), ci nivelurile crescute ale CRP se corelează cu recăderile, astfel încât CRP este folosit și pentru a detecta recăderile (2, 10, 32–35). Deși CRP nu este specifică doar BII, putând fi crescută în orice afecţiune inflamatorie, importanţa și rolurile CRP sunt subliniate inclusiv de ghidurile europene – atât cel adresat bolii Crohn (7), cât și cel adresat colitei ulcerative (6). Există însă diferenţe în rolul pe care îl are determinarea CRP în boala Crohn față de colita ulcerativă, CRP fiind mai util pentru evaluarea activităţii bolii (6, 9).
Deși au fost studiaţi mai mulţi markeri, în practica clinică s-au impus doar calprotectina și lactoferina. Calprotectina este mai specifică pentru inflamaţia intestinală comparativ cu CRP și se corelează mai bine cu aspectul endoscopic faţă de CRP (10, 29, 36, 37). Multiplele studii publicate au adus precizări privind importanţa calprotectinei fecale: astfel, aceasta este utilă pentru facilitarea diagnosticului, evaluarea activităţii bolii, dar și pentru monitorizarea pacienţilor cu boală Crohn și pentru decelarea recăderilor apărute postchirurgical (7, 9). Nici aceasta nu este însă un marker perfect, întrucât ea poate fi crescută și în alte afecţiuni (38). Calprotectina poate fi utilă, de asemenea, pentru diagnosticul diferenţial dintre BII și sindromul de intestin iritabil (6), deși există și o categorie restrânsă de pacienţi cu sindrom de intestin iritabil care pot avea un grad scăzut de inflamaţie intestinală atestată de valorile calprotectinei fecale ușor crescute (39).
Pe lângă calprotectină, și lactoferina s-a dovedit utilă pentru diagnosticul inflamaţiei acute intestinale (6, 40, 41). Nivelurile calprotectinei și/sau lactoferinei fecale sunt în curs de a constitui și „markeri surogat” ai vindecării mucoasei, deși nu există încă bine definit nivelul-prag al acestora (7).
În pofida unei activităţi intense de cercetare în domeniul biomarkerilor, există un număr restrâns de markeri serologici și din materiile fecale care sunt utilizaţi în practica clinică. Markerii utilizaţi în acest moment, respectiv CRP, calprotectina și lactoferina, nu sunt specifici pentru BII, ci atestă inflamaţia. În practica clinică, CRP, calprotectina și lactoferina pot fi folosiţi pentru monitorizarea terapiei, urmărirea pe termen scurt și pentru predicţia recăderilor clinice. În plus, calprotectina poate ajuta la diferenţierea între BII și sindromul de intestin iritabil. Activitatea de cercetare în acest domeniu trebuie susţinută și continuată spre direcţii noi, respectiv cea vizând căile patogenetice ale inflamaţiei, prin studii de proteomică și genomică funcţională pentru descoperirea unor markeri specifici acestei entităţi, care să faciliteze diagnosticul și monitorizarea pacienţilor.
1. Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 2007;448(7152):427-34
2. Pedersen J et al. Inflammatory pathways of importance for management of inflammatory bowel disease. World J Gastroenterol. 2014;20(1):64-77
3. Zhang YZ, Li YY. Inflammatory bowel disease: pathogenesis. World J Gastroenterol. 2014;20(1):91-9
4. Brooks J et al. Omics approaches to identify potential biomarkers of inflammatory diseases in the focal adhesion complex. Genomics Proteomics Bioinformatics. 2017;15(2):101-9
5. Chan PP et al. Current application of proteomics in biomarker discovery for inflammatory bowel disease. World J Gastrointest Pathophysiol. 2016;7(1):27-37
6. Magro F et al. Third European Evidence-based Consensus on Diagnosis and Management of Ulcerative Colitis. Part 1: Definitions, Diagnosis, Extra-intestinal Manifestations, Pregnancy, Cancer Surveillance, Surgery, and Ileo-anal Pouch Disorders. J Crohns Colitis. 2017;11(6):
649-70
7. Gomollon F et al. 3rd European Evidence-based Consensus on the Diagnosis and Management of Crohn’s Disease 2016: Part 1: Diagnosis and Medical Management. J Crohns Colitis. 2017;11(1):3-25
8. Spiller RC. Potential biomarkers. Gastroenterol Clin North Am. 2011;40(1):121-39
9. Fengming Y, Jianbing W. Biomarkers of inflammatory bowel disease. Dis Markers. 2014;2014:710915
10. Chang S et al. Disease monitoring in inflammatory bowel disease. World J Gastroenterol. 2015;21(40):11246-59
11. Husain N et al. Neopterin concentration as an index of disease activity in Crohn’s disease and ulcerative colitis. J Clin Gastroenterol. 2013;47(3):246-51
12. Dalal SR, Kwon JH. The Role of MicroRNA in Inflammatory Bowel Disease. Gastroenterol Hepatol (N Y). 2010;6(11):714-22
13. Diaz-Jimenez D et al. Soluble ST2: a new and promising activity marker in ulcerative colitis. World J Gastroenterol. 2011;17(17):2181-90
14. Maor I et al. Adenosine deaminase activity in patients with Crohn’s disease: distinction between active and nonactive disease. Eur J Gastroenterol Hepatol. 2011;23(7):598-602
15. Turner D et al. Faecal calprotectin, lactoferrin, M2-pyruvate kinase and S100A12 in severe ulcerative colitis: a prospective multicentre comparison of predicting outcomes and monitoring response. Gut. 2010;59(9):1207-12
16. Malerba M et al. Exhaled nitric oxide as a marker of lung involvement in Crohn’s disease. Int J Immunopathol Pharmacol. 2011;24(4):1119-24
17. Oikonomou KA et al. Angiogenin, angiopoietin-1, angiopoietin-2, and endostatin serum levels in inflammatory bowel disease. Inflamm Bowel Dis. 2011;17(4):963-70
18. Czub E et al. Fecal pyruvate kinase: a potential new marker for intestinal inflammation in children with inflammatory bowel disease. Scand J Gastroenterol. 2007;42(10):1147-50
19. Langhorst J et al. Noninvasive markers in the assessment of intestinal inflammation in inflammatory bowel diseases: performance of fecal lactoferrin, calprotectin, and PMN-elastase, CRP, and clinical indices. Am J Gastroenterol. 2008;103(1):162-9
20. Shinzaki S et al. Lectin-based immunoassay for aberrant IgG glycosylation as the biomarker for Crohn’s disease. Inflamm Bowel Dis. 2013;19(2):321-31
21. Zholudev A et al. Serologic testing with ANCA, ASCA, and anti-OmpC in children and young adults with Crohn’s disease and ulcerative colitis: diagnostic value and correlation with disease phenotype. Am J Gastroenterol. 2004;99(11):2235-41
22. Nakarai A et al. Evaluation of mucosal healing of ulcerative colitis by a quantitative fecal immunochemical test. Am J Gastroenterol. 2013;108(1):83-9
23. Gu P et al. Increased Cell Adhesion Molecules, PECAM-1, ICAM-3, or VCAM-1, Predict Increased Risk for Flare in Patients With Quiescent Inflammatory Bowel Disease. J Clin Gastroenterol. 2017;51(6):522-7
24. Quinton JF et al. Anti-Saccharomyces cerevisiae mannan antibodies combined with antineutrophil cytoplasmic autoantibodies in inflammatory bowel disease: prevalence and diagnostic role. Gut. 1998;42(6):788-91
25. Dotan I et al. Antibodies against laminaribioside and chitobioside are novel serologic markers in Crohn’s disease. Gastroenterology. 2006;131(2):366-78
26. Hosomi S et al. Sepsis Markers Soluble IL-2 Receptor and Soluble CD14 Subtype as Potential Biomarkers for Complete Mucosal Healing in Patients With Inflammatory Bowel Disease. J Crohns Colitis. 2018;12(1):87-95
27. Weinstock JV. Substance P and the regulation of inflammation in infections and inflammatory bowel disease. Acta Physiol (Oxf). 2015;213(2):453-61
28. Boldeanu MV et al. Investigation of inflammatory activity in ulcerative colitis. Rom J Morphol Embryol. 2014;55(4):1345-51
29. Schoepfer AM et al. Fecal calprotectin correlates more closely with the Simple Endoscopic Score for Crohn’s disease (SES-CD) than CRP, blood leukocytes, and the CDAI. Am J Gastroenterol. 2010;105(1):162-9
30. Lakatos PL et al. Serum lipopolysaccharide-binding protein and soluble CD14 are markers of disease activity in patients with Crohn’s disease. Inflamm Bowel Dis. 2011;17(3):767-77
31. Owczarek D et al. Activated thrombin activatable fibrinolysis inhibitor (TAFIa) is associated with inflammatory markers in inflammatory bowel diseases TAFIa level in patients with IBD. J Crohns Colitis. 2012;6(1):13-20
32. Boirivant M et al. The clinical significance of serum C reactive protein levels in Crohn’s disease. Results of a prospective longitudinal study. J Clin Gastroenterol. 1988;10(4):401-5
33. Koelewijn CL et al. C-reactive protein levels during a relapse of Crohn’s disease are associated with the clinical course of the disease. World J Gastroenterol. 2008;14(1):85-9
34. Bitton A et al. Predicting relapse in Crohn’s disease: a biopsychosocial model. Gut. 2008;57(10):1386-92
35. Menees SB et al. A meta-analysis of the utility of C-reactive protein, erythrocyte sedimentation rate, fecal calprotectin, and fecal lactoferrin to exclude inflammatory bowel disease in adults with IBS. Am J Gastroenterol. 2015;110(3):444-54
36. D’Haens G et al. Fecal calprotectin is a surrogate marker for endoscopic lesions in inflammatory bowel disease. Inflamm Bowel Dis. 2012;18(12):2218-24
37. Mosli MH et al. C-Reactive Protein, Fecal Calprotectin, and Stool Lactoferrin for Detection of Endoscopic Activity in Symptomatic Inflammatory Bowel Disease Patients: A Systematic Review and Meta-Analysis. Am J Gastroenterol. 2015;110(6):802-19
38. Sipponen T. Diagnostics and prognostics of inflammatory bowel disease with fecal neutrophil-derived biomarkers calprotectin and lactoferrin. Dig Dis. 2013;31(3-4):
336-44
39. David LE et al. Semiquantitative fecal calprotectin test in postinfectious and non-postinfectious irritable bowel syndrome: cross-sectional study. Sao Paulo Med J. 2015;133(4):343-9
40. Costa F et al. Role of faecal calprotectin as non-invasive marker of intestinal inflammation. Dig Liver Dis. 2003;35(9):642-7
41. Kane SV et al. Fecal lactoferrin is a sensitive and specific marker in identifying intestinal inflammation. Am J Gastroenterol. 2003;98(6):1309-14
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe