Antibiorezistenţa nu este un fenomen ciclic
sau tranzitoriu, ci o proprietate intrinsecă a lumii bacteriene. Variabilitatea
rezistenţei este legată de apariţia mutaţiilor sau de capacitatea bacteriilor
de a accepta ADN străin.
Un „antibiotic bun“ este definit prin
toxicitatea diferenţială (mai mare pentru bacterii decât pentru organismul
uman, cu efecte secundare absente sau minime) şi prin spectrul de activitate
asupra mai multor specii bacteriene. Deoarece în practica medicală, izolarea şi
identificarea speciei bacteriene responsabile de o anumită infecţie durează un
anumit timp, este util a avea un antibiotic ce acţionează asupra unui spectru
etiologic cât mai larg posibil. Administrarea de antibiotice cu spectru larg
are însă şi consecinţe nedorite. Astfel de antibiotice omoară nu numai
bacteriile cu rol etiologic într-o infecţie, ci şi microbiota comensală, producând
un dezechilibru (dismicrobism) ce permite bacteriilor condiţionat patogene
(oportuniste) să colonizeze şi să declanşeze diverse mecanisme patogene, cu
manifestări clinice grave (de exemplu, diareea ulceronecrotică produsă de Clostridium difficile sau vaginitele
micotice postantibioticoterapie, produse de Candida
albicans).
REZISTENŢA
BACTERIANĂ LA ANTIBIOTICE
Un alt aspect al tratamentului cu antibiotic
cu spectru larg este legat de selecţia din microbiota proprie a organismului a
unor suşe rezistente, chiar dacă nu se instalează dismicrobismul bacterian.
Membri ai microbiotei organismului uman pot fi cauza unor infecţii dobândite în
mediul intraspitalicesc. Tratamentul cu vancomicină pentru infecţiile cu Staphylococcus aureus
meticilino-rezistent (MRSA) sau pentru diareea cu Clostridium difficile a dus la colonizări şi infecţii urinare cu Enterococcus faecium
vancomicină-rezistent (VRE).
 Biodisponibilitatea (pătrunderea eficientă
la locul infecţiei) este o altă caracteristică importantă. Biodisponibilitatea
măsoară fracţia dintr-un preparat antibiotic ce pătrunde în circulaţia
sistemică şi se concentrează la locul infecţiei, unde acţionează specific.
Biodisponibilitatea (pătrunderea eficientă
la locul infecţiei) este o altă caracteristică importantă. Biodisponibilitatea
măsoară fracţia dintr-un preparat antibiotic ce pătrunde în circulaţia
sistemică şi se concentrează la locul infecţiei, unde acţionează specific. Antibioticele acţionează asupra bacteriilor
prin inhibarea funcţiilor fiziologice specifice, cum ar fi: sinteza peretelui
bacterian, replicare/transcripţie ADN, sinteză proteică, respiraţie celulară.
Pentru a-şi exercita acţiunea, antibioticul trebuie să se lege specific de
moleculele-ţintă, situate de obicei intracelular.
Activitatea intrinsecă a antibioticului faţă
de anumite specii bacteriene depinde de o combinaţie complexă de factori, cum
ar fi afinitatea acestuia faţă de ţintă, numărul ţintelor moleculare care
trebuie inactivate, concentraţia antibioticului în apropierea ţintei (Cint),
concentraţia lui în mediul înconjurător al bacteriilor (Cext). Activitatea este
influenţată, de asemenea, de permeabilitatea membranelor bacteriene la
antibiotic (difuzie simplă sau transport activ), de existenţa mecanismelor de
activare/inactivare, de prezenţa pompelor de eflux bacteriene, care previn
acumularea antibioticului în interiorul celulei bacteriene.
Bacteriile au abilitatea de a dezvolta
rezistenţă la antibiotice printr-o multitudine de mecanisme, ale căror natură
şi eficienţă depind de specie, dar şi de particularităţile chimice ale
antibioticului. Microorganismele au uriaşa capacitate de a suferi mutaţii şi de
a face schimburi de material genetic.
specie, dar şi de particularităţile chimice ale
antibioticului. Microorganismele au uriaşa capacitate de a suferi mutaţii şi de
a face schimburi de material genetic.
În SUA, s-a estimat că aproximativ 50% din
antibiotice sunt administrate incorect, frecvent în infecţii virale ori în doze
sau la intervale de administrare improprii. În ultimii ani, în întreaga lume,
antibioticele s-au administrat excesiv, în condiţiile în care au apărut doar câteva
molecule antibacteriene noi. Una dintre cele mai mari surse a emergenţei
antibiorezistenţei o constituie tratamentul antibiotic administrat animalelor
din ferme şi înglobarea antibioticului în hrana acestora, ca factor de creştere
rapidă, pentru sacrificare.
Aglomerarea urbană, creşterea numărului
persoanelor fără locuinţă, nutriţia săracă şi igiena deficitară, lipsa îngrijirii
medicale corespunzătoare duc la răspândirea rezistenţei la antibiotice, atât în
ţările dezvoltate economic, cât mai ales, în ţările în curs de dezvoltare. În
acestea, organizarea socială, a reţelei de îngrijiri de sănătate şi a
spitalelor reprezintă surse pentru dobândirea de către bacterii a genelor de
rezistenţă, care, ulterior, se răspândesc în comunitate. Intensificarea
turismului (a călătoriilor internaţionale) reprezintă încă o modalitate de răspândire
în întreaga lume a bacteriilor multirezistente.
Alte surse ale antibiorezistenţei sunt
reprezentate de pacienţii cu imunosupresie, bolnavii cu SIDA, procedurile
medicale invazive, transplantul de organe, implanturile de dispozitive medicale
(care implică formarea de biofilm) etc.
Toţi
aceşti factori sunt implicaţi în creşterea incidenţei infecţiilor bacteriene
dobândite în comunitate sau în spital cu tulpini multidrog-rezistente (MDR).
EVOLUŢIA
ANTIBIOREZISTENŢEI
Testarea, cunoaşterea şi
analiza în dinamica multianuală a antibiorezistenţei locale reprezintă o
obligaţie a microbiologilor, datorită informaţiilor foarte utile pe care le
furnizează colegilor clinicieni, în scopul alegerii celei mai eficiente decizii
terapeutice, de primă intenţie. O raportare anuală sumară a Laboratorului de
microbiologie din Spitalul „Victor Babeş“ este exemplificată în tabelul alăturat.
Staphylococcus
spp. meticilino-rezistent
Stafilococii sunt bacterii
Gram-pozitive cu sensibilitate naturală la b-lactami (excepţie făcând
monobactamii). Au o mare capacitate de adaptare rapidă la presiunea determinată
de tratamentul antibiotic şi de a dobândi rezistenţă. După introducerea penicilinei
G în terapie în anul 1940, în următorii ani au fost deja izolate tulpini de S. aureus rezistente la penicilină. La
doar doi ani după introducerea penicilinei M în tratamentul infecţiilor cu
tulpini producătoare de beta-lactamaze (1959), au fost depistate tulpini de S. aureus meticilino-rezistente (MRSA).
Izolatele de S. aureus rezistente la penicilina G sunt rezistente şi la alte
peniciline: ampicilină, amoxicilină, carbenicilină, azlocilină, ticarcilină şi
piperacilină. Combinaţia cu inhibitori de penicilinază (acid clavulanic,
sulbactam, tazobactam) reface în vitro
sensibilitatea la aceste antibiotice.
Dacă se identifică rezistenţă la oxacilină
(test screening la cefoxitin) a stafilococului auriu sau a speciilor de
stafilococi coagulazo-negativi, atunci se consideră ca inactivi şi ceilalţi
b-lactami: toate penicilinele, penicilinele asociate cu inhibitori de
beta-lactamază, cefalosporinele şi carbapenemele.
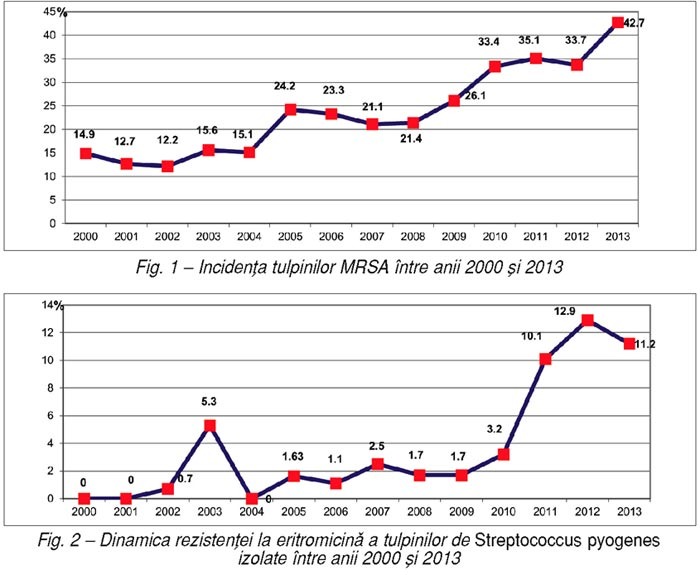
Analiza în dinamică a incidenţei globale a
tulpinilor de MRSA în spitalul nostru în perioada 2000–2013 (fig. 1) evidenţiază o creştere a
acesteia de la 12,2% (2002) la 42,7% (2013). Tulpinile de MRSA au fost izolate
din diverse tipuri de prelevate: secreţii, leziuni cutanate superficiale şi
colecţii profunde, infecţii respiratorii şi din sfera ORL, infecţii sistemice
etc.
Creşterea progresivă a incidenţei tulpinilor
MRSA se explică şi prin înfiinţarea Compartimentului de terapie intensivă, şi
prin creşterea numărului de pacienţi transferaţi din alte spitale din
Bucureşti.
Dinamica rezistenţei la macrolide a tulpinilor de Streptococcus pyogenes
Faringitele acute determinate de
streptococul beta hemolitic grup A Lancefield (Streptococcus pyogenes) au ca recomandare
terapeutică penicilina G (administrare orală sau parenterală) ca tratament de
elecţie, datorită costului redus, spectrului îngust de acţiune antibacteriană
şi eficienţei clinice. Pacienţii cu alergie la penicilină beneficiază de
tratament cu cefalosporine de generaţia I: cefalexin, cefadroxil. În caz de
eşec terapeutic, experţii recomandă administrarea cefalosporinelor, datorită
eficienţei superioare a tratamentului în eradicarea infecţiilor şi a portajului
cronic.
În ultimii trei ani, în Laboratorul de
microbiologie am constatat o creştere bruscă a incidenţei rezistenţei la
eritromicină a tulpinilor de S. pyogenes,
în urma administrării macrolidelor în infecţiile respiratorii şi cutanate.
Această indicaţie terapeutică este frecvent utilizată în medicina primară sau în
automedicaţie.
În anul 2010, am înregistrat o rezistenţă la
eritromicină de 3,2%, iar în 2011, o creştere bruscă la 10,1%, menţinută în
următorii ani (fig. 2).
Dinamica antibiorezistenţei la Streptococcus pneumoniae
Streptococcus
pneumoniae este recunoscut a fi un important factor etiologic al bacteriemiei
şi meningitei şi cea mai frecventă cauză a infecţiilor acute comunitare de
tract respirator, incluzând pneumonia, rinosinuzita şi otita medie. Penicilina
a fost larg utilizată, fiind considerată un agent antibacterian foarte activ împotriva
infecţiilor streptococice, până în anii ’50, când au apărut primele tulpini
rezistente, dar cu incidenţă foarte redusă. După anul 1970, situaţia s-a
schimbat dramatic, odată cu apariţia tulpinilor de S. pneumoniae rezistente la penicilină şi totodată multidrog-rezistente
(ampicilină, cloramfenicol, macrolide, tetraciclină,
trimetoprim/sulfametoxazol), aparţinând serotipului 19A. Totuşi, după 60 de ani
de utilizare a penicilinelor, penicilina G rămâne un antibiotic foarte activ
pentru tratamentul majorităţii infecţiilor pneumococice necomplicate.
Rezistenţa la penicilina G a tulpinilor de S. pneumoniae a fost până de curând (2008) arbitrar încadrată în
categoriile S, I, R, în funcţie de intervalele valorice ale CMI. Această
clasificare a valorilor CMI la penicilina G a creat confuzii şi a determinat
aplicaţii clinice improprii. În prezent, situaţia a fost pe deplin clarificată,
prin stabilirea valorilor clinic corespunzătoare ale CMI şi a pragurilor (breakpoint) de sensibilitate la
majoritatea b-lactamilor în funcţie de regimul de dozare a antibioticului şi de
locul infecţiei (infecţii meningeale şi non-meningeale).
Conform ghidurilor EUCAST (decembrie 2013) privind detecţia mecanismelor
de rezistenţă şi rezistenţa specifică a izolatelor de importanţă clinică şi
epidemiologică, breakpoint-urile clinice la pneumococ au fost la început
concepute pentru a asigura succesul terapeutic al meningitelor pneumococice.
Studii clinice au demonstrat că pneumoniile determinate de tulpini de
pneumococ, cu sensibilitate intermediară la penicilină şi cu tratament
parenteral cu penicilina G au avut aceeaşi evoluţie favorabilă ca şi cele
tratate cu alte clase de antibiotice.
În
contextul noilor criterii de interpretare a valorilor CMI pentru penicilina G în
infecţiile non-meningeale cu S.
pneumoniae, din anul 2009 se consemnează o rezistenţă semnificativ scăzută
la penicilina G (2,7% în 2013) a pneumococului izolat din secreţii respiratorii
şi din sfera ORL (fig. 3), stimulând
clinicienii să utilizeze penicilina în tratamentul infecţiilor respiratorii
necomplicate.
Sensibilitatea pneumococilor la penicilina G este foarte variabilă, în
funcţie de serotip. Tulpinile sălbatice de pneumococ sunt considerate sensibile
la levofloxacin şi moxifloxacin şi intermediar sensibile la ciprofloxacin şi
ofloxacin. Dintre carbapeneme, imipenemul şi meropenemul sunt foarte active pe
tulpinile de pneumococ rezistente la penicilina G, în timp ce ertapenemul este
mai puţin activ.
Enterococcus
faecium
 Tulpinile de Enterococcus faecium izolate din
infecţii de tract urinar au prezentat
0% rezistenţă la vancomicină în perioada 1999–2012 şi 1,5 % în 2013, în urma
tratamentului de lungă durată cu vancomicină al pacienţilor cu enterocolită
acută cu Clostridium difficile.
Tulpinile de Enterococcus faecium izolate din
infecţii de tract urinar au prezentat
0% rezistenţă la vancomicină în perioada 1999–2012 şi 1,5 % în 2013, în urma
tratamentului de lungă durată cu vancomicină al pacienţilor cu enterocolită
acută cu Clostridium difficile.
Incidenţa tulpinilor de E. coli şi K.
pneumoniae
ESBL
Producţia de enzime inactivatoare este cel
mai important mecanism de rezistenţă la antibioticele β-lactamice
în familia Enterobacteriaceae. Există
o mare diversitate de b-lactamaze.
Fenotipul de rezistenţă caracteristic tulpinilor de Enterobacteriaceae producătoare de b-lactamaze cu spectru extins
(ESBL) se caracterizează prin rezistenţă la peniciline şi cefalosporine, cu
excepţia cefamicinelor. Carbapenemele şi cefamicinele nu sunt, de obicei,
substrat pentru aceste enzime.
ESBL
au fost descrise în Europa de Vest în anii ’80, când cefalosporinele de
generaţia a treia erau larg utilizate în secţiile de ATI. Astăzi sunt prezente
atât în infecţii intraspitaliceşti, cât şi în comunitate. Prevalenţa este
aproape identică în Franţa (1–3%) şi Germania (1–5%), dar mare în Italia
(9–15%), Marea Britanie (7–22%) şi Europa de Est (Rusia, Polonia, Turcia,
Grecia) – 39–47%.
În
perioada 2000–2013 am înregistrat în spitalul nostru o creştere progresivă a
incidenţei tulpinilor de E. coli
producătoare de ESBL, de la 3,2% în 2000, la 27% în 2013 (fig. 4). Această situaţie se explică prin creşterea numărului de
pacienţi cu infecţii multiple cu bacterii MDR din servicii de ATI şi
chirurgicale din alte spitale, prin tratamentul de primă intenţie cu
cefalosporine de generaţia a treia şi prin înfiinţarea compartimentului ATI în
spitalul nostru.
Klebsiella pneumoniae este o specie
bacteriană în general mai rezistentă la antibiotice decât E. coli. Analiza în dinamică a incidenţei tulpinilor producătoare
de ESBL arată o creştere a acesteia de la 17,6% în 2000 la 54,4% în 2013 (fig. 5).
Mecanismul de producere a b-lactamazelor cu
spectru extins este frecvent asociat la Enterobacteriaceae
cu alte mecanisme de rezistenţă (fluorochinolone, aminoglicozide, sulfonamide,
carbapeneme etc.), care conduc la multidrog-rezistenţă, situaţie în care
tratamentul acestor specii beneficiază de puţine alternative terapeutice, cum
ar fi carbapenemele sau polimixinele (fig.
6).
Rezistenţa la antibiotice a bacteriilor Gram-negative
nefermentative
 O caracteristică distinctivă a speciilor de Pseudomonas aeruginosa (fig. 7) şi Acinetobacter baumannii (fig. 8), ca patogeni responsabili, în
special, de infecţii dobândite în spital, o reprezintă nivelul înalt de rezistenţă
intrinsecă la antibiotice, în particular la b-lactami. În plus, este
recunoscută abilitatea acestor specii de a dobândi multiple mecanisme de
rezistenţă, în special enzimatice, frecvent acumulate în aceeaşi tulpină.
O caracteristică distinctivă a speciilor de Pseudomonas aeruginosa (fig. 7) şi Acinetobacter baumannii (fig. 8), ca patogeni responsabili, în
special, de infecţii dobândite în spital, o reprezintă nivelul înalt de rezistenţă
intrinsecă la antibiotice, în particular la b-lactami. În plus, este
recunoscută abilitatea acestor specii de a dobândi multiple mecanisme de
rezistenţă, în special enzimatice, frecvent acumulate în aceeaşi tulpină.
CONCLUZII
Aplicarea noilor tehnologii, a metodelor
avansate de cercetare, prin care se studiază mecanismele moleculare şi genetice
ale dobândirii rezistenţei bacteriene la antibiotice, asigură un potential
uriaş de descoperire de molecule noi sau modificare a celor existente. Multe
dintre produsele naturale vechi cu activitate antibiotică pot fi reanalizate
din punct de vedere chimic şi microbiologic.
Asocierile, combinaţiile de antibiotice
reprezintă o promisiune în succesul tratamentului bolilor emergente şi
reemergente.
Soluţia reducerii incidenţei infecţiilor cu
bacterii MDR ar fi conservarea resurselor preţioase, reprezentate de
antibioticele „de rezervă“, ce ar trebui utilizate doar în situaţii limită,
salvatoare de viaţă.
 Este nevoie de o implicare responsabilă a
tuturor factorilor: pacienţi (educaţie medicală, automedicaţie), medici (abuz,
subdozare, antibiotic administrat ca medicaţie antitermică în infecţii
virale), factori decizionali din agricultură şi industrie, în scopul păstrării
antibioticelor eficiente şi pentru generaţiile următoare.
Este nevoie de o implicare responsabilă a
tuturor factorilor: pacienţi (educaţie medicală, automedicaţie), medici (abuz,
subdozare, antibiotic administrat ca medicaţie antitermică în infecţii
virale), factori decizionali din agricultură şi industrie, în scopul păstrării
antibioticelor eficiente şi pentru generaţiile următoare. Avem nevoie de o suplimentare periodică cu
molecule de antibiotice noi şi vaccinuri, care să permită „oprirea timpului“ în
ceea ce priveşte evoluţia şi răspândirea rezistenţei bacteriene.
Supravegherea antibiorezistenţei în zona
noastră geografică este foarte importantă pentru administrarea unui tratament
antibiotic de primă intenţie corect şi pentru elaborarea unei politici adecvate
în lupta împotriva dobândirii rezistenţei la antibiotice.
 Biodisponibilitatea (pătrunderea eficientă
la locul infecţiei) este o altă caracteristică importantă. Biodisponibilitatea
măsoară fracţia dintr-un preparat antibiotic ce pătrunde în circulaţia
sistemică şi se concentrează la locul infecţiei, unde acţionează specific.
Biodisponibilitatea (pătrunderea eficientă
la locul infecţiei) este o altă caracteristică importantă. Biodisponibilitatea
măsoară fracţia dintr-un preparat antibiotic ce pătrunde în circulaţia
sistemică şi se concentrează la locul infecţiei, unde acţionează specific. specie, dar şi de particularităţile chimice ale
antibioticului. Microorganismele au uriaşa capacitate de a suferi mutaţii şi de
a face schimburi de material genetic.
specie, dar şi de particularităţile chimice ale
antibioticului. Microorganismele au uriaşa capacitate de a suferi mutaţii şi de
a face schimburi de material genetic. Tulpinile de Enterococcus faecium izolate din
infecţii de tract urinar au prezentat
0% rezistenţă la vancomicină în perioada 1999–2012 şi 1,5 % în 2013, în urma
tratamentului de lungă durată cu vancomicină al pacienţilor cu enterocolită
acută cu Clostridium difficile.
Tulpinile de Enterococcus faecium izolate din
infecţii de tract urinar au prezentat
0% rezistenţă la vancomicină în perioada 1999–2012 şi 1,5 % în 2013, în urma
tratamentului de lungă durată cu vancomicină al pacienţilor cu enterocolită
acută cu Clostridium difficile.
 O caracteristică distinctivă a speciilor de Pseudomonas aeruginosa (fig. 7) şi Acinetobacter baumannii (fig. 8), ca patogeni responsabili, în
special, de infecţii dobândite în spital, o reprezintă nivelul înalt de rezistenţă
intrinsecă la antibiotice, în particular la b-lactami. În plus, este
recunoscută abilitatea acestor specii de a dobândi multiple mecanisme de
rezistenţă, în special enzimatice, frecvent acumulate în aceeaşi tulpină.
O caracteristică distinctivă a speciilor de Pseudomonas aeruginosa (fig. 7) şi Acinetobacter baumannii (fig. 8), ca patogeni responsabili, în
special, de infecţii dobândite în spital, o reprezintă nivelul înalt de rezistenţă
intrinsecă la antibiotice, în particular la b-lactami. În plus, este
recunoscută abilitatea acestor specii de a dobândi multiple mecanisme de
rezistenţă, în special enzimatice, frecvent acumulate în aceeaşi tulpină.
 Este nevoie de o implicare responsabilă a
tuturor factorilor: pacienţi (educaţie medicală, automedicaţie), medici (abuz,
subdozare, antibiotic administrat ca medicaţie antitermică în infecţii
virale), factori decizionali din agricultură şi industrie, în scopul păstrării
antibioticelor eficiente şi pentru generaţiile următoare.
Este nevoie de o implicare responsabilă a
tuturor factorilor: pacienţi (educaţie medicală, automedicaţie), medici (abuz,
subdozare, antibiotic administrat ca medicaţie antitermică în infecţii
virale), factori decizionali din agricultură şi industrie, în scopul păstrării
antibioticelor eficiente şi pentru generaţiile următoare.