
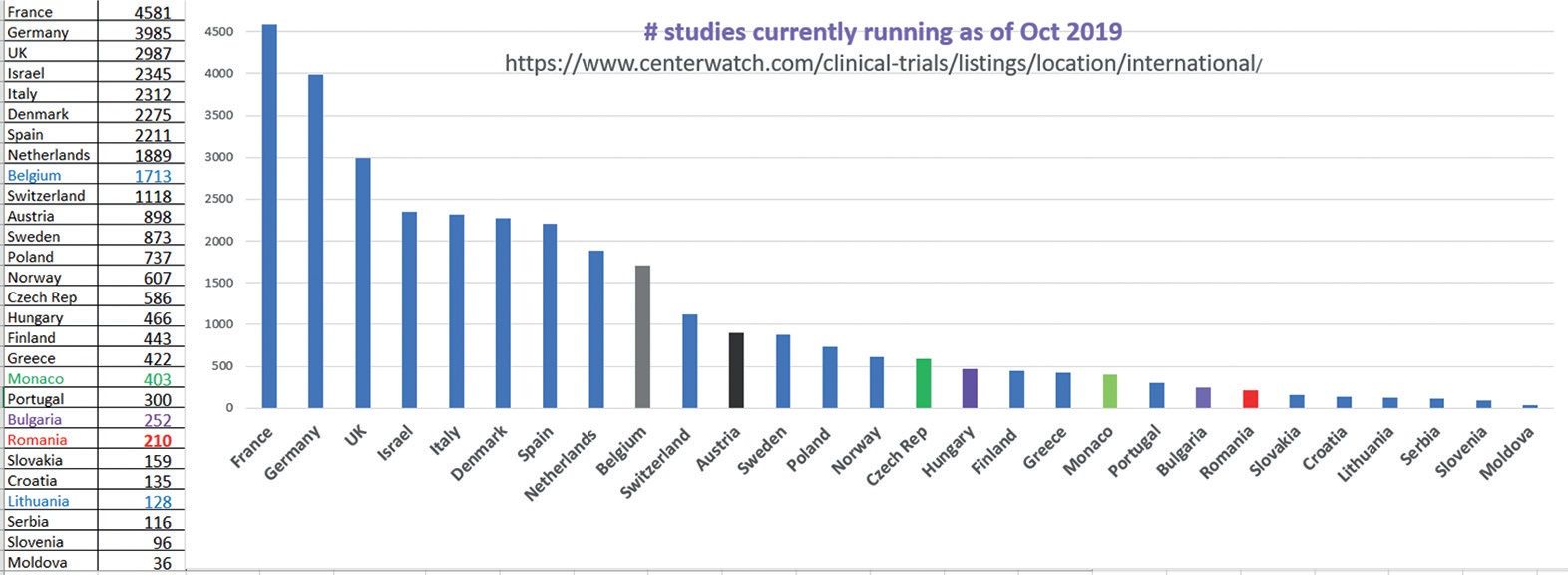
România se pregătește pentru implementarea noului regulament european privind studiile clinice.
Acesta prevede ca fiecare ţară membră UE să depună online, pe o platformă unică, documentaţia știinţifică a studiului clinic, rămânând ca la nivelul autorităţilor naţionale să fie depuse doar documentele centrelor medicale naţionale.
Procesul centralizat este menit să accelereze obţinerea aprobării. Cu prilejul unei întâlniri la București a experţilor în domeniu, am vorbit despre situaţia României în ceea ce privește studiile clinice cu dr. Cătălina Sârbu, directorul Asociaţiei Companiilor Conducătoare de Studii Clinice (CRO) din România (ACCSCR) și director de operaţiuni la PAREXEL, una dintre aceste CRO.

Cum stăm la capitolul „studii clinice”, care sunt punctele noastre tari?
Stăm foarte bine în ceea ce priveşte activitatea medicilor și calitatea datelor procurate de ei, sunt foarte conștiincioși. Și asta nu o spunem doar noi, care monitorizăm studiile, ci și inspecţiile autorităţilor internaţionale, chiar și inspecţiile FDA din SUA, ale căror rezultate sunt postate pe site-ul lor oficial. Oricine poate să vadă câte inspecţii în România au menţiunea „No action indicated” (n.r.: „Nu e nevoie de luarea vreunei măsuri”). Alt punct bun este disponibilitatea pacienţilor, dorinţa lor de a participa la studii clinice, fie și pentru că medicul are mai mult timp la dispoziţie decât într-o consultaţie obișnuită, în care 10 minute din 15 sunt ocupate cu accesarea site-ului Casei de Asigurări. În cadrul studiului, medicul este obligat să facă un consult amănunţit. Alt punct forte ar fi rapiditatea cu care ne mișcăm noi, organizatorii studiilor clinice; am observat că suntem foarte dedicaţi, ne mișcăm repede, producem documentele necesare, medicii răspund și ei.
Iar cele slabe?
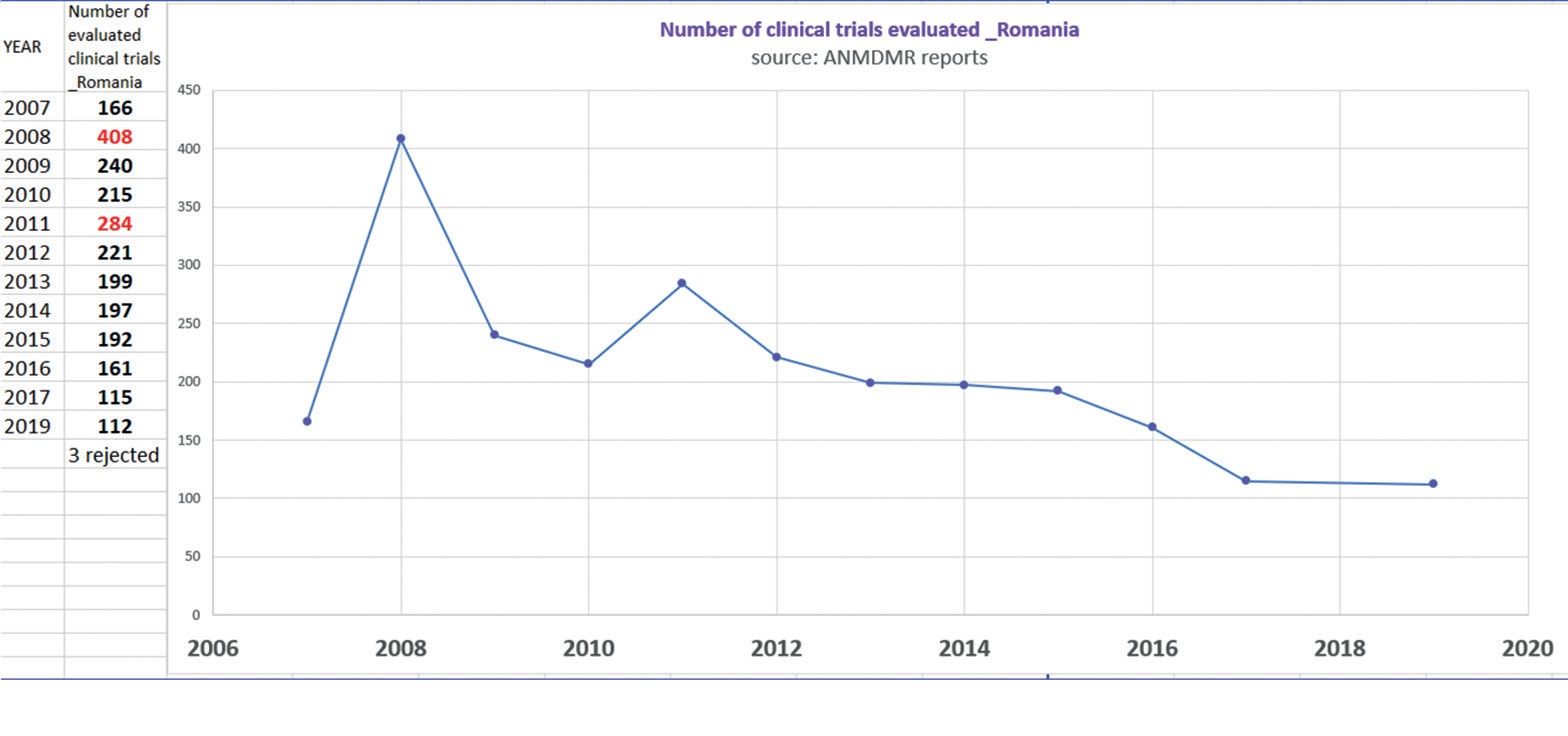
Punctele slabe sunt unul principal și câteva secundare. Cel principal este că evaluarea se face inadmisibil de încet. Legislaţia românească este perfect aliniată Directivei Europene, care spune că în maximum 60 de zile trebuie să se obţină opinia autorităţilor. Opinia Comisiei de Bioetică se obţine în 60 de zile. Opinia ANMDM... am ajuns să o obţinem în 430-470 de zile, când de obicei [studiul] nu mai este interesant, pentru că înrolarea s-a terminat de mult în acest moment.
Se are în vedere o rezolvare a acestui aspect?
Noua echipă ANMDM se luptă. Din păcate, au o listă mare de studii din trecut, dar eu nu știu de ce se mai obosesc cu ele, pentru că acele studii din trecut s-au terminat. Merg foarte greu cu evaluările studiilor care încă sunt în curs, iar înrolarea pacienţilor sau a subiecţilor se face competitiv între ţări și acest proces se termină până să ajungă studiul la evaluare și să primească aprobare în România. Sau se întâmplă că pacienţii români și medicii români mai au două săptămâni de înrolare și nu este posibil să lucrezi în felul acesta. Iar urmarea este că sponsorii studiilor clinice nu mai vor să vină în România, pentru că nu se încurcă cu o ţară cu un termen atât de mare de aprobare. China mai avea un termen mai lung, de 100 de zile, dar și-au revenit și ei.
Aţi menţionat că există și puncte slabe secundare.
De-a lungul anilor s-au adăugat tot felul de bariere în obţinerea aprobării și a participării la studiul clinic de către spitale și medici. Acestea nu există în alte ţări, pentru că acolo studiile clinice sunt dorite. Un exemplu este calificarea investigatorului – în alte ţări este suficient CV-ul, el este de competenţa comisiei de etică, nu a agenţiei de reglementare. La noi se cere și ordinul de intrare în specialitate, și anume cel dat de minister, nu cel comunicat de Facultatea de Medicină și Farmacie, dacă medicul este cadru universitar, angajat acolo. Deci nu îi credem pe medicii noștri că sunt specialiști. Nu îl credem pe profesorul ultracunoscut, care va trebui să obţină o anume adeverinţă. S-a introdus și autorizaţia centrelor pentru a face studii clinice. Nici asta nu există în alte părţi decât într-o formă mult mai ușoară, în Rusia și în Libia. Centrele trebuie să facă eforturi serioase, care sunt fără rost, cum ar fi, de exemplu, contract cu o unitate de urgenţă, ca și cum ar fi vreodată nevoie, căci pacienţii iau medicamentele acasă și, dacă au nevoie de asistenţă, apelează la cea mai apropiată instituţie. Mai sunt astfel de exemple, prin care ANMDM și-a adăugat sarcini și responsabilităţi, probabil din dorinţa de a asigura o calitate bună. Deși asta arată că nu urmează felul în care se desfășoară studiile în alte ţări ale UE.
Ce medici pot fi implicaţi în studii clinice?
Orice medic cu experienţă în specialitate de minimum trei ani poate fi implicat într-un studiu clinic.
Cum sunt aleși medicii care participă la studii clinice, cine are iniţiativa?
Noi avem baze de date cu medicii cu care am mai lucrat. În general, în cadrul studiului de fezabilitate sunt căutaţi medici de specialitatea respectivă. Îi mai rugăm pe medicii pe care deja îi cunoaștem și care sunt foarte conștiincioși să ne recomande colegi despre care ei cred că ar fi interesaţi să participe la studiile clinice.
Cum ajung la pacienţi informaţiile despre studiile clinice aflate în derulare?
Noi lucrăm împreună cu asociaţiile de pacienţi pentru ca ei să afle și să le comunice pacienţilor că există aceste studii și locul în care se desfășoară. Există site-ul european (clinicaltrialsregister.eu) și cel american (clinicaltrials.gov). De curând, ANMDM a pus pe site-ul agenţiei studiile aprobate de ei de când au început să lucreze în noua echipă. Acestui site îi lipsesc însă două chestiuni: data depunerii studiului și, mai important decât atât, lista centrelor, astfel încât pacienţii să-și găsească spitalul sau centrul unde se face studiul respectiv.
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe