Listeria monocytogenes determină două tipuri de sindroame clinice umane importante: toxiinfecţii alimentare şi infecţii sistemice (septicemii, meningoencefalite). Diagnosticul bacteriologic al acestora din urmă este detaliat, la rubrica In vitro, de dna dr. Maria Nica, dl prof. dr. Emanoil Ceauşu şi colab.

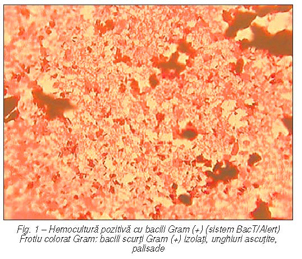
 luetică, virală etc.) şi neinfecţioasă (sarcoidoză, limfogranulomatoza Wegener etc.). Din supernatant LCR se efectuează: determinarea cantitativă a albuminorahiei (> 100 mg/dl), a glicorahiei (< 45 mg/dl) şi alte teste biochimice. Izolarea bacteriană în cultură se efectuează fie prin metoda clasică, folosind mediul de cultură Brain Heart Infusion (BHI) Agar cu 5–10% sânge de berbec, incubare 24–48 de ore, la 37°C, în atmosferă îmbogăţită cu 5% CO2 şi, în paralel, incubare la temperatura camerei (22°C) (fig. 4); sistemul automat BacT/Alert, cu incubare 7–14 zile. Identificarea bacteriană se realizează în sistem clasic, pe baza caracterelor culturale (colonii alb-gri, translucide, beta-hemolitice pe geloză sânge), microscopice (bacili scurţi Gram pozitivi, cu dispoziţie unghiulară, palisade – fig. 3), a proprietăţilor exoenzimatice. Listeria monocytogenes se caracterizează prin următoarele reacţii biochimice: producerea catalazei (+), hidroliza esculinei (+), test CAMP (+) (fig. 5), hidroliza hipuratului (+), testul oxidazei (–), nu reduce nitraţii, mobilitate la temperatura camerei (după 48 de ore de incubare, cu aspect particular de „umbrelă întoarsă“) şi imobilă la 37°C, dezvoltare la +4°C (la frigider, timp de şapte zile – metoda de îmbogăţire la rece). Identificarea în sistem automat se face cu galerii de identificare API Coryne cu citire automată în sistem ATB/Expression (bioMerieux) şi carduri de identificare bacterii Gram pozitive, sistem VITEK2C (bio/Merieux) (12, 13, 14).
luetică, virală etc.) şi neinfecţioasă (sarcoidoză, limfogranulomatoza Wegener etc.). Din supernatant LCR se efectuează: determinarea cantitativă a albuminorahiei (> 100 mg/dl), a glicorahiei (< 45 mg/dl) şi alte teste biochimice. Izolarea bacteriană în cultură se efectuează fie prin metoda clasică, folosind mediul de cultură Brain Heart Infusion (BHI) Agar cu 5–10% sânge de berbec, incubare 24–48 de ore, la 37°C, în atmosferă îmbogăţită cu 5% CO2 şi, în paralel, incubare la temperatura camerei (22°C) (fig. 4); sistemul automat BacT/Alert, cu incubare 7–14 zile. Identificarea bacteriană se realizează în sistem clasic, pe baza caracterelor culturale (colonii alb-gri, translucide, beta-hemolitice pe geloză sânge), microscopice (bacili scurţi Gram pozitivi, cu dispoziţie unghiulară, palisade – fig. 3), a proprietăţilor exoenzimatice. Listeria monocytogenes se caracterizează prin următoarele reacţii biochimice: producerea catalazei (+), hidroliza esculinei (+), test CAMP (+) (fig. 5), hidroliza hipuratului (+), testul oxidazei (–), nu reduce nitraţii, mobilitate la temperatura camerei (după 48 de ore de incubare, cu aspect particular de „umbrelă întoarsă“) şi imobilă la 37°C, dezvoltare la +4°C (la frigider, timp de şapte zile – metoda de îmbogăţire la rece). Identificarea în sistem automat se face cu galerii de identificare API Coryne cu citire automată în sistem ATB/Expression (bioMerieux) şi carduri de identificare bacterii Gram pozitive, sistem VITEK2C (bio/Merieux) (12, 13, 14).
 De obicei, testarea sensibilităţii la antibiotice se efectuează numai când se suspectează un eşec terapeutic, formă clinică gravă, alergie la penicilină a pacientului.
De obicei, testarea sensibilităţii la antibiotice se efectuează numai când se suspectează un eşec terapeutic, formă clinică gravă, alergie la penicilină a pacientului.Bibliografie
1. Farber JM, Peterkin PI. Listeria monocytogenes, a food-borne pathogen. Microbiol Rev. 1991 Sep;55(3):476-511
2. Feresu SB, Jones D. Taxonomic studies on Brochothrix, Erysipelothrix, Listeria and atypical lactobacilli. J Gen Microbiol. 1988 May;134(5):1165-83
3. Ludwig W, Schleifer KH, Whitman WB. Revised road map to the phylum Firmicutes. In De Vos P et al. (ed.), Bergey’s Manual of Systematic Bacteriology. 2nd ed., vol. 3. The Firmicutes. Springer- Verlag, 2009, New-York, NY
4. Boerlin P, Rocourt J, Grimont F, Grimont PAD, Jacquet C, Piffaretti JC. 1992. Listeria ivanovii subsp. londoniensis subsp. nov. Int. J. Syst. Bacteriol. 42: 69-73
5. Collins MD, Wallbanks S, Lane DJ, Shah J, Nietupski R, Smida J, Dorsch M, Stackebrandt E. Phylogenetic analysis of the genus Listeria based on reverse transcriptase sequencing of 16S rRNA. Int J Syst Bacteriol. 1991 Apr;41(2):240-6
6. McLauchlin J, Low JC. Primary cutaneous listeriosis in adults: an occupational disease of veterinarians and farmers. Vet Rec. 1994 Dec 24-31;135(26):615-7
7. Doganay M. Listeriosis: clinical presentation. FEMS Immunol Med Microbiol. 2003 Apr 1;35(3):173-5
8. Voetsch AC, Angulo FJ, Jones TF, Moore MR, Nadon C, McCarthy P, Shiferaw B, Megginson MB, Hurd S, Anderson BJ, Cronquist A, Vugia DJ, Medus C, Segler S, Graves LM, Hoekstra RM, Griffin PM; Centers for Disease Control and Prevention Emerging Infections Program Foodborne Diseases Active Surveillance Network Working Group. Reduction in the incidence of invasive listeriosis in foodborne diseases active surveillance network sites, 1996-2003. Clin Infect Dis. 2007 Feb 15;44(4):513-20
9. Cairns BJ, Payne RJ. Sudden increases in listeriosis rates in England and Wales, 2001 and 2003. Emerg Infect Dis. 2009 Mar;15(3):465-8
10. Goulet V, Hedberg C, Le Monnier A, de Valk H. Increasing incidence of listeriosis in France and other European countries. Emerg Infect Dis. 2008 May;14(5):734-40
11. Gerner-Smidt P, Hise K, Kincaid J, Hunter S, Rolando S, Hyytiä-Trees E, Ribot EM, Swaminathan B; Pulsenet Taskforce. PulseNet USA: a five-year update. Foodborne Pathog Dis. 2006 Spring;3(1):9-19
12. Gasanov U, Hughes D, Hansbro PM. Methods for the isolation and identification of Listeria spp. and Listeria monocytogenes: a review. FEMS Microbiol Rev. 2005 Nov;29(5):851-75
13. Funke G, Renaud FN, Freney J, Riegel P. Multicenter evaluation of the updated and extended API (RAPID) Coryne database 2.0. J Clin Microbiol. 1997 Dec;35(12):3122-6
14. Odumeru JA, Steele M, Fruhner L, Larkin C, Jiang J, Mann E, McNab WB. Evaluation of accuracy and repeatability of identification of food-borne pathogens by automated bacterial identification systems. J Clin Microbiol. 1999 Apr;37(4):944-9
15. Grayo S, Join-Lambert O, Desroches MC, Le Monnier A. Comparison of the in vitro efficacies of moxifloxacin and amoxicillin against Listeria monocytogenes. Antimicrob Agents Chemother. 2008 May;52(5):1697-702
16. Vitas AI, Sánchez RM, Aguado V, García-Jalón I. Antimicrobial susceptibility of Listeria monocytogenes isolated from food and clinical cases in Navarra, Spain. J Food Prot. 2007 Oct;70(10):2402-6
17. Hadorn K, Hächler H, Schaffner A, Kayser FH. Genetic characterization of plasmid-encoded multiple antibiotic resistance in a strain of Listeria monocytogenes causing endocarditis. Eur J Clin Microbiol Infect Dis. 1993 Dec;12(12):928-37
18. Hof H. An update on the medical management of listeriosis. Expert Opin Pharmacother. 2004 Aug;5(8):1727-35
19. Salas C, Calvo J, Martínez-Martínez L. Activity of Tigecycline against Coryneform Bacteria of Clinical Interest and Listeria monocytogenes. Antimicrob Agents Chemother. 2008 Apr;52(4):1503-5
20. Streit JM, Jones RN, Sader HS. Daptomycin activity and spectrum: a worldwide sample of 6737 clinical Gram-positive organisms. J Antimicrob Chemother. 2004 Apr;53(4):669-74
21. Troxler R, von Graevenitz A, Funke G, Wiedemann B, Stock I. Natural antibiotic susceptibility of Listeria species: L. grayi, L. innocua, L. ivanovii, L. monocytogenes, L. seeligeri and L. welshimeri strains. Clin Microbiol Infect. 2000 Oct;6(10):525-35
22. Piper KE, Steckelberg JM, Patel R. In vitro activity of daptomycin against clinical isolates of Gram-positive bacteria. J Infect Chemother. 2005 Aug;11(4):207-9
23. Wellinghausen N. Listeria and Erysipelothrix. Manual of Clinical Microbiology, 10th Edition. 2011.
Vol. 1. pp. 403-412
24. Clinical and Laboratory Standards Institute (CLSI). Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated and fastidious bacteria. Approved guideline M45-A2. 2010. Clinical and Laboratory Standards Institute, Wayne, PA
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe