Stabilirea indicelui de prezenţă a sarcopeniei, în cazul pacienţilor oncologici, ar trebui să fie obligatorie. Astfel, multe cheltuieli și speranţe ar putea fi economisite, iar resursele ar fi folosite raţional.
Amplul reportaj publicat în „Viaţa Medicală” nr. 3 din 20 ianuarie a.c. a tratat un subiect de o importanţă covârșitoare pentru pacienţii incurabili, și anume paliaţia. Din cele relatate de Mălina Dumitrescu (HOSPICE Casa Speranţei) se vede clar că, în România, îngrijirea paliativă este înţeleasă parţial, fiind considerată o îngrijire acordată în ultimele zile sau săptămâni de viaţă: „Este un lucru pe care publicul ar trebui să-l înţeleagă: poţi face multe lucruri pentru calitatea vieţii pacientului și familiei, chiar și atunci când vindecarea nu e posibilă”.
Organizaţia Mondială a Sănătăţii consideră îngrijirea paliativă ca fiind un drept al omului, iar nerespectarea lui înseamnă vătămare corporală – malpraxis. Practic, la pacientul oncologic paliaţia începe odată cu apariţia recidivei tumorale sau a primei metastaze la distanţă și nu este specifică numai ultimei perioade a vieţii.
Pacienţii oncologici sunt în general subnutriţi. Studiul efectuat de grupul condus de Nicole Erickson în 2018 a evidenţiat că malnutriţia este prezentă la mai mult de jumătate dintre acești pacienţi (1). Nutriţia are un rol esenţial și determinant în tolerarea și acceptarea terapiei, în răspunsul la terapie, în calitatea vieţii pacientului. La pacienţii cu o stare nutriţională adecvată efectele secundare la terapia aplicată sunt reduse, la fel și recidivele tumorale. De aceea, se impune stabilirea statusului nutriţional încă de la luarea în evidenţa unui serviciu oncologic, prin efectuarea așa-numitului Mini Nutritional Assessment (MNA).
Pentru aceasta, se face o determinare a compoziţiei corpului prin bioimpedanţă (BIA) (Figura 1). Se determină astfel valoarea cantitativă a componentelor importante ale corpului: masa musculară, grăsimea și apa (intra- și extracelulară), precum și repartizarea acestora în corp. Coroborând aceste valori cu indicele de masă corporală (BMI), se determină starea nutriţională la acel moment a pacientului.
Iniţierea oricărei terapii la un pacient oncologic poate induce efecte secundare, precum inapetenţă, modificare a gustului, a mirosului etc. Dacă este prezentă și componenta psihică sau/și durerile produse de tumora primară, de metastaze sau chiar de terapie (candidoză orală și esofagită), atunci nutriţia pacientului va fi direct afectată, consecinţa fiind reducerea aportului nutriţional. Acesta este doar începutul unei pierderi accelerate în greutate. În plus, multiplele procese inflamatorii induse de prezenţa tumorii (efecte paraneoplazice) afectează și ele pierderea în greutate (Figura 2). Pe de altă parte, pacientul oncologic reduce mult și exerciţiul fizic, ceea ce face ca masa musculară să scadă. Dacă mai este și în vârstă, această pierdere este mult accentuată.
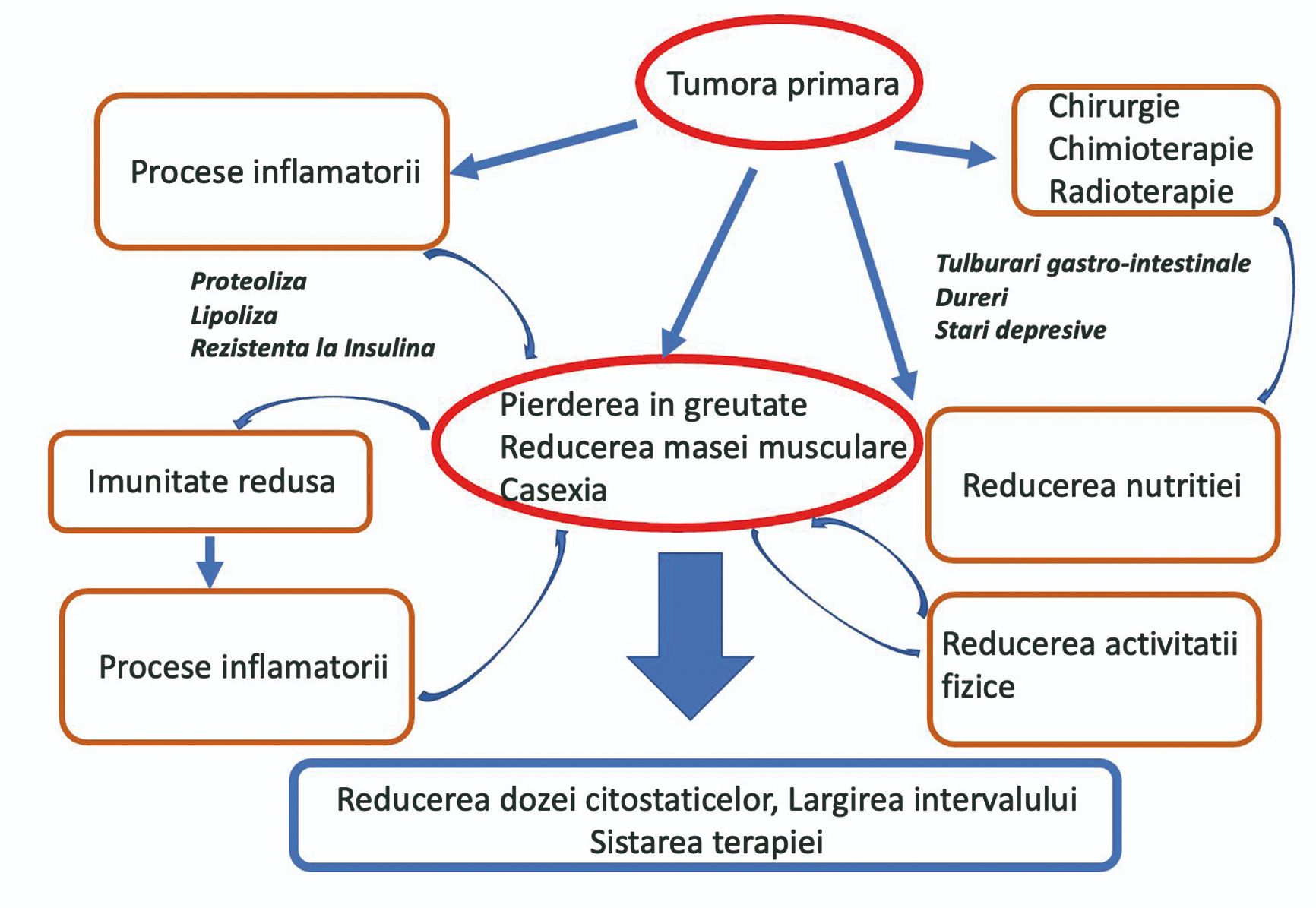
Pierderea masei musculare îi accentuează pacientului fatigabilitatea, astenia și îi induce o stare depresivă care favorizează apariţia cașexiei. Dacă acest proces nu este recunoscut și diagnosticat din timp și nu se iniţiază măsuri paliative (determinarea BIA, nutriţie, îmbunătăţirea mobilităţii, combaterea inflamaţiilor), pacientul poate aluneca către o fază posibil ireversibilă, conducând implicit la moarte prematură. De aceea, considerăm că este imperativ necesar ca centrele de îngrijiri paliative să aibă posibilitatea de măsurare a bioimpedanţei. Fără rezultatul acestor măsurători, prezenţa nutriţionistului într-o clinică oncologică nu este sustenabilă, ea poate fi chiar inutilă, aducând un deserviciu pacientului.
Vârsta metabolică este influenţată în principal de proporţia de grăsime și de starea de hidratare a organismului. Dacă se consideră și masa musculară prezentă, atunci un raport optimal al acestor trei componente determină vârsta metabolică. La pacientul oncologic cu deficit nutriţional, cu pierdere a grăsimii și reducere a masei musculare, este greu de stabilit acest parametru, care la rândul său să reflecte acel potenţial biologic ce-l face apt pentru terapia stabilită (chimioterapie, imunoterapie,
chirurgie, radioterapie etc.).
În chirurgia generală și în transplantul de organe, investigarea statusului nutriţional este obligatorie. Fără această evaluare, pacientul nu este programat pentru operaţie. La cei cu deficit nutriţional se începe un program de nutriţie, pentru îmbunătăţirea stării generale și reducerea riscurilor operatorii. De ce în oncologie nu se face această evaluare? Procedura aceasta simplă ar crea posibilitatea selecţionării acelor pacienţi care chiar ar profita de terapia indicată.
Pacientul oncologic cu o pierdere în greutate de cinci kilograme, fără rezerve de grăsime și cu masă musculară mult sub normal, intră în zona sarcopeniei, adică se află foarte aproape de apariţia cașexiei. Cașexia este determinată atât de inflamaţie, cât și de apetitul redus. Dacă mai este asociată și cu o activitate fizică redusă, toleranţa la tratamentul oncologic va fi mult mai scăzută. Cât va profita un asemenea pacient de imunoterapie când imunitatea lui este grav afectată de procesele inflamatorii secundare deja prezente și de starea de nutriţie deficitară?
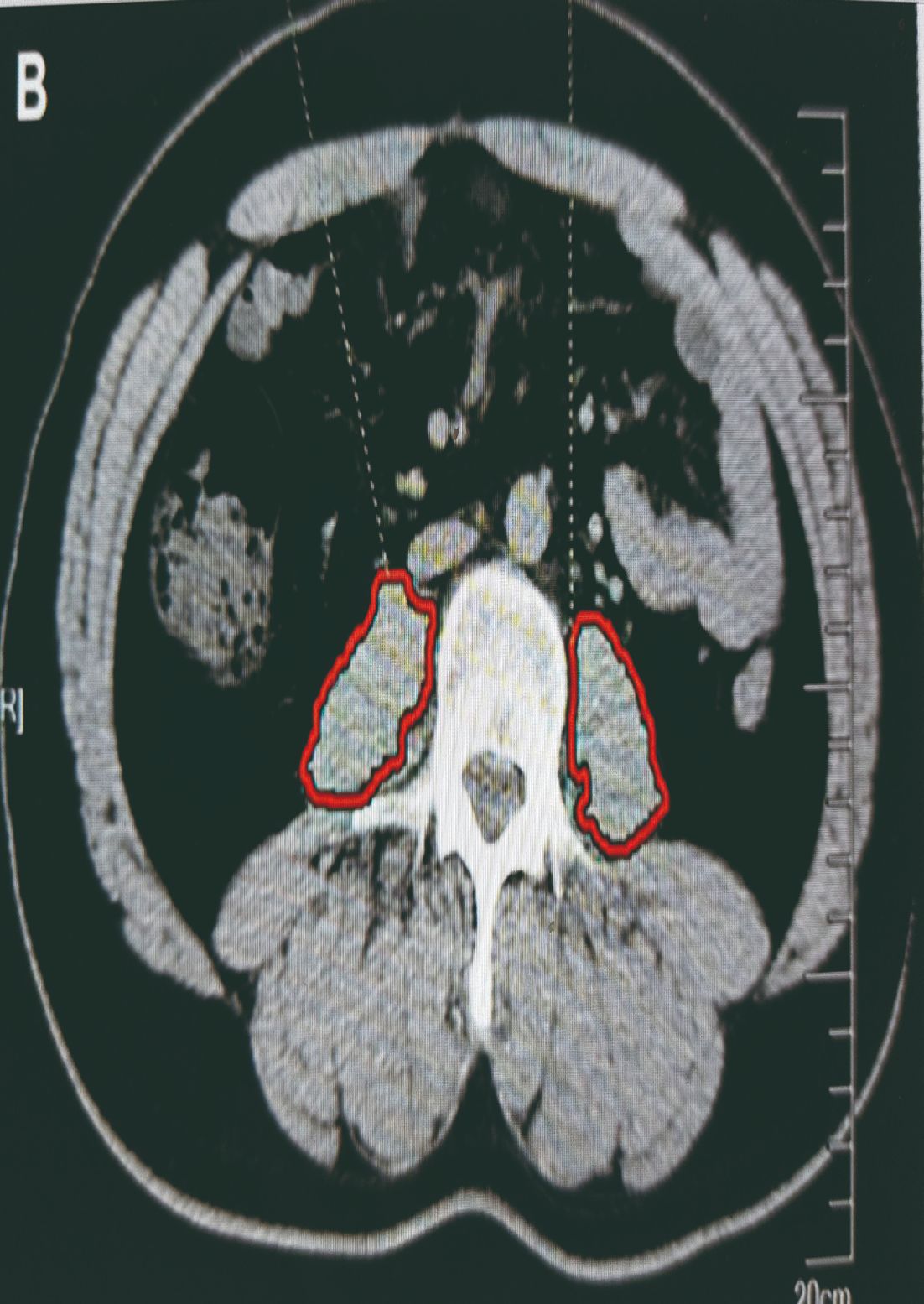
Starea de nutriţie și în special pierderea masei musculare sunt apreciate de un parametru nou numit indice sarcopenic. Există mai multe metode de determinare a acestui indice. Cel mai frecvent utilizată la evaluarea pacientului chirurgical este aprecierea stării masei musculare a mușchiului psoas la nivelul celei de-a treia vertebre lombare (Figura 3).

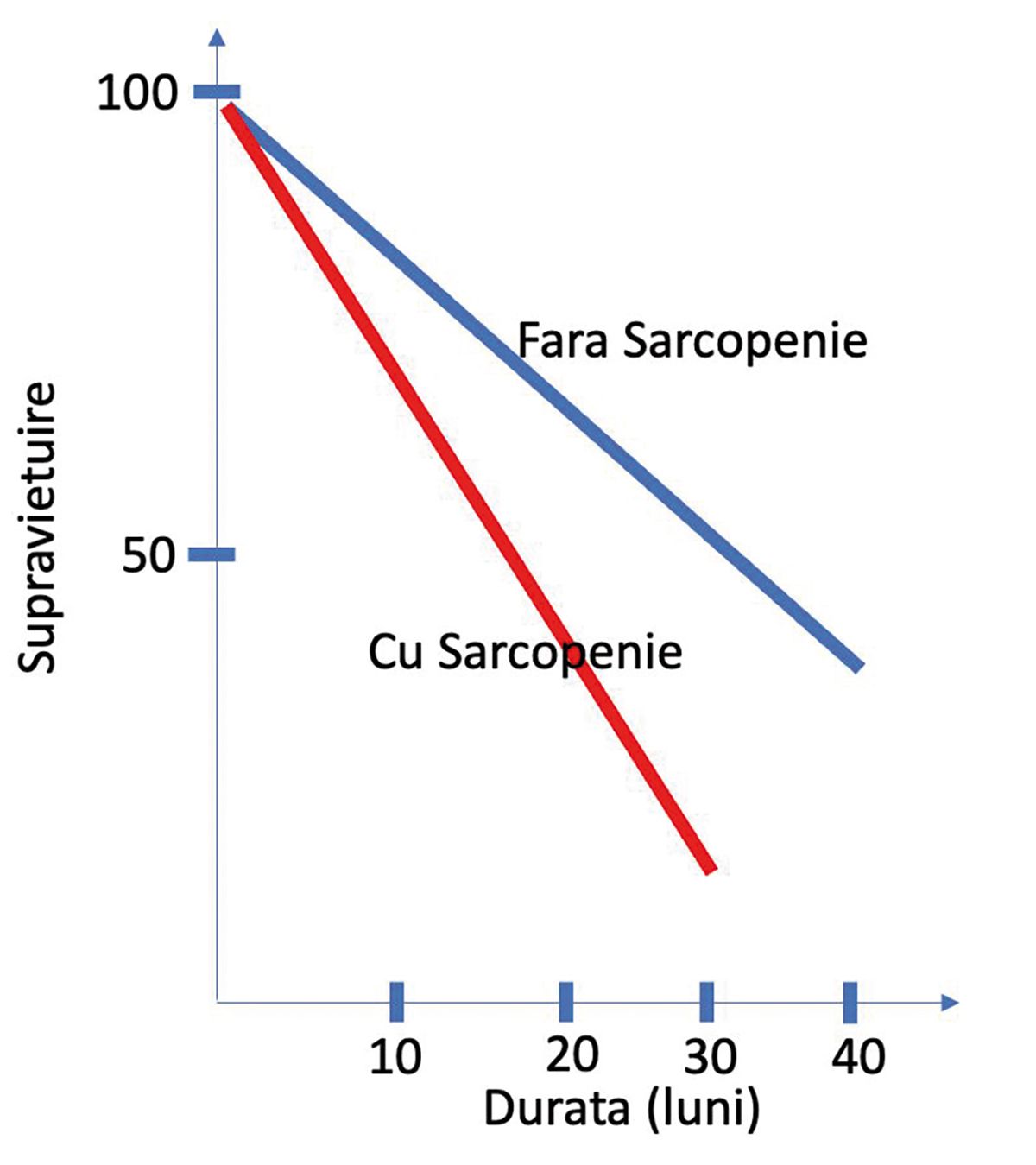
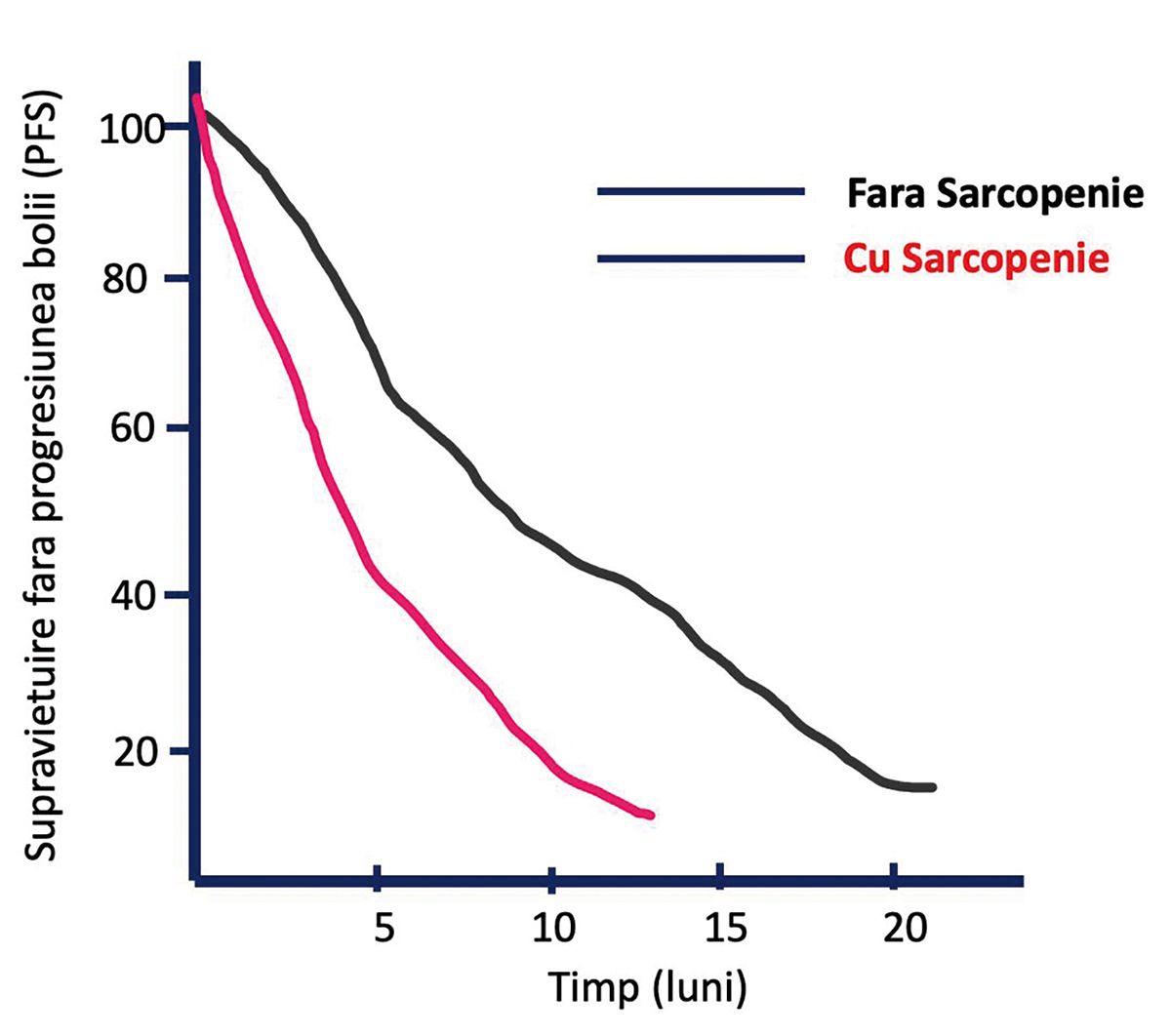
Prado MM și colaboratorii au publicat în Lancet Oncology rezultatele unui studiu în care a fost semnalată dependenţa supravieţuirii pacienţilor oncologici (tumori gastrointestinale și pulmonare) de starea lor de nutriţie (2). În lipsa sarcopeniei, pacienţii au supravieţuit mult mai mult decât cei la care apăruse sarcopenia (Figura 4). Apariţia sarcopeniei este un proces insidios care scapă ușor observaţiei pacientului, rudelor sale și a personalului medical. Anorexia și lipsa activităţii fizice reprezintă cadrul ideal în care acest proces este accelerat.
Takayuki Shiroyama și echipa sa au investigat, la pacienţii cu cancer pulmonar (non-small cell), efectul terapiei cu inhibitori PD-1 (3). Impactul prezenţei sarcopeniei asupra răspunsului la terapia cu nivolumab sau pembrolizumab a fost statistic semnificativ diferită (p=0,004). Prevalenţa sarcopeniei a fost asociată cu un răspuns redus la terapie (Figura 5).
Bibliografie
1. https://www.ernaehrungs-umschau.de/fileadmin/Ernaehrungs-Umschau/pdfs/pdf_2018/12_18/EU12_2018_M686_M694.pdf
2. Lancet Oncol 2008; 9(7): 629-35
3. Sci Rep 2019; 9:2447
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe