Prezentarea cazului
Un pacient în vârstă de 55 ani este adus de
ambulanță la 75 de minute după instalarea bruscă, la domiciliu, a unui deficit
motor în hemicorpul stâng. Un examen neurologic rapid pune în evidență
hemiplegie stângă, pareză facială stângă centrală, hemianestezie superficială
stângă, hemianopsie homonimă stângă, hemineglijență stângă și disartrie. Scorul
NIHSS este estimat la 19. După recoltarea de sânge este transportat de urgență
la IRM.
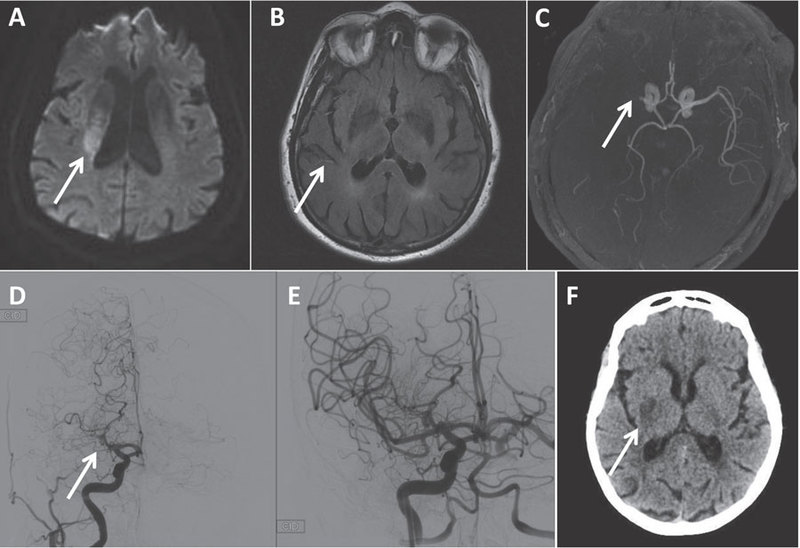
În figura alăturată, imaginile A–C ilustrează IRM cerebral
realizat la 90 de minute de la debutul simptomelor. O ischemie ireversibilă de
mici dimensiuni în nucleii bazali este vizualizată în secvența de difuzie (A).
În secvența FLAIR (B), există o multitudine de vase în hipersemnal în insula
dreaptă, datorită fluxului lent retrograd în ramurile distale de ocluzie. Acest
flux retrograd reprezintă circulația colaterală prin anastomozele piale cu
celelalte vase intracraniene (artera cerebrală anterioară și posterioară).
Colateralitatea pială reprezintă substratul fiziopatologic prin care se poate
menține temporar viabilitatea parenchimului cerebral. În secvența TOF este
vizualizată o ocluzie de arteră cerebrală medie (ACM) dreaptă (C).
Indicația de tratament de revascularizare este stabilită luând
în considerare datele clinice și imagistice. Clinic, pacientul prezintă un
sindrom deficitar sever care exprimă suferința parenchimului cerebral din
întregul teritoriu al ACM. Imagistic, se vizualizează o zonă de ischemie
ireversibilă de dimensiuni foarte mici. Comparația simptomelor clinice cu
datele imagistice ne permite să stabilim o neconcordanță semnificativă între
teritoriul deja necrozat și teritoriul cerebral care produce simptome – mismatchclinic-radiologic. Această neconcordanță este expresia indirectă a unei
penumbre ischemice voluminoase și deci cazul are o indicație excelentă de
revascularizare.
Se inițiază tratamentul trombolitic intravenos cu alteplază la
două ore de la debut. Ținând cont de rata de recanalizare relativ scăzută a
tratamentului intravenos în cazul ocluziilor arteriale proximale, pacientul
este transferat imediat în sala de angiografie pentru tratament complementar
prin trombectomie mecanică.
Imaginile D și E din figura alăturată sunt din
timpul trombectomiei. Ocluzia de arteră cerebrală medie (D) este recanalizată
după un pasaj de stent-retriever (E). Procedura durează 35 de minute și este
realizată sub anestezie generală din cauza lipsei de cooperare din partea
pacientului.
După o perioadă de supraveghere în reanimare de 24 de ore,
pacientul este transferat în serviciul de neurologie. La o zi după intervenție,
se observă o ameliorare semnificativă a simptomelor neurologice. Persistă doar
un deficit parțial în hemicorpul drept și disartrie (scor NIHSS 5). CT cerebral
de control la 24 de ore (imaginea F) demonstrează o mică zonă de infarct în
nucleii bazali care corespunde leziunii de ischemie ireversibilă vizualizată pe
IRM inițial. Leziunea nu s-a extins, tot teritoriul arterei cerebrale medii a
fost salvat.
Urmând protocolul uzual pentru pacienții cu accident vascular
cerebral (AVC) ischemic, sunt efectuate investigații pentru a stabili etiologia
AVC. Acestea cuprind analize de sânge, ecografie Doppler carotidiană, ecografie
cardiacă transtoracică/transesofagiană, ECG și monitorizare ECG 24 de ore. În
cazul prezentat, sunt identificate multiple episoade de fibrilație atrială
paroxistică.
În fața unui AVC ischemic de origine cardioembolică, terapia de
prevenție secundară este stabilită folosind scorul de risc de recurență CHADS2-VASc
și scorul de risc hemoragic HAS-BLED. În cazul prezentat, scorul CHADS2-VASc
este 3 (AVC și HTA), echivalent cu un risc teoretic de recurență de AVC de 3,2%
pe an în lipsa tratamentului. Scorul HAS-BLED este 2 (AVC și HTA), echivalent
cu un risc hemoragic teoretic de 4,1%.
Având în vedere dimensiunile mici ale infarctului, la patru zile
după eveniment se inițiază terapia anticoagulantă cu apixaban. Pacientul se
externează fără deficit neurologic la șapte zile de la AVC.
Discuții
Până în anii ʼ90, tratamentul AVC ischemic s-a rezumat la
prevenția secundară. Un număr ridicat de substanțe neuroprotectoare cu efecte
promițătoare în modele experimentale animale au fost testate în studii clinice,
însă nu au reușit să demonstreze un beneficiu clinic. Anul 1995 a marcat un
moment major prin introducerea trombolizei intravenoase.
Alteplaza este o substanță administrabilă pe cale intravenoasă,
care activează plasminogenul tisular. Acesta se transformă în plasmină care
lizează punțile de fibrină din trombi ducând la recanalizarea arterei
obstruate. În 1995, după o serie de alte studii cu rezultate negative, studiul
pivotal NINDS (1) a marcat intrarea în practica clinică a tratamentelor de
recanalizare în faza acută, confirmând beneficiul alteplazei administrate
intravenos în primele trei ore de la debutul simptomelor neurologice. În 2008,
13 ani mai târziu, rezultatele studiului european ECASS 3 (2) au extins
indicația de tratament până la 4,5 ore. Ulterior, aceste beneficii au fost
confirmate în metaaanalize și registre prospective pe un număr ridicat de
pacienți (3, 4). În 2012, studiul IST-3 (5) a sugerat un beneficiu pentru
tromboliza până la șase ore de la debut, inclusiv la pacienții peste 80 de ani.
La administrarea trombolizei intravenoase, numărul de pacienți
tratați necesar pentru evitarea unui deces sau unei invalidități (NNT – number
needed to treat) este de 3,5 la 0–90 de minute de la debut, 11 la 90–180 de
minute și 13 la 180–270 de minute. Cu cât tratamentul este administrat mai
rapid, cu atât mai mare este șansa de recuperare a deficitului neurologic.
În prezent, date fiind contraindicațiile și fereastra
terapeutică îngustă, mai puțin de 10–15% din pacienții cu AVC ischemic
beneficiază de tratament trombolitic intravenos. Tromboliza intravenoasă are
eficacitate relativ scăzută în cazurile de AVC sever, unde un tromb de
dimensiuni mari blochează o arteră de calibru important (artera carotidă
internă, artera cerebrală medie, trunchiul bazilar). Mai multe studii au arătat
că substanța trombolitică nu reușește de obicei să dizolve trombii de
dimensiuni mari (6). Pe de altă parte, acești pacienți prezintă și zone mai
extinse de infarct, făcându-i astfel mai predispuși la complicații după
tratamentul trombolitic (sângerare în zona de infarct cerebral). Din aceste
motive, în paralel cu implementarea trombolizei intravenoase, a existat un
interes în creștere pentru dezvoltarea unor tratamente de recanalizare pe cale
endovasculară, adresate pacienților cu AVC sever cauzat de ocluzii de
trunchiuri arteriale proximale.
La exact două decenii după studiul NINDS, la începutul anului
2015, nu mai puțin de cinci studii randomizate (7–11) arată beneficiul net al
trombectomiei asociate trombolizei intravenoase, comparativ cu tromboliza
intravenoasă singură. Tratamentul endovascular poate fi administrat până la
șase ore de la debutul simptomelor neurologice. Numărul de pacienți tratați
necesar pentru evitarea unui deces sau a unei invalidități (NNT) este între
patru și șapte, în funcție de modalitatea de selecție imagistică. Prin
comparație, în infarctul miocardic acut, numărul de pacienți tratați prin
angioplastie percutană pentru a evita un deces/reinfarct/AVC este de 17 (12).
În plus, datele extrase din studiile de tratament endovascular
au permis o mai bună înțelegere a evoluției infarctului cerebral în faza acută.
Fereastra de timp a fost extinsă la șase, opt sau chiar douăsprezece ore
într-unul din studii. Sintagma Time is brain, emisă acum 20 de ani,
rămâne la fel de actuală și în prezent – pacienții trebuie tratați cât mai
repede după debutul simptomelor neurologice. Noile metode de imagistică
cerebrală fac posibilă individualizarea tratamentului în funcție de situația
fiecărui pacient în parte.
Este acum evident că după ocluzia unei artere cerebrale, necroza
parenchimului cerebral nu este un proces liniar care se consumă invariabil în
trei sau șase ore. Dimpotrivă, acest proces este foarte variabil de la un
pacient la altul și depinde în mare măsură de prezența sau absența unei
circulații colaterale piale adecvate. Acest fenomen face sau nu posibilă
vascularizarea teritoriului lipsit de sânge, prin intermediul unor căi
alternative (colaterale). Astfel, pacienții cu circulație colaterală bună își
pot menține timp îndelungat viabilitatea țesutului cerebral ischemiat și astfel
sunt candidați excelenți la terapii de reperfuzie până la 12 ore de la debutul
simptomelor sau poate chiar mai târziu. Identificarea acestor pacienți este
posibilă numai cu ajutorul noilor modalități de imagistică cerebrală.
Selecția imagistică a pacienților cu infarct cerebral acut se
poate face folosind fie computer-tomograful (CT), fie imagistica prin rezonanță
magnetică (IRM). Protocolul CT trebuie să cuprindă CT cerebral nativ,
angiografie CT de trunchiuri supra-aortice și, eventual, CT de perfuzie
cerebral. Protocolul IRM trebuie sa cuprindă secvențe de difuzie, secvențe
parenchimatoase și secvențe vasculare (angio-IRM), cu sau fără IRM de perfuzie
cerebral. IRM oferă informații net superioare, însă nu este disponibil nonstop
în toate centrele, iar investigația durează mai mult. CT este rapid, mai
adecvat pentru pacienți agitați și este larg disponibil în toate spitalele de urgență.
Oricare ar fi modalitatea aleasă, obiectivele sunt aceleași: excluderea
diagnosticelor alternative, vizualizarea ocluziei arteriale, selecția
pacienților cu zona de ischemie ireversibilă mică (zonă deja distrusă) și cu
zonă de penumbră ischemică prezentă (zonă de creier care suferă însă nu este
încă distrusă). Astfel, folosind IRM sau CT multimodal, se pot selecționa
pacienții la care există încă țesut cerebral care poate fi salvat, chiar și
după șase ore de la debutul simptomelor neurologice.
Terapia cu antivitaminice K este standardul de terapie pentru
pacienții cu fibrilație atrială, obținând o scădere de 65% a riscului de AVC
(13). În ultimii ani au apărut noi medicamente care aparțin clasei de
medicamente denumite anticoagulante orale de nouă generație – non-antagoniști
ai vitaminei K (NOAC). Aceste medicamente sunt fie inhibitori direct de
trombină (dabigatranul), fie antagoniști ai factorului Xa (rivaroxabanul,
apixabanul, endoxabanul). Aceste medicamente reprezintă o alternativă la tratamentul
clasic cu acenocumarol, care este asociat cu o serie de probleme în practica
clinică curentă: necesitatea unei monitorizări regulate prin analize sanguine
și variabilitatea marcată a răspunsului biologic. Este estimat că pacienții
petrec mai puțin de 60% din timp în intervalul INR țintă, chiar și în cadrul
unei supravegheri biologice stricte.
NOAC se administrează de asemenea pe cale orală și au avantajul
major de a nu necesita supraveghere biologică regulată. O serie de studii au
arătat că eficacitatea acestor preparate în prevenția AVC ischemic la pacienții
cu fibrilație atrială non-valvulară este similară sau mai bună decât cea a
antivitaminicelor K, cu un risc similar sau mai mic de complicații hemoragice
majore (14–17). În plus, o metaanaliză recentă a arătat că, în comparație cu
warfarina, pacienții tratați cu NOAC au mortalitate generală și cardiovasculară
semnificativ mai mică, asociată cu scădere de 50% a riscului de hemoragie
intracraniană și o reducere absolută de 0,5% pe an a riscului de hemoragie
majoră (18). Din aceste motive, NOAC sunt din ce în ce mai mult utilizate
pentru prevenția secundară a AVC cardioembolic.
În contrapartidă, deși a fost demonstrat că evenimentele
hemoragice survin mai rar în caz de hemoragie sub tratament cu NOAC, managementul
pacientului este dificil. Pentru moment nu este disponibil un antidot specific,
iar dozarea răspunsului biologic nu se poate face utilizând analizele de
laborator uzuale. Un studiu recent publicat arată totuși că mortalitatea în
hemoragia intracraniană sub NOAC nu este semnificativ mai mare (19), iar o
serie de substanțe antidot sunt în prezent în diferite faze de validare
clinică.
Concluzii
Cazul prezentat este ilustrativ pentru progresele înregistrate
în ultimii ani în tratamentul AVC ischemic. Pentru a putea asigura
implementarea noilor standarde, este necesară crearea și dezvoltarea de unități
neurovasculare care să acopere întregul teritoriu al țării. Investiția în
activitatea acestor centre și în noile preparate medicamentoase disponibile se
va traduce pe termen lung într-o reducere semnificativă a costurilor asociate
susținerii medicale și sociale a pacienților cu sechele neurologice permanente
invalidante.