Cancerul tiroidian este o
afecțiune din ce în ce mai des întâlnită în populația din întreaga lume. De
aceea, anual, la reuniunile medicale de endocrinologie îi sunt dedicate sesiuni
întregi de prezentare, unde se discută noutățile în ceea ce privește
mecanismele etiologice, diagnosticul paraclinic și metodele terapeutice ale
acestui tip de cancer.
Recent, a avut loc Congresul
european de endocrinologie, la München, unde s-au prezentat date și descoperiri
interesante despre cancerul tiroidian. Congresul a debutat cu un curs de
ecografie tiroidiană, examen considerat în prezent cel mai sensibil în
deciderea diagnosticului și tratamentului unui nodul tiroidian. Prof. dr. Furio
Pacini, una dintre personalitățile internaționale în patologia endocrină și
membru al grupului de la clinica Mayo, care a reactualizat în 2015 ghidurile
pentru cancerul tiroidian, a participat activ la această reuniune.
Și în România s-a organizat la
sfârșitul anului trecut un congres important de endocrinologie – ultimul
Chapter al Asociației americane a endocrinologilor clincieni, unde patologia
tiroidiană a fost intens discutată. Prof. dr. Cătălina Poiană și prof. dr.
Gharib Hossein (fost președinte al Asociației americane pentru glanda tiroidă)
au coordonat evenimentul.
Poluarea industrială sau radioactivitatea?
Prevalența cancerului tiroidian a
explodat după anul 1986, în urma accidentului de la Cernobîl. Numărul de cazuri
a crescut inclusiv în Statele Unite ale Americii, unde norul radioactiv nu a
ajuns. Cu toate acestea, statisticile internaționale se raportează la cazurile
din SUA, care sunt cele mai bine documentate, și la accidentul nuclear.
Totuși, de ce se raportează
Europa la aceste date nu știm. Chiar și în județele din Moldova, unde se pare
că radioactivitatea post-Cernobîl a fost mai mare decât în alte părți ale
țării, cancerul nediferențiat a avut o evoluție ondulatorie, cu creșteri
anterioare anului 1986 și descreșteri după 1990 (în aceste situaţii, cauza a
fost mai degrabă poluarea industrială, nu radioactivitatea).
Să nu uităm că în anul 1986, în
Statele Unite au apărut primele ecografe cu achiziție B, folosibile cu sondă
liniară pentru tiroidă. Astfel, putem deduce că incidența și prevalența
cancerului tiroidian nu au legătură cu radioactivitatea, ci cu apariția
ecografiei de tiroidă, în anul 1986. În plus, endocrinologul Juan P. Brito de
la clinica Mayo afirmă într-un articol din 2014 (1) că incidența
cancerului tiroidian a crescut și din cauza modernizării secțiilor de chirurgie
tiroidiană, unde se intervine agresiv într-un eventual cancer de tiroidă și, ca
urmare a operațiilor, se efectuează mult mai multe analize histopatologice. De
aici vine și ideea că prevalența cancerului tiroidian ține de capacitatea de a
face analize histopatologice. Totuși, apare următoarea problemă: când trebuie
efectuată puncția biopsie cu ac fin (fine needle aspiration – FNA) și
dacă FNA patologică trebuie să conducă la operație.
Factorii clinici de risc malign
Înainte de a trece la elemente
paraclinice (ecografie, anatomie patologică), este bine să reamintim factorii
care au fost identificați a fi „de risc“ de malignitate pentru un nodul
tiroidian. Aceștia sunt: istoricul de iradiere la nivelul gâtului, istoric
familial de MEN2 sau cancer medular tiroidian și creșterea rapidă a unui nodul
observabil la trei luni (creșterea trebuie apreciată ecografic și să fie de
minimum 3 mm, la același aparat, cu același observator). De asemenea, alți
factori de risc sunt nodulii extrem de fermi și/sau ficși, paralizia de corzi
vocale, adenopatia cervicală și apariția unui singur nodul (nodul solitar) la
un bărbat (2).
Paralizia de corzi vocale și
adenopatia cervicală vizibilă clinic sunt caracteristice tumorilor anaplastice.
În ultimul deceniu, prevalența acestora a scăzut până la 1% din totalul
neoplaziilor tiroidiene. De exemplu, în SUA, numărul de cazuri existente a
scăzut de la 47% în 1964 (3) la 20% în 1985 (4). În România, de la aproximativ
15% în 1978 (5) sau 20–25% în 1987 (6), prevalența tumorilor anaplastice a
scăzut la aproximativ 3,5% (7).
Se admite că prezența unui nodul
tiroidian la un pacient dintr-o regiune cu necesar de iod adecvat sau în
surplus sugerează, dacă este cancer, forme ușoare sau blânde de evoluție (2).
Ca o contrazicere a acestei
aserțiuni, prof. dr. Voichița Mogoș a prezentat un raport al AACE din 2015, în
care acuza implicația surplusului de iod în apariția cancerului tiroidian, în
special a celui papilar. Dar dacă suplimentarea cu iod scade prevalența
cancerelor active folicular și anaplastic, nu este oare mai bună intervenirea
în această direcție pentru sănătatea populației? De altfel, date mai vechi (6)
arătau că, în România, cancerul anaplastic reprezenta 20–45% din cancerele
tiroidiene, iar cel folicular 25%.
Prof. dr. Voichița Mogoș afirmă
că zonele deficitare în iod și cele supraiodate conduc la creșterea mutațiilor
genei BRAF, implicată în cancerul papilar. Mutația ar apărea în timpul vieții
și nu ar fi înscrisă în codul genetic al persoanei la naștere. Dar astfel de
analize nu s-au efectuat. În schimb, cercetări mai noi arată că nu există
diferențe între țările cu surplus de iod și cele cu deficit, în ceea ce
privește prevalența cancerului papilar și folicular (8). Alți factori clinici
de risc pentru cancerul tiroidian, precum asocierea cu tiroidita Hashimoto
și/sau sexul feminin nu au fost validați.
Factorii ecografici de risc malign
Ecografia simplă și/sau color s-a
dovedit a fi cea mai bună metodă de investigație a unui nodul tiroidian.
Actualmente, aceasta este cea care sugerează caracterul malign al unui nodul,
în funcție de imaginea căruia s-au elaborarat cinci niveluri de suspiciune
pentru malignitate, prezentate în tabelul 1.
Pentru fiecare din aparițiile
ecografice ce pot fi încadrate într-o anumită clasă de suspiciune, analizele
ulterioare anatomopatologice au confirmat suspiciunea în procente diferite.
Încadrarea ecografică într-o grupă este apanajul investigatorului, ceea ce face
din acest proces unul extrem de subiectiv. Astfel, un nodul tiroidian suspect
ecografic nu este întotdeauna malign, dar chiar și nodulii cu aspect benign pot
genera cancer tiroidian.
Aceste date ar putea conduce la
ideea că orice nodul tiroidian trebuie puncționat pentru analiză bioptică. Cu
toate acestea, biopsia poate fi înlăturată, fie pe motive de „evoluție“ a
nodulului, fie prin noi tehnici ecografice în curs de evaluare, ce vor fi
prezentate în continuare.
Aspecte ecografice
sugestive pentru malignitate
În aprecierea unui nodul
tiroidian sunt folosite permanent zece elemente de imagistică ecografică, după
cum se prezintă în tabelul 2.
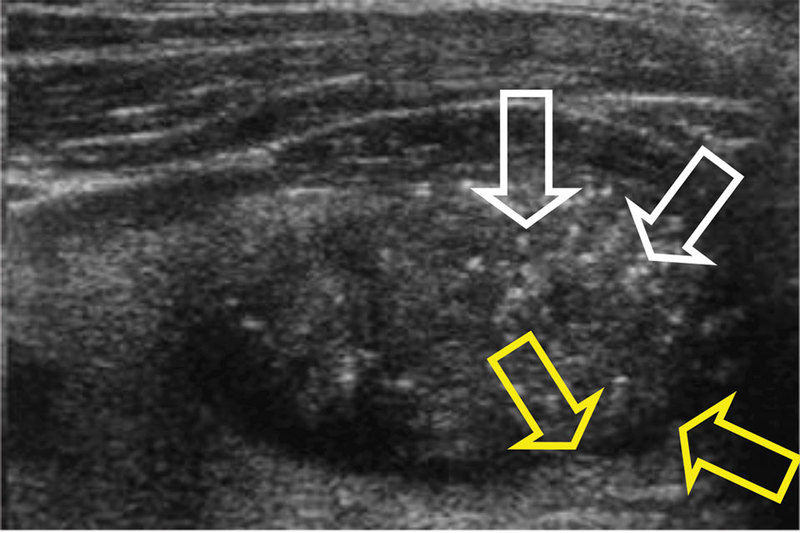
Prof. dr. Hossein Gharib și prof.
dr. Fuori Pacini afirmă că cea mai sugestivă imagine ecografică pentru un nodul
malign de cancer papilar este aceea de microcalcificări (săgeata albă) într-un
nodul hipoecogen cu margini neregulate (săgeata galbenă) (fig. 1). Dacă
nodulul este hiperecogen, el este de obicei benign.
Datele de sensibilitate și
specificitate ale calcificărilor, din metaanalize extinse (pe aproximativ
13.000 de noduli), nu arată însă valori extrem de mari: sensibilitatea între
25% și 60% și specificitatea de 80% (9). Sensibilitatea mică sugerează faptul
că prezența calcificărilor este observată frecvent și la cazurile fără cancer.
Examenul clinic și condițiile de
analiză ecografică sunt mai importante decât aspectul „fotografic“ al
ecografiei, care poate fi observant în fig. 2. Contextul clinic este
însă esențial: această imagine aparent malignă este realizată după injectarea
de alcool în nodul benign, conform procedurilor sugerate de Frasoldati în 2015
(10).
Sugestiv pentru neoplazie este și
„un nodul hipoecogen cu margini neregulate“, adică un nodul solitar, fără
calcificări (fig. 3). Margini neregulate pot fi și sub forma unui halou
întrerupt, în unele imagini. Sensibilitatea acestui aspect este cuprinsă între
25% și 87%, iar specificitatea între 45% și 90% (9). Această imagine are cele
mai mari valori pentru aceste analize statistice.
Un nodul tiroidian cu diamentrul
antero-posterior mai mare ca cel transvers (11) poate fi considerat, de
asemenea, suspect de transformare neoplazică (fig. 4), asemănător cu
aspectul unui nodul în cancerul de sân. Unii autori introduc aici și nodulii
strict rotunzi (non-eliptici), unde diamentrul longitudinal, mai mare la
nodulii eliptici, este egal cu cel antero-posterior (transvers). Sensibilitatea
pentru aceast aspect este mică (25%), dar specificitatea este mare (95%) (9).
Nodulul cu calcificări externe de
tip „coajă de ou“ cu aparentă protruzie pe lângă această „coajă“ (fig. 5)
este de multe ori cancer papilar. Asocierea la aceste imagini a ganglionilor
latero+cervicali (fig. 6) conduce la ideea de malignitate.
Prezența circulației interne
într-un nodul sugerează de asemenea malignitate (fig. 7). Sensibilitatea
pentru acest tip de imagine este cuprinsă între 55% și 75% (9), fiind o imagine
intens sugestivă pentru suspiciunea de malignitate.
Pentru acest tip de imagini, ATA
recomandă FNA. Cu toate acestea, datele derivate din metaanalize arată că
prezența unei imagini „sugestive“ nu este de real folos în sugerarea unei
conduite. De altfel, ATA recomandă azi folosirea tuturor imaginilor sugestive
pentru un nodul malign.
Noduli cu suspiciune intermediară
Cu o prevalență de numai 10–20%
pentru malignitate se prezintă nodulii hipoecogeni pur solizi, cu margini
regulate și fără circulație internă (fig. 8). Acești noduli se numesc
„cu suspiciune intermediară“. Se observă însă că acești noduli sunt în
majoritate benigni. Astfel de noduli nu evoluează sau evoluează spre neoplazie
doar în 14% (din cele 10%) din cazuri. Pentru astfel de noduli, ATA recomandă
FNA dacă nodulul este mai mare de 10 mm.
Noduli cu risc scăzut
Riscul redus înseamnă că 5–10%
din nodulii evaluați ecografic s-au dovedit maligni după examentul
histopatologic. Aceștia sunt neomogeni. Cu noile echipamente (ecografe care
folosesc și 15 MHz pentru analiza glandei tiroide), acest tip de nodul poate
deveni mai neomogen, trecând astfel în categoria a treia de risc. Aici trebuie
să facem încă o precizare: riscul este matematic și extrem de subiectiv.
Interpretarea ecografică de omogenitate vs. neomogenitate depinde de experiența
investigatorului dar (cum remarcăm în ultimul timp) și de rezoluția folosită la
investigare. În acest mod, de la un risc de malignitate de 10–20% se poate
ajunge la 5–10%. Cu toate acestea, se observă suprapunerea de 10% la cele două
paliere. Aceste convenții creează dificultăți de interpretare a ghidurilor de
practică. Pentru astfel de noduli, ATA recomandă FNA dacă nodulul este mai mare
de 15 mm.
Nodulii cu risc foarte scăzut
Prezența de imagini anecogene,
precum și dispoziția neomogenă a hipoecogenității scad suspiciunea de cancer
sub 3%. Acest tip de nodul (fig. 9) generează un indice elastografic
scăzut (1 m/s).
Tot în această categorie se încadrează
și nodulii hiperecogeni sau izoecogeni. Atunci când aceștia prezintă și un
halou delimitat de parenchimul tiroidian (fig. 10), ne putem gândi la un
proces inflamator între nodul și tiroidă, nu la un proces malign.
Cu același risc de malignitate se
prezintă și imaginile parțial anecogene sau parțial solide, care pot prezenta
calcificări de capsulă sau la locul unde se presupune că a avut loc „o
ramolire“ a țesutului tiroidian (fig. 11).
Pentru acest tip de imagine, ATA
recomandă efectuarea FNA dacă nodulul are peste 2 cm, dar lipsa FNA este de
asemenea o opțiune rezonabilă.
Noduli fără risc de malignitate
Al cincilea palier de suspiciune,
în care se spune că nu prea găsim cancer tiroidian (risc sub 1%) sunt imaginile
pur anecogene sau cele cu mici leziuni de calcificare unică pe marginea
leziunii (fig. 12). Anecogenitatea pură este urmată de „întărire
posterioară“. Acest tip de imagine nu are indicația ATA de FNA.
Definirea cancerului tiroidian papilar cu
risc scăzut
Prevalența cancerului tiroidian a
fost apreciată în România la 6% din nodulii tiroidieni. În Moldova, cancerul
papilar a fost apreciat la 90% din 6%, adică 5,4% (7). Cancere agresive au fost
considerate având o prevalență de 0,6%.
Ghidurile au stabilit
convențional că 10 mm este limita (cut-off) sub care cancerul tiroidian
– mai ales cel papilar – nu evoluează sau evoluează la foarte puțini pacienți.
Tumorile tiroidiene sub 10 mm reprezintă un „cancer cu risc scăzut“. Riscul
redus este legat de evoluția în timp. Sau, altfel spus, dacă ai curajul (ca
medic) să nu intervi la momentul diagnosticului sau dacă pacientul este
îndeajuns de determinat să nu facă operația, atunci poți avea acea cazuistică.
Cancerul papilar apărut în noduli
sub 10 mm evoluează mai mult de 3 mm la numai 6% din pacienți în cinci ani și
la numai 16% din pacienți în zece ani. După zece ani de observație, numai 3,4%
din acești pacienți vor prezenta metastaze ganglionare (12).
Cu alte cuvinte, dacă un
clinician vede azi 100 de noduli tiroidieni, care sunt puncționați și
diagnosticați drept cancer papilar, peste zece ani, 84 din pacienți vor arăta
la fel, cu același cancer papilar și același nodul.
Acest tip de evoluție apare la
80% din pacienții cu cancer papilar. Dacă considerăm 100 de noduli tiroidieni
nediagnosticați biopsic și știm că prevalența cancerului papilar care nu
evoluează este de 86% din 80% reprezentând pacienții cu cancer papilar cu
evoluție lentă, având în vedere că prevalența cancerului tiroidian este de 5%
(după statistica mondială) sau 6% (după statistica românească), peste zece ani
ar însemnă că numai 1,9–2% din nodulii observați au fost operați. Astfel, pare
că după zece ani de observație, 98% din pacienți trebuie să rămână neoperați.
În epoca modernă, cercetări ale
istoriei naturale a unui pacient cu cancer tiroidian neoperat sunt rare, pentru
că de obicei pacientul este operat. A nu opera un cancer tiroidian a fost
considerat ca un act de mare curaj (13), dar astfel de istorii au fost
publicate în vechime, iar datele lor ar trebui reinterpretate azi.
În epoca pre-ecografică,
Silliphant și colaboratorii au arătat, încă din 1964, că 2,7% până la 81% (în
funcție de cercetarea citată) din pacienții decedați de alte afecțiuni prezintă
cancer tiroidian, fără a preciza vârsta pacienților la care s-a efectuat
autopsierea. În aceeași epocă, Sobrinho-Simões (în anul 1979) observă cancere
tirodiene oculte în 6,5% din autopsiile efectuate în Porto. După 70 de ani,
prevalența a crescut la 12%.
Studii autopsice mai noi, din
perioada „ecografică“ arată în continuare prevalențe crescute ale cancerului
tiroidian la decedații de alte cauze, de la 6% (14) la puțin peste 10% (15).
Interesant este că s-au observat
prevalențe crescute în continuare pentru cancerele nediferențiate (41%) (14).
Un singur caz a prezentat metastaze ganglionare. Vârsta pacienților decedați de
alte cauze, pentru care s-a făcut autopsie, a fost între 15 și 96 de ani, cu o
mediană destul de mare, 60 de ani la bărbați și 62 de ani la femei. Prevalența
scăzută pentru vârstele mai tinere (16) sugerează apariția bolii în timp.
Cercetările moderne arată că 384
de pacienți cu cancer papilar sub 10 mm au fost observați timp de 6,8 ani (17).
Observația a fost ecografică și s-au urmărit trei din caracteristicile
imagistice de malignitate: creșterea dimensiunilor (peste 15%), calcificările
și vascularizația intranodulară.
Creșterea dimensiunii tumorii a
fost înregistrată la numai 6% din pacienți. Toți pacienții/pacientele la care
s-a observat creșterea dimensiunilor tumorii aveau sub 60 de ani. Un nodul
tiroidian descoperit la un pacient peste 60 de ani, chiar dacă este cancer
papilar, nu evoluează. Contrar a ceea ce se afirmă în prezent despre
microcalcificări, studiul arată că o creștere a numărului de calcificări și a
dimensiunilor calcificărilor apar la pacienții la care nu se observă creșterea
dimensiunilor nodulului, sugerând că fenomenul este unul de apărare sau de
vindecare (în 1998, am afirmat că apariția calcificărilor în diferite țesuturi,
inclusiv în tiroidă, face parte din sistemul de apărare al organismului în
cadrul reacțiilor inflamatorii).
A treia observație de imagistică
a studiului a fost că, în timp, vascularizația intratumorală, observată inițial
la 18% din pacienți, a diminuat la peste 60% din aceștia. Datele sugerează că evoluția
„naturală“ a cancerului tiroidian este extrem de blândă.
Convenții milimetrice
Nu se știe de ce ghidurile de
practică americane, dar și cele europene folosesc convenția de 10 mm pentru
nodulii tiroidieni ca limită de evaluare potențială pentru cancerul tiroidian.
Întrebările pe care le-am pus prezentatorilor de la congresele de specialitate
din Florența, București și München au primit răspunsuri la fel de
convenționale, nelegate de analize statistice de tipul sensibilitate,
specificitate sau valoare predictivă pozitivă.
Profesorul Pacini, comentând
datele prezentate de antecesorii săi de la Mayo (Hay, Gharib), a arătat că dacă
un nodul tiroidian este cancer, el evoluează la fel și dacă are 10 mm și dacă
are 14 sau 17 mm. Și alți specialiști afirmă că mărimea nodulului tiroidian nu
are importanță în creșterea riscului de cancer (18), dar afirmațiile pot fi
negate de alții, care sugerează că nodulii peste 3 cm sunt mai maligni decât
arată FAN și trebuie operați (19).
De altfel, sensibilitatea este
extrem de scăzută pentru biopsiile efectuate la dimensiuni mici (11). Astfel,
cazurile fals negative cresc cu posibilitatea creșterii intervențiilor
agresive. Unii cercetători, în sistemul analizelor CT și IRM, fixează cut-off-ul
pentru cancerul tiroidian la 15 mm (20).
Întoarcerea la origini
În anii ʼ30 –ʼ40 ai secolului
trecut, se considera că puțin peste 60% din pacienții cu cancer papilar
evoluează excelent doar după excizia nodulului canceros (26). În acea epocă,
prezența de metastaze ganglionare era interpretată ca un semn clinic cu
pronostic pozitiv, în sensul că acestea erau protective. Astfel, ganglionii nu
erau extrași. Administrarea de hormoni tiroidieni peste limita de supresie
prelungea viața la numeroși pacienți non-tiroidectomizați total.
În anii ʼ50 –ʼ60, după ce
operațiile au devenit mai ample (lobectomie subtotală, unilateral 24%, și
bilateral 21%, lobectomie totală 28%, tiroidectomie totală 6%), rămânea un
procent de 33% din pacienți care nu erau operați, iar evoluția era în continuare
aceeași – excelentă. Metastazarea ganglionară era apreciată la 39%, dar
ganglionii nu erau eliminați.
Evaluările tiroidectomiei au fost
analizate și în anii ’80 -’90, la clinica Mayo. Observația a fost că fie că se
practică intervenție „minimală“, fie că se practică intervenție majoră,
supraviețuirea nu se modifică. Lobectomia este o intervenție adecvată,
tiroidectomia totală este o intervenție adecvată și intervenția chirurgicală
diferită nu conduce la efecte diferite.
În prejma anilor 2000, același
grup de la Mayo își schimbă părerea și nu mai recomandă lobectomia, spunând că
aceasta nu crește mortalitatea specifică, dar conduce la recurențe
loco-regionale. Astfel, se inaugurează era tiroidectomiei totale, chiar și
pentru cancerele papilare considerate cu risc scăzut. Indicația ghidurilor ATA
a fost preluată până în 2015.
În 2015, Ghidurile ATA au fost
revizuite. Din 2015, indicațiile pentru tiroidectomie încep să revină în mod
timid la cele din anii ʼ50. Acum, ATA recomandă fie lobectomie, fie tiroidiectomie
totală, la alegerea medicului, prin analiza factorilor de risc, inclusiv cei
legați de gena BRAF (mutația E600V).
În plus, Recomandarea 35 este:
„Dacă chirurgia este aleasă pentru un nodul sub 10 mm fără extensie
extratirodiană, procedura chirurgicală ar trebui să fie lobectomia dacă nu
există indicație pentru a scoate și celălalt lob. Lobectomia singură este
tratamentul suficient pentru nodulii mici, izolați în cazul în care pacientul
nu a fost supus anterior iradierii gâtului și nu are istoric familial de cancer
tiroidian sau metastaze cervicale detectabile“.
Aceasta înseamnă că un anume
clinician poate alege să nu indice operația tiroidiană, deși cancerul este
dovedit bioptic. Problema este dacă specialistul crede că 10 mm este o
indicație fermă sau consideră că se poate aștepta până la 17 mm (26). Aici, la
un nodul între 10 și 40 mm, ghidul este la fel de pitiatic: „procedura inițială
poate să fie tiroidectomia totală sau cvasitotală, ori lobectomia“. Deci, un
anume clinician poate transcende indicația simplă de lobectomie și decide
tiroidectomia toatală, dar nu este clar care sunt indicațiile de a scoate și
celălalt lob, din moment ce se specifică faptul că nodulul este unic. Iată cum
un ghid performant devine ușor pitiatic.
Nici indicațiile ferme de adenectomie din anii 2000 nu
mai sunt așa de sigure. Recomandarea 36 din ghidul ATA spune că tumorile T1
(sub 10 mm) și T2 (intratiroidiene) noninvazive nu necesită abordarea
ganglionară, aceasta fiind indicată numai la pacienții la care se efectuează
tiroidectomia totală.
Toate aceste abordări sunt timide
recomandări de a nu se mai interveni agresiv în cancerul tiroidian despre care
se spune că ar fi „cu risc scăzut“. S-a apreciat (12) că numai acei pacienți la
care se observă ganglioni laterocervicali ce sugerează a fi metastaze ale unui
cancer tiroidian și la care tiroglobulina crește trebuie operați (12). În plus,
mortalitatea prin cancer tiroidian diferențiat (papilar plus folicular) nu a
crescut timp de 30 de ani, fiind în jur de cinci cazuri la un milion de
persoane (21).
Elastografia în evaluarea unui nodul
tiroidian
În esență, conduita terapeutică
în fața unui nodul tiroidian evaluat ecografic este dependentă de o ulterioară
puncție. În ultimul timp, se discută dacă ar putea fi adoptate alte mijloace
terapeutice pentru a înlătura puncția, și astfel a evita operațiile pentru
acele cancere zise „cu risc scăzut“. De fapt, obiectivul este de a încadra cât
mai multe din cancerele tiroidiene la acest tip de diagnostic.
Astfel, a apărut elastografia.
Aceasta încearcă să aducă dovezi pentru susținerea unor „cancere cu risc
scăzut“ în absența FNA. Metoda de uz clinic, în special în forma cantitativă,
este încă la început, deși ea datează din anii ’90. Experții germani în
ecografie și prof. dr. Hossein Gharib de la Mayo consideră că elastografia nu
are nicio valoare în evaluarea unui nodul tiroidian. Se dau ca exemple cele
două situații antagonice: „fals negative“ și „fals pozitive“.
În situația fals pozitivă,
nodulii tiroidieni anecogeni, adică cei plini cu lichid, sunt fermi, „înalt
elastografici“ (fig. 13).
Acești noduli sunt benigni în
proporție de 99,9%, din punctul de vedere al ecografiei clasice. Fermitatea
elastografică (în figură – 5 m/s) este dată de capsula lor sub presiunea
lichidului (de cele mai multe ori, sânge provenit dintr-o ruptură capilară a
unui folicul tiroidian). Însă situația este clară din punct de vedere clinic,
pentru că anecogenitatea generează elastografia înaltă, nu zona solidă. Un
imagist experimentat nu poate face o recomandare de diagnostic malign pe o
astfel de elastografie.
Situația fals negativă este cea
în care nodulii tiroidieni care au cancer folicular sau chiar papilar se
prezintă cu elastografie „joasă“, adică „benignă“. Acestă situație nu a căpătat
până acum un răspuns adecvat din punct de vedere ecografic, căci majoritatea
nodulilor cu cancer folicular se prezintă „hard“ elastografic (fig. 14).
În plus față de aceastea, există
situații frecvente de noduli care apar la elastografie cu arii diferite, unele mai
moi, altele mai ferme. Interpretarea este dificilă dacă există diferențe mari
între ele. De exemplu, un nodul tiroidan considerat „moale“ s-a dovedit a fi
cancer papilar (fig. 15). La o analiză atentă, se vede că marginea nodulului a fost mai
fermă (22).
La o pacientă cu cancer folicular
diagnosticat biopsic în urmă cu cinci ani, la 55 de ani, neoperată, se observă
de asemenea arii diferite la elastografie (fig. 16).
Cu toate acestea, valorile
cantitative nu depășesc 4 m/s și nici nu se îndreaptă spre 5–6 m/s, cât permite
scala acestui aparat modern.
În schimb, metaanalize recente
sugerează că elastografia este capabilă să reducă numărul de puncții-biopsie,
considerate „nenecesare“ (23), afirmație susținută și de procentul mic de
malignitate obținut după analizele anatomopatologice, fie ele FNA sau operații.
Elastografia „non-moale“,
enunțată ca „absența elasticității“, în sensul de nodul ferm, a fost
considerată un test extrem de valoros, din moment ce, pe metaanalize extinse
(pe 13.000 de noduli), sensibilitatea a fost de 88%, specificitatea de 86%, iar
raportul de probabilitate a fost extrem de mare (6,39) (9). Studii mai vechi
(24) sugerau valori și mai mari: o sensibilitate de 92% și o specificitate de
90%.
Folosirea elastografiei, în
combinație cu toate imaginile ecografice sugestive de mai sus, poate conduce la
creșterea sensibilității la 97% (25).
Disputa asupra folosirii sau nu a
elastografiei este dependentă de rapiditatea cu care se poate face o puncție și
de dotarea investigatorilor clinici pentru utilizarea puncției și efectuarea
operațiilor. Clinicienii care fac puncții și au în dotare servicii de anatomie
patologică le utilizează pe acestea din urmă, fără a mai solicita ajutorul noii
metode elastografice cantitative. Dacă au la dispoziție și servicii de
chirurgie tiroidiană, atunci rolul elastografiei pare minim.
Conduita clinică generată de
ecografia clasică urmată de elastografie cantitativă ar putea fi următoarea:
dacă nodulul are caracteristici ecografice clasice de malignitate dar este
circumcis, cu capsulă clară, fără adenopatie (care sugerează metastazare
ganglionară), iar elastografia este „înaltă“, cel mai probabil este un cancer
papilar, care de obicei nu evoluează. De aceea, se indică „așteptarea“.
Dacă nodulul are caracteristici ecografice clasice de
malignitate, dar este circumcis, cu capsulă clară, iar elastografia este
„joasă“, cel mai probabil este un cancer folicular. Acest tip de cancer de
obicei evoluează în circa șase luni. Problema poate fi atunci când caracterul oncogen
sonografic nu este extrem de clar.
Poate apărea situația unui nodul
benign cu evoluție îndelungată. Peste 50% din nodulii tiroidieni pot fi în
această situație. Pentru a face diferențierea fără a folosi puncția-biopsie, se
poate alege o cale clinică numită „de temporizare“. Dacă după trei luni un
astfel de nodul nu a evoluat, el nici nu va evolua. Dacă este benign, el va
rămâne benign. Dacă este cancer tiroidian, în lipsa evoluției, probabil că nu
va evolua, susține Pacini (26).
Din acest punct de vedere, foarte
recent, Singh Ospina a arătat că nodulii benigni la FNA, cu caractere
ecografice suspecte, observați pentru cel puțin 8 ani, operați pentru motive
legate de „simptome compresive“ pot fi cancere în alte locuri decât cel în care
s-a efectuat FNA în proporție de numai 0,6%, pentru cancerul folicular,
respectiv 1,8%, pentru cancerul papilar.
Încă o problemă care apare în
clinică este în ce procente operațiile sunt „terapeutice“ și în ce procente
sunt „diagnostice“, pentru noduli tiroidieni dovediți postoperator a fi benigni
(23).
Instituții care au disponibile și
servicii chirurgicale, chiar și după puncție, nu reușesc să scadă necesarul de
intervenții la sub 75%. Cu alte cuvinte, după FNA, instituții cotate ca extrem
de performante fac tiroidectomii pentru noduli care se dovedesc maligni numai
în proporție de 26–36% (în funcție de tipul intevenției) (27).
Aproximativ 6,5–10% din
operațiile de tiroidă în România s-au dovedit a fi cancere tiroidiene,
informație prezentată la congresul Societății Române de Endocrinologie. În alte
țări, procentul este mult mai crescut: 47% cancere vs. 52% leziuni benigne
(28). Deci, în România, peste 90% din indicațiile de tiroidectomie au motive
mecanice (compresiune) sau diagnostice – „să vedem dacă nu este cancer“, ceea
ce pare cam mult, dar conform cu perceptele lui Shin, pentru nodulii peste 3
cm.
Mulțumim
dr. Adrian Sîrbu și Centrului Medical „Sana“, pentru posibilitatea de a efectua
și înregistra elastografii cantitative cu un aparat Loqic E9.