Contextul diagnostic: cazuri şi „necazuri“
În terapia intensivă neurochirurgicală, întâlnirea
cu hipotensiunea şi şocul stă mereu sub semnul unei provocări. În special la
pacientul plegic, recunoaşterea semnelor ameninţătoare de viaţă (de tip
tahicardie, vasoconstricţie, centralizarea circulaţiei) este mascată de absenţa
tonusului simpatic sub nivelul leziunii neurologice. Ne putem afla în faţa unui
pacient bradicardic fără paloare, dar în şoc hemoragic. Semnele de iritaţie
peritoneală pot fi, din acelaşi motiv, absente.
Pneumonia (de aspiraţie, prin suprainfecţie
a unor teritorii atelectatice sau urmarea bronhoplegiei centrale) complică într-un
procent de până la 70% evoluţia pacienţilor tetraplegici din terapia intensivă.
Toaleta bronşică riguroasă şi ridicarea capului la 30 de grade faţă de planul
orizontal se dovedeşte indispensabilă. Deşi inervaţia diafragmului îşi are
originea la nivel cervical (C3–C5), tusea eficientă şi inspiraţia adâncă implică
musculatura respiratorie intercostală şi, în consecinţă, participarea inervaţiei
toracice. Pacienţii cu secţiuni cervicale înalte (C3–C5) experimentează adesea
„oboseala respiratorie“ de denervare. Fumătorii, pulmonarii cronici sau cei
care au aspirat sânge sau conţinut gastric în momentul impactului (chiar în
cantitate mică) pot avea dificultăţi în ceea ce priveşte clearence-ul căii
aeriene. Aceştia impun o monitorizare atentă, pentru a beneficia de intubaţia
oro-traheală electivă, de protecţie. Evaluările precoce ale indicaţiei de
protezare respiratorie se referă la capacitatea vitală mai mică de 20 ml/kgc şi
la presiunea negativă a inspirului fiziologic peste –20 cm H2O. Tahipneea
(frecvenţa respiratorie peste 35 de respiraţii/minut), balansul
toraco-abdominal important, tirajul suprasternal şi intercostal aparţin
semiologiei clasice, dar sunt utile şi azi în faţa pacientului cu efort
respirator. Hipoxia şi hipercapnia evaluate de gazometria arterială sunt semne
tardive de insuficienţă respiratorie, iar intubaţia oro-traheală nu trebuie să
le aştepte. Aceasta este necesară pentru orice pacient neurologic a cărui stare
de conştienţă nu-i mai permite menţinerea patentă a căii aeriene. Hipoxia (paO2 sub 60 mm Hg, cu SaO2 sub 90%) dublează în mod independent
mortalitatea acestei categorii de pacienţi (de la 27 la 50%). În aceeaşi ordine
de idei, pneumonia asociată ventilaţiei mecanice apare ca „lider“ al infecţiilor
pulmonare enumerate, pentru că o evoluţie neurologică dificilă ne pune adesea în
imposibilitatea de a extuba pacientul cu GCS mai mic de 8. Traheostomia de elecţie
intervine ca soluţie temporară.
respiraţii/minut), balansul
toraco-abdominal important, tirajul suprasternal şi intercostal aparţin
semiologiei clasice, dar sunt utile şi azi în faţa pacientului cu efort
respirator. Hipoxia şi hipercapnia evaluate de gazometria arterială sunt semne
tardive de insuficienţă respiratorie, iar intubaţia oro-traheală nu trebuie să
le aştepte. Aceasta este necesară pentru orice pacient neurologic a cărui stare
de conştienţă nu-i mai permite menţinerea patentă a căii aeriene. Hipoxia (paO2 sub 60 mm Hg, cu SaO2 sub 90%) dublează în mod independent
mortalitatea acestei categorii de pacienţi (de la 27 la 50%). În aceeaşi ordine
de idei, pneumonia asociată ventilaţiei mecanice apare ca „lider“ al infecţiilor
pulmonare enumerate, pentru că o evoluţie neurologică dificilă ne pune adesea în
imposibilitatea de a extuba pacientul cu GCS mai mic de 8. Traheostomia de elecţie
intervine ca soluţie temporară.
O menţiune aparte merită ventilaţia mecanică
cu presiune pozitivă la sfârşitul expirului. Aceasta creează presiuni crescute
intratoracice, care scad întoarcerea venoasă şi duc la diminuarea suplimentară
a presiunii arteriale medii, la pacienţi deja vulnerabili. Se compromite, în
plus, fluxul sanguin cerebral, prin accentuarea instabilităţii hemodinamice.
Contextul diagnostic se completează cu
evaluarea riscului de tromboză venoasă profundă şi de trombembolism pulmonar (aşa-zisul„silent killer“).
Este cunoscut faptul că creierul uman conţine
tromboplastină, iar după leziunea cerebrală activitatea acesteia creşte, mai
ales în lobii frontal, parietal şi temporal. Se activează astfel cascada coagulării
şi devine posibilă apariţia coagulării intravasculare diseminate. Detectarea
trombilor se realizează în prezent cu fibrinogen marcat, prin angio-CT. Incidenţa
trombembolismului la pacientul cu traumă cerebrală gravă este încă subestimată,
dar variază procentual între 41 şi 60%. Datele se completează cu rapoartele
necroptice ale pacienţilor asimptomatici intra
vitam.
Anomalii ale timpilor de coagulare (PT,
APTT, INR) sau ale numărului de trombocite sunt prezente la mai mult de jumătate
din pacienţii cu traumatism craniocerebral. Trombocitopenia se corectează prin
administrarea de masă trombocitară, dar poate apărea şi în contextul heparinoterapiei.
Riscul maxim de tromboză se situează în primele două săptămâni de la traumă,
dar se menţine înalt pentru încă şase săptămâni. Ghidurile în vigoare recomandă
anticoagularea sistemică cu heparine în tot acest interval, chiar dacă în prima
perioadă pacienţii sunt supuşi doar profilaxiei mecanice cu dispozitive de
compresie externă. Chimioprofilaxia cu heparină nefracţionată (sub controlul
coagulogramei) sau cu heparine cu greutate moleculară mică trebuie iniţiată cât
mai curând posibil.
Cazurile de şoc neurogen refractar trebuie întotdeauna
evaluate pentru embolismul pulmonar. Se folosesc electrocardiograme seriate,
dozări enzimatice succesive şi radiografii toracice, căutând surprinderea în
timp real a modificărilor patologice. Congestia pulmonară, silueta cardiacă,
modificările electrice pot fi înalt sugestive, dar trebuie ţinut cont de faptul
că în aproape 57% din cazuri rezultatele acestora au fost normale la pacienţi
cu emboli dovediţi angiografic. Singura situaţie care justifică decizia de a nu
trata sau de a nu continua evaluarea este obţinerea unei scintigrame de
perfuzie normale. Posttraumă spinală însă, anticoagularea corectă protejează
contra trombozei pulmonare acute şi ischemiei miocardice. Riscul major este
reprezentat de apariţia unui eventual hematom epidural acut. Acesta se evacuează
rapid, pentru a nu afecta prognosticul neurologic.
Ca o consecinţă gravă a şocului neurogen,
indiferent de forma etiopatogenică, apare tubul digestiv de stres. Ulceraţiile
mucoasei gastrice, plasate pe fund şi pe corp, au fost evidenţiate endoscopic
la peste 91% din pacienţii ventilaţi mecanic în primele 24 de ore de la
producerea leziunii cerebrale. Prevenţia se realizează tipic prin menţinerea
unui pH intraluminal peste 5 şi prin blocada receptorilor H2. În prezent,
se utilizează în egală măsură sucralfat, antagonişti H2 şi inhibitori ai pompei de protoni. Nutriţia
enterală precoce are efect protector. Aceasta trebuie administrată cât mai curând
posibil, cu formule hipercalorice şi hiperprotidice, prevenind astfel şi
fenomenul de translocaţie bacteriană intestinală, cu rol-cheie în iniţierea răspunsului
inflamator sistemic, atât de defavorabil pentru pacientul critic.
În cursul primelor şapte zile care urmează
traumatismului cerebral grav, fără a se putea stabili clar o relaţie de
cauzalitate cu şocul neurogen, se descriu fenomenele convulsive. Acestea beneficiază
de tratament antiepileptic cu fenitoin şi carbamazepină, pentru a preveni creşterea
suplimentară a consumului de oxigen cerebral. Administrarea cronică de
anticomiţiale nu poate însă preveni apariţia convulsiilor tardive, consemnate
chiar la patru-cinci ani de la traumatism.
Susţinerea pacientului cu şoc neurogen în
terapia intensivă justifică pe deplin monitorizarea atentă şi complexă.
Hemodinamica se evaluează prin
determinarea presiunii venoase centrale şi a tensiunii arteriale măsurate
continuu, invaziv, prin cateter arterial. Rareori, poate fi necesară instalarea
cateterului de tip Swan-Ganz.
Accesul venos central măsoară PVC şi asigură
administrarea de fluide şi medicamente, în special infuzia de vasopresor la
nevoie. Chiar cu riscuri mai mari la instalare, venele subclaviculare sunt
preferate pentru că se evită teoretic staza venoasă care apare pe venele
jugulare la pacienţii cu presiune intracraniană crescută. În plus, subiecţii cu
traumă cerebrală prezintă adesea leziuni ale coloanei cervicale şi poartă
contenţie externă de tip guler. Aceasta scade accesibilitatea venei jugulare
interne la puncţie.
În prezenţa febrei şi a instabilităţii
hemodinamice, monitorizarea presupune întotdeauna recoltarea de hemoculturi. De
la prezentare, se instituie tratament antibiotic – cu spectru ultralarg în
aceste cazuri.
Culturile şi antibiogramele obţinute din
lichidul cefalorahidian au importanţă deosebită pentru că ghidează acoperirea
antibiotică a unor potenţiale  infecţii grave ale sistemului nervos central.
Acestea sunt redutabile şi pot apărea în special după trauma cerebrală care a
creat soluţii de continuitate în baza de craniu sau la nivelul sinusurilor.
Contaminarea bacteriană poate apărea şi după manevre instrumentale cerebrale
sau pe canalul spinal. Terenul imunosuprimat modifică în plus regimul
antibiotic.
infecţii grave ale sistemului nervos central.
Acestea sunt redutabile şi pot apărea în special după trauma cerebrală care a
creat soluţii de continuitate în baza de craniu sau la nivelul sinusurilor.
Contaminarea bacteriană poate apărea şi după manevre instrumentale cerebrale
sau pe canalul spinal. Terenul imunosuprimat modifică în plus regimul
antibiotic.
Informaţiile furnizate de senzorul de
monitorizare a presiunii intracraniene nu intervin în diagnosticul şocului
neurogen, dar conduc osmoterapia astfel încât presiunea arterială medie să
permită o presiune de perfuzie cerebrală mai mare de 65 mm Hg.
Determinările seriate de cortizol seric se
obţin în primele zile de traumă cerebrală, pentru a pune în discuţie forma
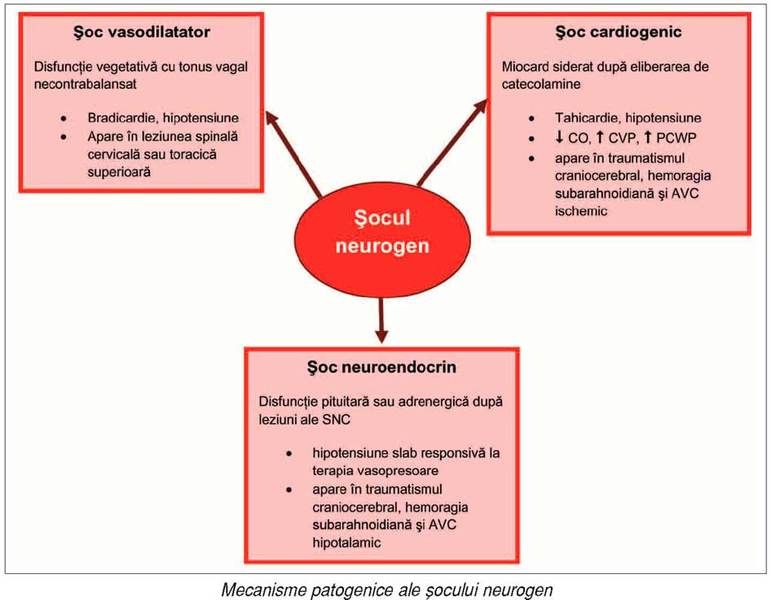
neuroendocrină a şocului.
O menţiune specială, în acest context,
merită utilizarea steroizilor în terapia intensivă neurochirurgicală.
Rezultatele studiului CRASH, desfăşurat cu metilprednisolon, au „demolat“
efectul antiinflamator presupus a fi „magic“ în trauma spinală. Steroidele
administrate falsifică întotdeauna rezultatele dozărilor de cortizol, iar
administrarea lor nu este suficientă pentru a trata adecvat insuficienţa
corticosuprarenală.
Hipotensiunea severă din şocul neurogen
contraindică formal retragerea steroizilor din schema de tratament.
Dexametazona, foarte populară în terapia intensivă neurologică şi
neurochirurgicală, este însă complet lipsită de efect mineralocorticoid. De
aceea, se impune înlocuirea ei cu hidrocortizon atunci când se suspectează
forma neuroendocrină a şocului neurogen. Doza va fi de 50 mg i.v. la fiecare şase ore, în acelaşi
regim ca pentru şocul septic.
Din interpretarea datelor nu putea lipsi
hiperglicemia. Are drept cauză eliberarea de catecolamine şi cortizol la
momentul traumei. Ischemia pituitară instalată astfel sau debutul unui diabet
zaharat latent poate creşte suplimentar nivelul glicemic. Acesta accentuează,
la rândul său, leziunea neurologică prin inducerea unui stres oxidativ legat de
radicalii liberi şi de mediatorii proinflamatori. Hiperglicemia este
responsabilă de creşterea globală şi a edemului cerebral, potenţând intrarea
directă a calciului în neuron. Terapia cu insulină, pentru menţinerea unui
nivel al glucozei circulante sub 110 mg/dl, a redus semnificativ mortalitatea şi
morbiditatea în trauma cerebrală.
Pe modele experimentale, s-a constatat că
insulina reduce semnificativ afectarea cerebrală în timpul ischemiei acute,
atribuindu-şi astfel un rol inedit în neuroprotecţie. În plus, suprimă
mediatorii inflamaţiei şi ai coagulării, crescând eliberarea endotelială de
oxid nitric, cu rol vasodilatator cerebral.
În hemoragia subarahnoidiană, rinichiul răspunde
în cadrul şocului neurogen cu o varietate de nefropatii. Pierderea de sodiu
duce la hiponatremie şi depleţie volemică dacă nu este recunoscută în timp
util.
Nu în ultimul rând, la capitolul „necazuri“
se citează apariţia diabetului insipid ca o consecinţă directă a traumei
cerebrale. Debutul apare şi la o oarecare distanţă de evenimentul acut, iar
cauza este suferinţa acută a hipofizei. Diagnosticul se pune pe apariţia
hipernatremiei serice şi a hipotoniei urinare apărute în acest context. Corecţia
trebuie realizată lent dacă durata dezechilibrului a depăşit câteva ore.
Strategii de tratament
Terapia urmăreşte două direcţii principale:
prevenirea injuriei cerebrale secundare determinate de hipoxie şi hipotensiune,
respectiv susţinerea energică a funcţiilor vitale, ştiindu-se că şocul neurogen
– în special forma cardiogenică şi cea neuroendocrină – sunt tranzitorii şi se
autolimitează.
Prognosticul bun este regula, în ciuda
aspectului clinic „de muribund“ al pacientului în faza acută.
Menţinerea euvolemiei cu fluide şi/sau
vasopresoare duce la obţinerea unei presiuni de perfuzie cerebrală mai mare de
65 mm Hg, cu toate că presiunea optimă
nu este cunoscută.
Hipertonia vagală din varianta
vasodilatatorie poate duce la instalarea unei bradicardii cu indicaţie de
pacing temporar.
Forma cardiogenică impune adesea utilizarea
anumitor forme de suport inotrop. Dobutamina şi milrinona au şi efecte
vasodilatatoare, ducând la accentuarea hipotensiunii şi impunând folosirea
concomitentă a unui alfa-agonist de tip fenilefrină sau noradrenalină. Creşterea
postsarcinii în primul caz şi tahicardia în cel de-al doilea sunt factori care
le limitează utilizarea şi care impun o monitorizare atentă.
În şocul cardiogen de cauză neurogenă, în
mod tipic boala coronariană nefiind prezentă, tahicardia compensatorie este
modalitatea obişnuită de menţinere a debitului cardiac.
Disfuncţia miocardică se evaluează complet
la prezentarea iniţială şi apoi la câteva zile, pentru aprecierea evoluţiei.
Balonul de contrapulsaţie aortică, necesar
pentru a reduce mecanic postsarcina şi a îmbunătăţi perfuzia coronariană, este
foarte rar folosit.
Deşi nu se bucură de aceeaşi popularitate
ca alţi „parteneri“ din familia şocului (septic, anafilactic), cel neurogen
merită întreaga atenţie a intensiviştilor pentru că poate fi tratat cu un real
succes. Viitorul va aduce informaţii ştiinţifice de mare acurateţe, fără a
schimba semnificativ prognosticul.
 respiraţii/minut), balansul
toraco-abdominal important, tirajul suprasternal şi intercostal aparţin
semiologiei clasice, dar sunt utile şi azi în faţa pacientului cu efort
respirator. Hipoxia şi hipercapnia evaluate de gazometria arterială sunt semne
tardive de insuficienţă respiratorie, iar intubaţia oro-traheală nu trebuie să
le aştepte. Aceasta este necesară pentru orice pacient neurologic a cărui stare
de conştienţă nu-i mai permite menţinerea patentă a căii aeriene. Hipoxia (paO2 sub 60 mm Hg, cu SaO2 sub 90%) dublează în mod independent
mortalitatea acestei categorii de pacienţi (de la 27 la 50%). În aceeaşi ordine
de idei, pneumonia asociată ventilaţiei mecanice apare ca „lider“ al infecţiilor
pulmonare enumerate, pentru că o evoluţie neurologică dificilă ne pune adesea în
imposibilitatea de a extuba pacientul cu GCS mai mic de 8. Traheostomia de elecţie
intervine ca soluţie temporară.
respiraţii/minut), balansul
toraco-abdominal important, tirajul suprasternal şi intercostal aparţin
semiologiei clasice, dar sunt utile şi azi în faţa pacientului cu efort
respirator. Hipoxia şi hipercapnia evaluate de gazometria arterială sunt semne
tardive de insuficienţă respiratorie, iar intubaţia oro-traheală nu trebuie să
le aştepte. Aceasta este necesară pentru orice pacient neurologic a cărui stare
de conştienţă nu-i mai permite menţinerea patentă a căii aeriene. Hipoxia (paO2 sub 60 mm Hg, cu SaO2 sub 90%) dublează în mod independent
mortalitatea acestei categorii de pacienţi (de la 27 la 50%). În aceeaşi ordine
de idei, pneumonia asociată ventilaţiei mecanice apare ca „lider“ al infecţiilor
pulmonare enumerate, pentru că o evoluţie neurologică dificilă ne pune adesea în
imposibilitatea de a extuba pacientul cu GCS mai mic de 8. Traheostomia de elecţie
intervine ca soluţie temporară. infecţii grave ale sistemului nervos central.
Acestea sunt redutabile şi pot apărea în special după trauma cerebrală care a
creat soluţii de continuitate în baza de craniu sau la nivelul sinusurilor.
Contaminarea bacteriană poate apărea şi după manevre instrumentale cerebrale
sau pe canalul spinal. Terenul imunosuprimat modifică în plus regimul
antibiotic.
infecţii grave ale sistemului nervos central.
Acestea sunt redutabile şi pot apărea în special după trauma cerebrală care a
creat soluţii de continuitate în baza de craniu sau la nivelul sinusurilor.
Contaminarea bacteriană poate apărea şi după manevre instrumentale cerebrale
sau pe canalul spinal. Terenul imunosuprimat modifică în plus regimul
antibiotic.