Bolile respiratorii au o incidenţă mare în
perioada copilăriei. Particularităţile structurale ale aparatului respirator
creează condiţii funcţionale specifice, care justifică existenţa maladiilor
inflamatorii cu etiologie diversă, în special la vârsta sugarului şi copilului
mic.
După naştere, multiplicarea alveolară continuă
în primele trei luni de viaţă, iar desăvârşirea structurală şi funcţională este
completă abia după şapte ani. Deficitele imune tranzitorii reprezintă prima
provocare în confruntarea cu infecţiile, la fel ca hipoxiile plurietiologice,
anomaliile constituţionale şi imunologice, în special atopia.
Cumularea acestor factori de risc endogeni
perturbă, pe arii populaţionale ample, eficienţa sistemelor de apărare
antiinfecţioasă la vârstele mici. Dizabilitatea uneia sau mai multor verigi din
lanţul etapelor apărării antiinfecţioase explică doar parţial incidenţa crescută,
durata prelungită şi severitatea bolilor respiratorii la anumite categorii de
copii.
Bolile alergice urmează, în ultima perioadă,
un trend crescător, devenind alarmant faptul că un sfert din populaţia europeană
suferă de o manifestare alergică, cu implicarea tuturor vârstelor, dar primele
exprimări ale bolii sunt edificatoare din perioada copilăriei. Cauzele sunt
complexe, dar incomplet clarificate. Estimările privind viitorul sunt pesimiste
şi justifică interesul pentru elucidarea etiopatogeniei, în care se
înregistrează progrese spectaculare. S-au demonstrat relaţii de cauzalitate
care transferă gândirea pur clinică în domeniul medicinii moleculare.
Rolul factorului infecţios se menţine în
focus; dacă intervenţia infecţiei virale deţine astăzi locul de lider în declanşarea
disfuncţiei imune direcţionate spre diferenţiere limfocitară Th2, disputându-se
supremaţia virusului sinciţial respirator, rinovirusurilor şi adenovirusurilor,
în lumea infecţiilor bacteriene, concepţii noi şi dovezi ferme atestă rolul de
partener capricios, misterios şi greu de interpretat al microbiotei digestive. Şi, pentru că lucrurile sunt mereu mai complexe, comportamentul imun sistemic este
corelabil cu componenţa şi dinamica microbiotei specifice, respiratorii, o altă
entitate recent individualizată, care are rol covârşitor în apariţia,
caracteristicile clinice şi evoluţia bolilor pulmonare.
pentru că lucrurile sunt mereu mai complexe, comportamentul imun sistemic este
corelabil cu componenţa şi dinamica microbiotei specifice, respiratorii, o altă
entitate recent individualizată, care are rol covârşitor în apariţia,
caracteristicile clinice şi evoluţia bolilor pulmonare.
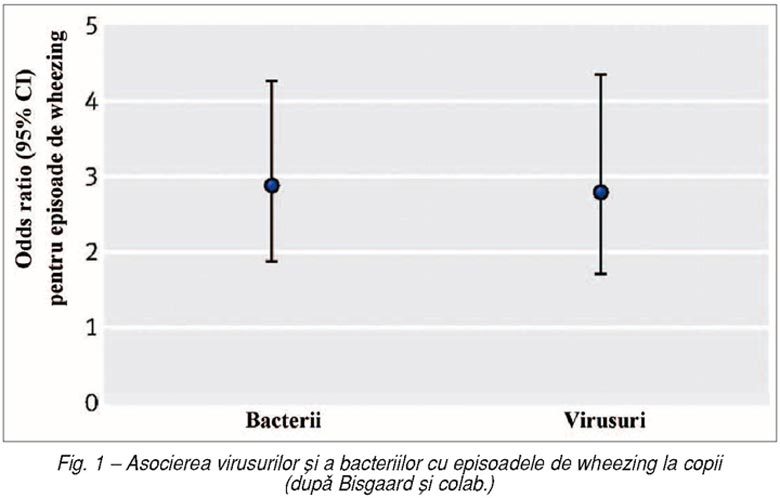
Există studii care au demonstrat o relaţie
inversă între anumite infecţii şi riscul de astm bronşic. Unele infecţii sunt
implicate în patogenia şi severitatea exacerbărilor astmului bronşic, altele au
rol de trigger şi, în sfârşit, există discuţii privind infecţiile bacteriene
protective faţă de exprimarea astmului bronşic la pacienţii cu risc. Recent,
există bazele susţinerii unor intervenţii primare în sensul protecţiei şi
diminuării riscului de astm bronşic prin intermediul microbiotei pulmonare (fig. 1). Aceste problematici se
identifică cu etapele elucidării rolului infecţiei bacteriene în declanşarea
debutului, incidenţa în creştere şi severitatea exacerbărilor.
Epiteliul pulmonar se implică în mecanismele
imune prin etape care emerg în fiecare fază a infecţiei. Celulele dendritice
epiteliale şi transepiteliale îşi activează receptorii toll-like (TLR) în contact cu bacteria şi epiteliul pulmonar secretă
IFN-1, G-CSF, MIP-2 şi KC, care recrutează polinucleare în scopul
clearance-ului agentului patogen. Celulele dendritice transepiteliale secretă
IL-23, care stimulează producţia înnăscută de IL-17 şi IL-22, ceea ce duce la
up-reglarea receptorului polimeric de imunoglobuline. Maturarea liniei celulare
B spre plasmocite are ca rezultat creşterea producţiei şi secreţiei de IgA (fig. 2). Posibilităţile implicării
imunologice cu scopul clearance-ului agentului patogen sunt diferenţiate în
funcţie de tipul infecţiei, pentru germeni intra- şi extracelulari.
Printr-un cumul de intervenţii, multe declanşate
în scop de protecţie, se realizează hiperreactivitatea căilor aeriene (fig. 3), existând riscul perpetuării
acesteia. Prin intermediul celulelor NK, se produce IL-33 şi IL-13, iar prin
intermediul celulelor natural helper se produce IL-33 şi IL-5, prin ambele căi
întreţinându-se hiperreactivitatea căilor aeriene.
Clasic relaţionate cu asocierea exacerbărilor
şi severităţii astmului bronşic au fost infecţiile cu germeni intracelulari (Mycoplasma pneumoniae şi Chlamydia pneumoniae) (fig. 4).
Mycoplasma pneumoniae este un agent
patogen recunoscut actualmente în producerea pneumoniei comunitare, dar se menţine
relaţia clasică cu astmul bronşic. Infecţia cu Mycoplasma pneumoniae poate să preceadă debutul astmului sau poate
exacerba simptomele şi acest lucru este posibil prin inducerea răspunsurilor
inflamatorii Th2 IgE-mediate. Într-un studiu realizat de Mok (4), la 4–50% din
grupul de studiu cu anamneză semnificativă de atopie, infecţia cu M. pneumoniae a declanşat
sensibilizarea alergică. În privinţa declanşării crizelor de astm bronşic,
pacienţii cu istoric pozitiv pentru pneumonia cu germeni atipici au dezvoltat
astm într-o proporţie de 55%.
Încă
din anul 2004, s-a arătat că creşterea ratei de colonizare cu Mycoplasma pneumoniae şi Chlamydia (Chlamydophila) pneumoniae
induce un răspuns imunologic prin anticorpi de tip IgA, răspuns absent la lotul
de control. După Sutherland, C.
pneumoniae joacă un rol în exacerbările acute ale astmului bronşic (5), iar
multiple studii experimentale aduc dovada că, în infecţia cu M. pneumoniae, se declanşează fenomenul
de remodelare a mucoasei bronşice, cu creşterea depozitelor de colagen în căile
aeriene. Aceste anomalii structurale pulmonare determină obstrucţia  căilor
aeriene mici, pe un interval de până la doi ani după evoluţia pneumoniei. S-a
sugerat şi s-a demonstrat că M.
pneumoniae se implică în lanţul patogenic imun de iniţiere a exacerbării.
căilor
aeriene mici, pe un interval de până la doi ani după evoluţia pneumoniei. S-a
sugerat şi s-a demonstrat că M.
pneumoniae se implică în lanţul patogenic imun de iniţiere a exacerbării.
În încercarea de a
tranşa dacă sunt implicaţi în declanşarea astmului bronşic sau consideraţi ca
factori agravanţi ai acestei boli vine existenţa anticorpilor IgE specifici
anti-Chlamydophila pneumoniae, sugeraţi
ca markeri de severitate ai astmului (6). În plus, aceşti anticorpi IgE
specifici au fost detectaţi semnificativ diferenţiat între pacienţii cu astm
bronşic intermitent (21%) şi cei cu astm bronşic persistent (62%) – p = 0,006.
Prin metode moleculare nu s-a putut însă stabili dacă prezenţa ADN C. pneumoniae ar putea fi asociată
semnificativ cu clasificarea după treptele de severitate a astmului bronşic după
ghidul GINA (Global Initiative for Asthma). Interpretarea rolului patogenic al
acestor anticorpi rămâne să fie elucidată.
Foarte recent, Patel şi colab. (7) au
raportat prezenţa ADN C. pneumoniae
în lavajul bronhoalveolar la 68% din copiii cu patologie respiratorie cronică şi
imunoglobuline specifice C. pneumoniae
la 91,9% din pacienţii cu astm bronşic.
Fenotipul astmatic poate fi corelat cu
nivelul IgE serice. Pacienţii astmatici au o creştere semnificativ mai mare a
IgE în comparaţie cu pacienţii non-astmatici. Fenotipul astmului inflamator
determinat prin lavaj bronhoalveolar arată că astmul eozinofilic are un nivel
mai mare al IgE, în comparaţie cu fenotipul non-eozinofilic. Acesta din urmă
este caracterizat prin inflamaţie neutrofilică, paucigranulocitară sau mixtă.
Un concept vechi reactualizat este cel de
„alergie bacteriană“. Germenii intracelulari determină reactivări şi
amplificarea inflamaţiei, care va impune creşterea dozelor de glucocorticoizi
sistemici sau topici. Reactivările frecvente şi infecţia cronică vor înclina
balanţa Th1/Th2 către diferenţiere Th2. În acelaşi timp, diverşi factori de
mediu – infecţioşi şi non-infecţioşi – pot modifica, de asemenea, dinamica
glucocorticoizilor. Nu numai germenii atipici sunt implicaţi în patogenia şi
evoluţia astmului bronşic.
Lipopolizaharidul bacterian ubicuitar
prezent având gena codantă a receptorului localizată pe cromozomul 5q (asociat
genelor citokinelor Th2) are un polimorfism caracteristic în relaţie cu
expresia fenotipului atopic. Preluat de receptorii toll-like, va determina o creştere a secreţiei de IL-12, IFN gamma
şi monoxid de azot, putând declanşa astfel hiperreactivitatea bronşică (fig. 5).
Astfel, vechii actori se menţin în scenă:
infecţiile cu S. pneumoniae, H. influenzae şi M. catarrhalis nu trebuie neglijate ca posibile evenimente iniţiatoare
de astm bronşic. La 20% din copiii cu wheezing s-au demonstrat anticorpi
împotriva S. pneumoniae, H. influenzae şi M. catarrhalis.
În 2007, Bisgaard, pe un studiu ce a inclus
321 de copii urmăriţi până la vârsta de cinci ani, a arătat că principalul
predictor al wheezingului recurent şi al astmului bronşic la cinci ani este
colonizarea căilor respiratorii superioare cu aceşti germeni. S. aureus nu a fost regăsit în acest
grup. Totuşi, S. aureus este
caracterizat prin certa constatare că produce enterotoxine, care pot acţiona ca
superantigene, prin activarea directă a celulelor T periferice, pe diferenţierea
Th1 şi Th2 şi în special prin capacitatea de a sintetiza IgE
enterotoxin-specifice (9). Nu este surprinzătoare această afirmaţie, deoarece
colonizarea cu acest tip de S. aureus
producător de superantigene joacă un rol important în atopie, cu toate manifestările
sale marşante: dermatita atopică, rinita alergică, astmul bronşic. Riscul
colonizării căilor aeriene superioare cu S.
aureus este încă  menţinut în atenţia cercetătorilor în relaţie cu
dezvoltarea ulterioară a astmului bronşic.
menţinut în atenţia cercetătorilor în relaţie cu
dezvoltarea ulterioară a astmului bronşic.
Răspunsurile imune în cadrul infecţiilor
bacteriene respiratorii au fost considerate cheia patogenică a exacerbării
astmului în colonizarea cu Haemophilus
şi stafilococ. Activările celulare cu producere de IgE prin intermediul
superantigenelor solubile ale S. aureus
au drept cauză diferenţierea Th2 celulară şi acest lucru a fost demonstrat
într-un studiu efectuat de Hollams, în 2010, pe 1.380 adolescenţi (10).
Discutând relaţia astmului cu infecţiile
bacteriene, trebuie să remarcăm că astmul este un factor independent de risc
pentru boala pneumococică invazivă. Intervenţia vaccinării antipneumococice în
masă reprezintă o provocare şi un proiect de studiu pentru viitor. Până la
profilaxia eficientă, posibilă pentru aceste infecţii bacteriene discutate în
prezent, este în atenţie rolul macrolidelor pentru tratamentul formelor de astm
insuficient controlat. În octombrie 2010, Sutherland a clarificat implicaţiile
clinice şi beneficiul macrolidelor în astmul bronşic, prin evaluarea ameliorării
formelor medii şi moderate de astm persistent în comparaţie cu terapia clasică
(fluticazonă). Deşi claritromicina nu a ameliorat controlul astmului şi funcţia
pulmonară, hiperresponsivitatea căilor respiratorii a fost mult îmbunătăţită
(11).
Îngrijorător, Huffnagle (2004) a demonstrat
experimental că animalele de experienţă expuse precoce la antibiotic au
prezentat perturbări imune similare astmului bronşic, comparabile cu expunerea
la sporii de mucegai. Această constatare a fost esenţială în ameţitoarea
sarabandă care a expus mereu alte idei legate de vulnerabilitatea sau rezistenţa
copiilor infectaţi vizavi de riscul pentru astm bronşic (12). Au fost primele
idei care au perpetuat ani buni faptul că expunerea la germeni în copilărie
este mai degrabă protectoare decât dăunătoare. Tratamentul cu streptomicină are
un rol limitat asupra microbiotei intestinale şi astmului, în vreme ce
vancomicina antrenează o amplă reducere a microbiotei intestinale şi poate
determina o creştere a severităţii astmului după acest tratament. Totuşi,
copiii cu wheezing persistent şi infecţie bacteriană cronică au avut un
beneficiu semnificativ în urma terapiei cu antibiotice. Rolul terapiei devine
major în astmul incipient, în fenotipul de astm infecţios, dar şi în astmul cronic stabil. Multe observaţii clinice susţin ideea că profilaxia infecţiilor
bacteriene la susceptibili diminuează riscul.
cronic stabil. Multe observaţii clinice susţin ideea că profilaxia infecţiilor
bacteriene la susceptibili diminuează riscul.
Dintre
antibiotice, macrolidele (în relaţie, evident, cu rolul germenilor
intracelulari) au un efect nu doar antiinfecţios, ci şi antiinflamator, care
teoretic aduce beneficii certe. Macrolidele şi ketolidele scad markerii
inflamatori (13), reducând TNFa, IL-5, IL-12 şi îmbunătăţind VEMS la
spirometrie. Hiperreactivitatea bronşică este cu certitudine semnificativ
ameliorată după tratamentul cu claritromicină. Având ca efect eradicarea
germenilor atipici, ca şi scăderea markerilor inflamaţiei alergice, macrolidele
prezintă cu certitudine interes pentru situaţiile care necesită terapie cu
antibiotice în astmul bronşic.
 pentru că lucrurile sunt mereu mai complexe, comportamentul imun sistemic este
corelabil cu componenţa şi dinamica microbiotei specifice, respiratorii, o altă
entitate recent individualizată, care are rol covârşitor în apariţia,
caracteristicile clinice şi evoluţia bolilor pulmonare.
pentru că lucrurile sunt mereu mai complexe, comportamentul imun sistemic este
corelabil cu componenţa şi dinamica microbiotei specifice, respiratorii, o altă
entitate recent individualizată, care are rol covârşitor în apariţia,
caracteristicile clinice şi evoluţia bolilor pulmonare. căilor
aeriene mici, pe un interval de până la doi ani după evoluţia pneumoniei. S-a
sugerat şi s-a demonstrat că M.
pneumoniae se implică în lanţul patogenic imun de iniţiere a exacerbării.
căilor
aeriene mici, pe un interval de până la doi ani după evoluţia pneumoniei. S-a
sugerat şi s-a demonstrat că M.
pneumoniae se implică în lanţul patogenic imun de iniţiere a exacerbării. menţinut în atenţia cercetătorilor în relaţie cu
dezvoltarea ulterioară a astmului bronşic.
menţinut în atenţia cercetătorilor în relaţie cu
dezvoltarea ulterioară a astmului bronşic. cronic stabil. Multe observaţii clinice susţin ideea că profilaxia infecţiilor
bacteriene la susceptibili diminuează riscul.
cronic stabil. Multe observaţii clinice susţin ideea că profilaxia infecţiilor
bacteriene la susceptibili diminuează riscul.