Malaria constituie o problemă prioritară de
sănătate publică, situându-se printre primele cinci boli care au impactul cel
mai înalt la mortalitatea globală (1). Este afecţiunea cea mai răspândită în
zonele tropicale şi cea mai frecventă boală de import în zonele nonendemice.
Unii cercetători cred că îşi are originea în Africa, cu aproximativ 30 de
milioane de ani în urmă (2). O descriere vagă a unei boli asemănătoare malariei
apare în scrierile antice religioase şi medicale din Egipt, China, Asiria şi
India. Primele informaţii concrete sunt datate de pe vremea lui Hipocrate, în
secolul 5 î.Hr., când acesta descrie în detaliu forma clinică şi câteva
complicaţii ale bolii. Se crede că malaria nu ar fi existat în emisfera vestică
înainte de descoperirea continentului american de Columb, şi că ea ar fi fost
adusă în acest teritoriu de coloniştii spanioli şi de sclavii africani (2).
În jurul anului 1880, la aproximativ 2.000
de ani de la prima descriere a bolii, chirurgul francez Charles Louis Alphonse
Laverau (1845–1922) descrie pentru prima dată în sângele uman parazitul ce
provoacă boala. Iniţial nu s-a acordat credibilitate descoperirii sale, dar
odată cu avansarea microscopiei optice, şi alţi cercetători au observat acelaşi
parazit. Ca urmare, în 1907, i s-a acordat pentru aceasta premiul Nobel (2, 3).
Cele mai importante date referitoare la
existenţa unor epidemii de malarie apar în timpul celor două războaie mondiale.
Imediat după Primul Război Mondial a izbucnit în Rusia o epidemie de malarie,
iar un număr important de cazuri s-au înregistrat în Marea Britanie, Franţa,
Germania şi Italia. În perioada interbelică, creşterea economică şi dezvoltarea
socială ce a avut loc în Europa, SUA şi o parte a Asiei, precum şi descoperirea
chininei au determinat o scădere considerabilă a numărului de cazuri de
malarie. În timpul celui de-al Doilea Război Mondial, soldaţii au fost cei care
au favorizat transmiterea speciilor de P.
vivax, P. falciparum şi P. malariae în
Europa şi SUA. Totuşi, intensitatea epidemiilor nu a mai fost atât de mare ca
după Primul Război Mondial şi acest lucru se datorează în special
chimioprofilaxiei şi existenţei DDT-ului. După al Doilea Război Mondial s-au
folosit din ce în ce mai frecvent insecticidele şi antimalaricele de sinteză,
ceea ce a determinat practic eradicarea malariei din vestul şi centrul Europei,
SUA, Japonia şi din nordul şi centrul Rusiei.
În ciuda eforturilor internaţionale, malaria
rămâne una din principalele cauze de deces în zonele tropicale, mai ales în
rândul copiilor. Aproximativ jumătate din populaţia planetei trăieşte în zone
cu risc pentru malarie, iar în 2008 s-au raportat 243 de milioane de cazuri de
malarie, cu 865.000 de decese. Conform datelor OMS, malaria afectează peste 100
de ţări, iar în ultimii ani numărul de îmbolnăviri a crescut considerabil.
Situaţia este mai alarmantă din cauza cazurilor de import apărute în unele ţări
prospere economic precum Marea Britanie, Franţa şi Germania (4).
Bolile infecţioase cu origine în zonele
tropicale sunt prezente şi în România, cu o tendinţă de creştere în ultimii
ani, din cauza accentuării mobilităţii populaţiei şi neaplicării măsurilor de
profilaxie. În România, malaria era prezentă în urmă cu 50–60 de ani în zonele
din sudul ţării şi în zonele mlăştinoase (de exemplu, în 1948 au fost raportate
333.198 de cazuri). Încălzirea climatică globală poate duce la reacomodarea
vectorilor specifici în spaţiul nostru geografic, ceea ce poate creşte riscul
reapariţiei acestei boli ca boală autohtonă (5).
Etiologie
Agentul etiologic este un parazit aparţinând
genului Plasmodium. Genul Plasmodium cuprinde peste 125 de specii
ce infectează reptilele, păsările şi mamiferele. Aceste specii sunt împărţite
în zece subgenuri (1). Speciile care afectează omul sunt cuprinse în două
subgenuri: Leverania (care cuprinde Plasmodium falciparum) şi subgenul Plasmodium (care cuprinde P. malariae, P. vivax, P. ovale). Recent,
parazitul de origine simiană P. knowlesi a
determinat cazuri umane în sudul Asiei (6).
Acestea
sunt protozoare intracelulare cu o fază de multiplicare asexuată (schizogonică)
în gazda umană şi o fază sexuată (sporogonică) la insecta vector, care e şi
gazda definitivă (7).
La om, sporozoiţii sunt inoculaţi prin înţepătura
de ţânţar împreună cu saliva acestuia, ducând la dezvoltarea ciclului
exoeritrocitar. De la locul de inoculare, sporozoiţii trec în sânge, ajung la
ficat unde se multiplică şi dezvoltă merozoiţi. După ce se produce
multiplicarea  intracelulară, membrana hepatocitului se rupe şi merozoiţii sunt
eliberaţi în circulaţie. În hepatocitele omului, sporozoiţii speciilor de P. vivax şi P. ovale pot persista sub formă de hipnozoiţi, maturându-se mai
târziu şi ducând la recăderi.
intracelulară, membrana hepatocitului se rupe şi merozoiţii sunt
eliberaţi în circulaţie. În hepatocitele omului, sporozoiţii speciilor de P. vivax şi P. ovale pot persista sub formă de hipnozoiţi, maturându-se mai
târziu şi ducând la recăderi.
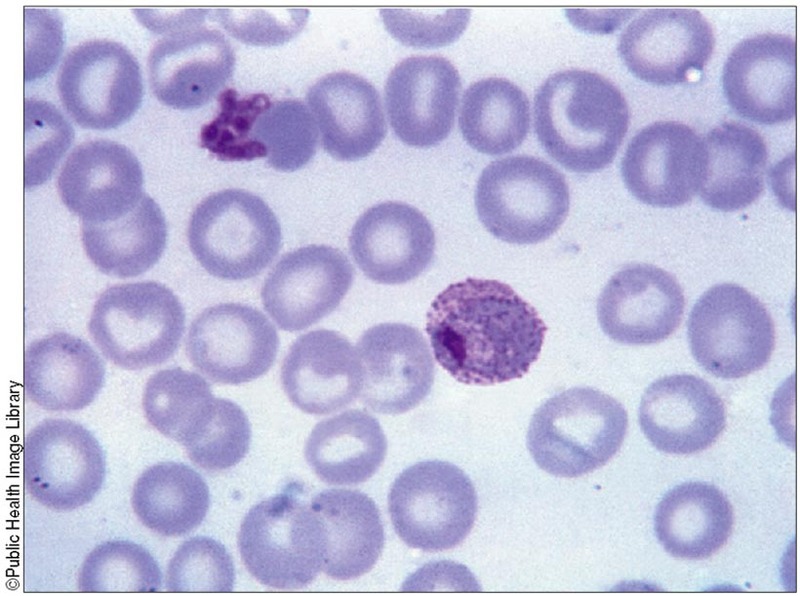
După ce merozoiţii au invadat hematiile,
începe ciclul eritrocitar ce are ca rezultat formarea trofozoiţilor şi a
schizonţilor. Hematiile care conţin schizonţi maturi se dezintegrează şi
eliberează merozoiţi ce infectează alte hematii. Acest ciclu variază în funcţie
de specie. Unii merozoiţi, după mai multe cicluri se pot transforma în gametociţi
(macrogametociţi – feminin şi microgametociţi – masculin), constituind stadiul
iniţial al fazei sexuate.
Ciclul sporogonic se desfăşoară la ţânţar
după o masă hematofagă. Gametociţii vor forma în stomacul ţânţarului un zigot,
ce se transformă în oochinet şi oochist, de unde sunt eliberaţi sporozoiţi.
Sporozoiţii ajung în glandele salivare ale ţânţarului care devine astfel
infectat (7, 8).
Polimorfismul speciilor de Plasmodium, modificarea permanentă a
epitopilor de suprafaţă şi instalarea rezistenţei la antimalaricele clasice fac
extrem de dificilă tentativa de a eradica boala, mai ales că producerea unui
vaccin nu a avut încă rezultatul aşteptat (1, 9).
Sursa
Sursa este reprezentată de omul bolnav sau
purtător de gametociţi.
Omul poate prezenta gametocitul în sânge, o
perioadă variabilă de timp, în funcţie de tipul de plasmodium cu care a avut loc infecţia şi în funcţie de tratamentul
urmat. La persoanele netratate, gametociţii persistă în sânge unu-doi ani
pentru P. falciparum, în timp ce
pentru P. malariae ei pot persista
peste 30 de ani, chiar toată viaţa (1, 9).
Căi şi mecanisme de transmitere
Direct: verticală – transplacentar
doar la primiparele neimune care prezintă anomalii placentare (8).
Indirect:prin înţepătura femelei de ţânţar Anophelessau prin inocularea de la o persoană infectată prin transfuzii de sânge,
transplant medular, prin ace şi seringi contaminate.
Există aproximativ 430 de specii de ţânţari
anofeli, dar doar 60 din aceştia sunt vectori pentru malarie. Cei mai importanţi
vectori sunt: A. gambiae (A. gambiae, A.
arabiensis, A. melas, A. merus, A. bwambae şi A. quadriannulatus) şi A.
funestus (10).
În malaria posttransfuzională este
incriminat cel mai frecvent P. malariae.
Transmiterea prin ace şi seringi poate fi
întâlnită la toxicomanii ce utilizează droguri injectabile (8, 9).
Receptivitate
Receptivitatea este generală, toate
persoanele indiferent de vârstă sau de sex fiind susceptibile să dezvolte boala.
Există o serie de aspecte particulare care sunt legate de rezistenţa faţă de
unele tipuri de malarie precum: • grupurile etnice din
populaţia de culoare din Africa (aceştia nu prezintă antigen eritrocitar –
factorul Duffy – care este necesar invadării hematiei de P. vivax) •persoanele cu hemoglobine anormale (hemoglobinoză S, C, G,
E; talasemii) – nu dezvoltă forme severe • eritrocitele sub formă de
seceră, ovalocitele •anomaliile genetice (deficitul de glucozo-6-fosfat
dehidrogenază) – oferă protecţie împotriva formelor severe de malarie cu P. falciparum (9).
Receptivitatea mai poate fi influenţată de
funcţia splinei, care are rol imunologic, dar şi de filtru pentru eritrocitele
parazitate, care devin sferice şi pe care le îndepărtează, scăzând parazitemia.
Persoanele splenectomizate dezvoltă forme rapid progresive (8).
Anumite grupuri populaţionale, în special
copiii de vârste mici şi femeile însărcinate, prezintă un risc particular şi
infecţia poate avea consecinţe serioase (9). La o femeie însărcinată creşte
riscul de deces matern, avort spontan, naşterea unui făt mort, greutate mică la
naştere şi deces neonatal. Pentru copiii cu vârste mici, infecţia cu P. falciparum este o urgenţă medicală
deoarece se poate ajunge foarte rapid la deces, mai ales că primele simptome
sunt atipice şi dificil de recunoscut, iar complicaţiile severe pot apărea în
câteva ore de la debutul simptomatic (11).
Malaria nu este o cauză frecventă de deces
în cazul copiilor sub şase luni în zonele endemice, datorită protecţiei
dobândită transplacentar, dar şi altor factori biologici. Cu toate acestea, după
vârsta de şase luni, copiii neprotejaţi suferă atacuri repetate şi grave, care
devin mai blânde pe măsură ce cresc în vârstă. În toate zonele cu endemicitate
mare a malariei, incidenţa cea mai mare este la copiii mici (sub vârsta de doi
ani), cu o medie de două-şase atacuri pe an. Ulterior, atât incidenţa, cât şi
severitatea bolii scad considerabil (10, 11).
Factori naturali
Ciclul de viaţă al ţânţarului anofel depinde de temperatură, umiditate, dar şi
de capacitatea de a procura sânge. Preferă să se hrănească cu sânge uman sau
animal, masculii se mai pot hrăni şi cu nectar şi diverse surse de zahăr; în
timp ce femelele au nevoie de sânge pentru dezvoltarea şi maturarea ouălor (8).
Ţânţarul Anopheles
gambiae există doar în regiunile în care temperatura minimă din timpul
iernii este de peste 5°C. Temperatura optimă de dezvoltare este de 18–22°C
pentru o perioadă de una-patru luni consecutive. El preferă zonele cu precipitaţii
şi nu se înmulţeşte în condiţii de secetă, observându-se un vârf al
transmiterii în perioadele ploioase (9, 10).
• Geografici
Malaria este întâlnită pe glob de la 45°
latitudine nordică până la 40° latitudine sudică.
Ţânţarul Anopheles preferă solurile umede
(terenurile mlăştinoase, orezării sau culturi de trestie de zahăr), abundenţa
florei şi a faunei.
În zonele temperate, anofelii se înmulţesc numai în sezonul cald, în
zona ecuatorială sunt întâlniţi în permanenţă, iar în zona tropicală înmulţirea
este maximă în sezonul ploios şi încetează în sezonul uscat. O altitudine de
peste 1.500 m scade riscul întâlnirii ţânţarilor anofeli datorită condiţiilor nefavorabile pentru dezvoltarea acestora (8).
Factori economico-sociali
• Factori ocupaţionali
În unele zone (sud-estul Asiei şi în America
de Sud), transmiterea malariei poate fi asociată cu o serie de activităţi,
fiind mai frecvent întâlnită la tăietorii de lemne sau minerii din zonele de pădure
(9).
• Standard
economic
Dezvoltarea socio-economică a influenţat şi
ea transmiterea malariei. Dezvoltarea agriculturii, îmbunătăţirea locuinţelor şi
prelucrarea terenurilor a redus transmiterea malariei. Mai mult, dezvoltarea
serviciilor de sănătate publică a redus şi va reduce morbiditatea şi
mortalitatea indusă de malarie. Nivelul venitului pe familie s-a dovedit că
influenţează direct achiziţionarea şi utilizarea prelungită a plaselor de ţânţari
(9, 10).
• Grad
de cultură şi educaţie
Diferenţele culturale între grupurile etnice
contribuie la diferenţele în ceea ce priveşte riscul de malarie (prin diferenţele
de expunere sau prin diferenţe în materie de comportament preventiv) (8, 10).
Unul din cei mai importanţi determinanţi ai
comportamentului uman şi ai bagajului de cunoştinţe este nivelul de educaţie,
considerat un indicator pentru statutul socio-economic al unei populaţii. Cunoştinţele
legate de faptul că ţânţarul transmite malaria cresc odată cu nivelul educaţiei, iar bărbaţii sunt mult mai
informaţi despre cauzele malariei decât femeile. Nivelul educaţional redus
poate duce la refuzul chimioprofilaxiei, care favorizează cazurile de import
(10).
• Aglomeraţie
Aglomerările urbane cresc riscul
transmiterii bolii; în zonele urbane sunt mult mai des folosite măsurile de
profilaxie primară precum plasele de ţânţari sau insecticidele (8, 10).
• Mişcările
populaţionale
Migrarea populaţiei neimune în zone
endemice, precum şi migrarea parazitului în zone nonendemice pot duce la
epidemii de malarie. Acest aspect se referă la zone în care există vectori
anofeli, dar şi alţi factori climatici şi ecologici care pot influenţa
transmiterea bolii (8, 9, 10).
Răspândire
Malaria este o boală foarte gravă şi
frecvent întâlnită în zonele cu climă tropicală, dar apare sub forma unor
cazuri sporadice (de import) şi în zonele temperate. OMS a declarat-o ca fiind
o problemă de sănătate publică în aproximativ 100 de ţări de pe glob. S-a
estimat că incidenţa malariei este de aproximativ 300–500 de milioane de cazuri
noi anual, 90% din ele în ţările africane. Mortalitatea cauzată de această boală
variază între 1,5 şi 2,7 milioane de decese anual, iar numărul de purtători ai
parazitului depăşeşte 300 de milioane (12).
Până în 1968, ca urmare a eforturilor
internaţionale, malaria a fost eradicată din Europa (în Spania a fost eradicată
în 1964), Rusia, Tunisia, Libia, Israel, Iordania, Coreea, Insulele Caraibe
(mai puţin Haiti), Australia, Mauritius, Taiwan, Argentina şi sudul Africii
(13). În acea perioadă, prima specie care a dispărut a fost P. falciparum.
Criza economică din anii ’70 a determinat o
scădere a eficacităţii luptei împotriva malariei, cauzată de faptul că preţurile
insecticidelor (precum DDT) şi ale medicamentelor deveneau tot mai inaccesibile.
Ca urmare, a apărut o creştere a numărului de cazuri, majoritatea cu P. vivax, în Asia şi America Latină, în ţări
în care malaria nu fusese complet eradicată.
În prezent, în Africa subsahariană, malaria
reprezintă o problemă majoră de sănătate publică. Se estimează că numărul
cazurilor care apar anual variază între 270 şi 480 de milioane, din care
140–280 de milioane la copii cu vârsta sub cinci ani. Trebuie ţinut însă seama
că numărul cazurilor raportate este mult mai mic faţă de numărul cazurilor existente.
În zonele mediteraneene estice, un grup de
state dintre Maroc şi Pakistan au aproximativ 45% din populaţie într-o zonă cu
risc de infecţie cu P. falciparum sau P. vivax. 15% din locuitorii acestor
zone pot face malarie doar cu P. vivax. Se
estimează că aproximativ 13 milioane de noi cazuri apar anual în aceste regiuni
şi majoritatea cu P. falciparum.
În ţări ca Irak, Maroc şi Siria, P. falciparum a fost eradicat, dar rămâne
totuşi infecţia cu P. vivax.
Chiar şi în secolul XXI, malaria reprezintă
o problemă pe continentul american, deşi în multe zone numărul real de îmbolnăviri
nu este raportat, iar la nivel global, incidenţa bolii pe continent nu pare
foarte ridicată. În Brazilia sunt raportate mai puţin de jumătate din cazuri,
iar în Bolivia, Columbia, Ecuator, Peru, Venezuela, doar o treime din cazuri.
Infecţia cu P. falciparum apare doar
în 30% din cazurile din Bolivia, Ecuator, Guyana Franceză, Guatemala, Mexic,
Peru şi Venezuela şi în peste 60% din cazuri în Brazilia.
În raportările OMS privind malaria în
sud-estul Asiei, se menţionează 2,6–2,7 milioane de noi cazuri anual, iar India
deţine peste 80% din numărul acestora. Şi aici numărul cazurilor se presupune că
este de şase-şapte ori mai mare decât ceea ce este raportat. Majoritatea
cazurilor apar în zonele împădurite şi deluroase. Combaterea malariei este
dificilă şi din cauza multirezistenţei la tratament şi este frecvent întâlnită
în Thailanda şi Cambogia.
În
estul Asiei şi vestul Pacificului raportările arată o incidenţă de 20% a infecţiei.
Ţări ca Australia, Coreea, Hong-Kong, Japonia, Macao, Mongolia, o parte a
Chinei şi Oceaniei au realizat eradicarea malariei. Cazurile semnalate în
această parte a globului au fost înregistrate în Vietnam, Insulele Solomon,
Thailanda şi Myanmar.
Malaria
reprezintă una din principalele cauze de deces în Cambodgia (5.000–10.000
decese/an), Laos (14.000 decese/an) şi Vietnam (15.000 de decese/an).
Nivelul
rezistenţei P. falciparum la
medicamente (ex. clorochină, sulfadoxină şi pirimetamină) este foarte ridicat.
Europa a fost declarată „liberă de malarie“
de OMS în 1975. Totuşi, mai există cazuri, majoritatea de import, ca urmare a
emigraţiei şi călătoriilor în zonele cu risc (14, 15). Cazuri sporadice,
autohtone au fost înregistrate în ultimii ani în Spania (octombrie 2010, în
regiunea Aragon) (13), Grecia (în regiunea Lakonia, şase cazuri în 2009; 20 de
cazuri în regiunile Evrotas şi Lakonia, în 2011) (16, 17). De asemenea, au mai
fost înregistrate aşa-numitele cazuri „de aeroport“ sau „malaria de bagaje“ (75
de cazuri în perioada 1977–1999).
În 2010, în Europa au fost raportate 6.759
de cazuri în 27 de ţări, cu o incidenţă de 0,99 cazuri la 100.000 de locuitori.
Cele mai înalte rate au fost în Marea Britanie, Luxemburg, Irlanda şi Belgia.
Zece cazuri au fost indigene, opt în Grecia şi două în Spania (18). Riscul de
extindere a transmiterii malariei în Europa în prezent este considerat scăzut,
dar este nevoie de întărirea supravegherii şi a măsurilor de prevenire şi
control.
În România,
începând cu 1961, transmiterea naturală a fost întreruptă, iar din 1963 ne aflăm
în faza de întreţinere a eradicării malariei.
Cazurile de malarie din ultimii ani au fost
cazuri de import, la persoane care au călătorit în zone endemice de malarie.
Apariţia acestora este posibilă prin creşterea numărului de călătorii în scop
profesional sau turistic şi/sau nerespectării măsurilor de prevenire, respectiv
chimioprofilaxia şi măsurile individuale de protecţie împotriva ţânţarilor.
Malaria, fiind boală prioritară, beneficiază
de un sistem de supraveghere epidemiologică a cazurilor umane şi a populaţiilor
de ţânţari vectori, care trebuie menţinut şi îmbunătăţit, având în vedere că
există o serie de factori (prezenţa populaţiilor de vectori Anopheles, fenomenul de încălzire globală,
creşterea rezistenţei vactorilor la insecticide) care, fără un control adecvat,
pot reintroduce malaria ca boală endemică în Europa, inclusiv în România.
În perioada 2007–2012 au fost raportate 140
de cazuri, toate de import (24 de cazuri în 2007, 13 cazuri în 2008, 12 cazuri
în 2009, 19 cazuri în 2010, 40 de cazuri în 2011 şi 32 în 2012) şi trei decese
(unul în 2007 – un bărbat de 40 de ani infectat în Uganda şi care a prezentat o
formă toxică de malarie cu P. falciparum şi
două decese în 2011 – o femeie de 60 de ani cu poliartrită reumatoidă şi
malarie cu P. falciparum infectată în
Ghana şi un bărbat de 24 de ani, care s-a prezentat şi a fost diagnosticat
tardiv cu malarie cu P. falciparum, infectat
în Nigeria).
În majoritatea cazurilor, infecţia s-a
produs pe continentul african, scopul călătoriei a fost unul profesional, iar
cei mai mulţi bolnavi nu au urmat niciun fel de profilaxie (19, 20, 21, 22,
23).
Profilaxie şi control
Profilaxia primară. În
ţările în care malaria a fost eradicată, se iau măsuri de supraveghere şi
control care se adresează populaţiilor de ţânţari vectori şi persoanelor care
au fost sau vor fi expuse la agentul infectant sau care se întorc din zone
endemice.
Se impune depistarea tuturor pacienţilor cu
malarie, efectuarea unui tratament corect şi excluderea lor din lista potenţialilor
donatori de sânge.
Măsuri de combatere a vectorilor: drenajul şi
desecarea apelor, pulverizarea de insecticid sau, ca metodă biologică – peştii
larvarofagi.
Cea mai eficientă profilaxie este evitarea
înţepăturilor de ţânţari prin aplicarea la nivelul tegumentelor de substanţe
respingătoare pentru ţânţari, folosirea sprayurilor cu insecticid în încăperi,
acoperirea zonelor expuse ale corpului, folosirea de plase impregnate cu
insecticid.
Chimioprofilaxia cu antimalarice se recomandă
persoanelor care călătoresc în zonele de risc, începe cu aproximativ una-două săptămâni
înainte de intrarea în zona endemică şi se continuă încă patru săptămâni după părăsirea
zonei. Trebuie supravegheată rezistenţa la antimalarice în zonele respective.
Trebuie menţionat faptul că protecţia
asigurată prin chimioprofilaxie nu este totală, putând să apară semne ale infecţiei
la şase-opt zile după înţepătura ţânţarului sau chiar la câteva luni.
Se lucrează în prezent la realizarea unui
vaccin antimalaric, dar ciclul de viaţă complex şi materialul genetic al
parazitului sunt motivele pentru care un vaccin eficient nu a fost încă
realizat (24).
Profilaxia secundară se efectuează
la apariţia primelor forme de boală şi constă în autoadministrarea de pacient
de combinaţia atovaquone + proguanil hidroclorid, meflochină, doxiciclină,
primachină, proguanil, clorochină (24).
Profilaxia terţiară impune diagnosticul şi terapia corectă
a tuturor cazurilor, astfel pentru P.
falciparum se realizează terapia malariei severe iar în infecţia cu P. vivax şi P. ovale se realizează terapia corectă pentru prevenirea recăderilor
şi complicaţiilor, ca limfomul Burkitt.
Cazurile de malarie confirmate se declară
nominal şi se supraveghează timp de doi ani de la data diagnosticării,
efectuându-se controale hematologice dacă apare un sindrom febril.
Tabelul 1 prezintă recomandările OMS privind
tipul de profilaxie care ar trebui efectuată în funcţie de riscul de malarie,
iar tabelul 2, lista ţărilor cu risc de infecţie cu Plasmodium (25).
Autorităţile de sănătate publică trebuie să
intensifice informarea populaţiei cu privire la riscul şi metodele de prevenire
a malariei şi a altor boli transmise prin vectori.
După terminarea călătoriei, la întoarcere,
mai ales dacă deplasarea a avut loc în zone tropicale sau subtropicale cunoscute
cu incidenţe ridicate ale diverselor boli transmisibile, este necesară
efectuarea unui examen medical de specialitate şi a unor investigaţii de
laborator, chiar în lipsa semnelor de boală.
|
Tabelul 1
Tipurile de prevenţie pentru infecţia cu Plasmodium
Riscul de malarie Tipul de prevenţie
Tipul I – Risc foarte limitat de transmitere – Prevenirea înţepăturilor de ţânţari
a malariei
Tipul II – Risc de infecţie doar cu P.
vivax – Prevenirea înţepăturii de ţânţari
– Risc de infecţie cu P. falciparum – Chimioprofilaxie
cu clorochine
sensibil la clorochine
Tipul III – Risc de infecţie cu P. vivax şi – Prevenirea înţepăturii de ţânţar
P.
falciparum combinat cu –
Chimiotrofilaxie cu clorochine +
rezistenţă la clorochine proguanil
Tipul IV – Risc crescut de infecţie cu –
Chimioprofilaxie cu proguanil,
P.
falciparum combinat cu doxiciclină
sau meflochine (aleasă
rezistenţă la antimalarice în raport cu patternul rezistenţei)
– Risc scăzut/moderat de infecţie
cu P.
falciparum combinat cu un
nivel crescut de rezistenţă la medicamente
*Sursa: World Health Organization.
International travel and health, 2011. Lista ţărilor privind recomandările
pentru malarie (25).
|
 intracelulară, membrana hepatocitului se rupe şi merozoiţii sunt
eliberaţi în circulaţie. În hepatocitele omului, sporozoiţii speciilor de P. vivax şi P. ovale pot persista sub formă de hipnozoiţi, maturându-se mai
târziu şi ducând la recăderi.
intracelulară, membrana hepatocitului se rupe şi merozoiţii sunt
eliberaţi în circulaţie. În hepatocitele omului, sporozoiţii speciilor de P. vivax şi P. ovale pot persista sub formă de hipnozoiţi, maturându-se mai
târziu şi ducând la recăderi.