Cu o prevalenţă de 21 de cazuri la 100.000
de locuitori (1), hiperparatiroidismul primar este cea mai frecventă cauză de
hipercalcemie. Vârsta medie la diagnostic este de 50 de ani iar femeile sunt de
trei ori mai afectate decât bărbaţii. În 85% din cazuri, hiperparatiroidismul
apare consecutiv unui adenom paratiroidian benign unic. În aproape 15% din
cazuri, există afectare pluriglandulară prin adenoame multiple sau hiperplazie
paratiroidiană (2). Carcinomul paratiroidian este o cauză rară de
hiperparatiroidism primar.
Tabloul clinic complet asociat cu prezenţa
hipercalcemiei cuprinde semne ale afectării renale (nefrolitiază, nefrocalcinoză,
poliurie-polidipsie, retenţie azotată), osoase (osteoporoză sau forma severă
cu resorbţie osoasă localizată, numită osteitis fibrosa chistica), digestive
(constipaţie, greaţă, risc de ulcer gastric şi pancreatită acută), sistemului
nervos central (depresie, fatigabilitate), cardiace (HTA, bradicardie, QT
scurt) şi altele (miopatie proximală, keratopatie în bandă). În prezent,
datorită includerii calciului în testele de screening ce se efectuează în
cadrul oricărui examen medical, diagnosticul hipercalcemiei se pune rapid, înainte
de apariţia complicaţiilor. De aceea, pacienţii sunt, de cele mai multe ori,
asimptomatici.
Hipercalcemia familială constituie un grup
de afecţiuni de cauză genetică ce se caracterizează prin debut la vârstă în
general tânără şi frecventă afectare pluriglandulară paratiroidiană. Cuprinde
hiperparatiroidismul primar (sindroamele MEN1 şi MEN2A, hiperparatiroidismul
primar asociat cu tumoră maxilară, hiperparatiroidismul familial izolat) şi
alterarea răspunsului paratiroidelor la fluctuaţiile calciului extracelular
(hipercalcemia familială hipocalciurică şi hipercalcemia neonatală severă).
Sindromul
MEN1, cu transmitere autozomal dominantă cu penetranţă genetică aproape
100% până la vârsta de 50 de ani (3, 4), afectează ambele sexe în egală măsură.
95% din pacienţi prezintă hiperparatiroidism (5) care este frecvent prima
manifestare a bolii şi apare prin hiperplazie paratiroidiană multiplă. Asociază
tumori ale pancreasului endocrin, ale adenohipofizei, dar şi ale
corticosuprarenalei, precum şi tumori carcinoide (3). Sindromul este rezultatul
inactivării meninei, un supresor tumoral a cărui genă a fost localizată prin
clonare poziţională (6, 7) pe cromozomul 11q13.
Mutaţii somatice şi germinale au fost
identificate la 12–20% din pacienţii cu adenom paratiroidian sporadic şi la
peste 90% din familiile cu MEN1. De la descoperirea ei până în prezent, au fost
raportate peste 100 de mutaţii germinale ale genei MEN1. Mutaţii missense, nonsense, frameshift şi
defecte de splicing ARNm apar atât la
nivelul exonilor, cât şi al intronilor. Tipul mutaţiei nu se asociază cu un anumit
fenotip al bolii, însă acelaşi tip de mutaţie este prezent la toţi membrii unei
familii afectate. La aproximativ 10% din familiile afectate, nu s-a detectat
mutaţia meninei, probabil pentru că aceasta este localizată în afara regiunii
din gena MEN1 testate uzual.
În prezent, testarea genetică este constant
utilizată pentru confirmarea diagnosticului clinic (3).
Sindromul
MEN2A este transmis autozomal dominant cu penetranţă genetică 95%.
Hiperparatiroidismul primar prin hiperplazie paratiroidiană poliglandulară
apare doar la 25% din cazuri (5), carcinomul medular tiroidian şi
feocromocitomul fiind manifestări frecvente ale sindromului. Poate asocia
amiloidoză cutanată licheniformă şi boala Hirschprung. Este determinat de mutaţia
germinală activatoare a protooncogenei RET localizate la nivelul cromozomului
10q11.2 (9). Oncogena RET codifică un receptor tirozin-kinazic a cărui
stimulare promovează proliferarea celulară. Când este afectat codonul 634 al
genei RET, incidenţa hiperparatiroidismului este maximă (10).
Hiperparatiroidismul
primar asociat cu tumoră maxilară (HPT-JT) este un sindrom ce se
caracterizează prin asocierea hiperparatiroidismului cu tumora fibro-osoasă a
maxilarului sau a mandibulei şi, ocazional, cu leziuni renale (tumoră Wilms, rinichi
polichistic, hamartom renal) (8). Se transmite autozomal dominant cu penetranţă
genetică de 70%, mai redusă în cazul femeilor purtătoare ale mutaţiei genetice
(12). De regulă, adenomul paratiroidian este unic, dar poate fi multiplu sau
chistic. Spre deosebire de sindroamele MEN, în care leziunile paratiroidiene
sunt benigne, HPT-JT se asociază cu risc crescut de carcinom paratiroidian:
15–20% din cei afectaţi (13, 14). Inactivarea genei HRPT2 (hyperparathyroidism 2 gene), numită şi CDC73 (cell division cycle 73), localizată la nivelul cromozomului 1q25,
prin mutaţii sau pierderea heterozigozităţii (LOH) este cauza acestui sindrom şi
a unui subgrup de cazuri de hiperparatiroidism familial izolat, la care au fost
evidenţiate mutaţii germinale ale HRPT2. Asocierea unei mutaţii somatice
inactivatoare a alelei restante duce la pierderea heterozigozităţii cu
inactivarea ambelor copii ale genei supresorului tumoral numit parafibromină
(15–17), situaţie identificată la pacienţii cu HPT-JT sau hiperparatiroidism
familial  izolat care dezvoltă carcinom paratiroidian.
izolat care dezvoltă carcinom paratiroidian.
Asocierea frecventă a mutaţiei HRPT2 cu
neoplazia paratiroidiană o face să fie un important marker de tumori
paratiroidiene agresive sau maligne.
Hipercalcemia
hipocalciurică familială benignă este un sindrom transmis autozomal
dominant şi care apare prin deplasarea la dreapta a set-point-ului receptorului pentru calciu (CaR).
CaR este abundent exprimat în glandele
paratiroide şi în tubii renali, unde joacă un rol esenţial în menţinerea normală
a calciului extracelular. Activarea lui de către calciul ionic duce la creşterea
secreţiei de PTH şi a calciuriei. Funcţia lui poate fi alterată prin mutaţii
inactivatoare sau prin reducerea expresiei sale la nivel membranar. Gena CaR
este localizată pe cromozomul 3q13.3-q21. Au fost descrise peste 150 de mutaţii
inactivatoare ale acesteia: majoritatea missense,
dar şi nonsense, inserţie, deleţie/inserţie.
Mutaţiile somatice ale acesteia nu sunt implicate în tumorigeneza paratiroidiană.
Mutaţii germinale au fost identificate la câteva familii cu hiperparatiroidism
familial izolat.
În forma heterozigotă, hipercalcemia
moderată non-progresivă prezentă de la naştere se asociază cu calciurie scăzută
şi PTH inadecvat crescut. Este important de recunoscut clinic, deoarece nu
necesită intervenţie chirurgicală. Este un sindrom heterogen din punct de
vedere genetic, fiind evidenţiate mutaţii ale unor gene cu locusuri diferite:
3q13, 19p, 19q (18) etc.
Forma homozigotă este rară, dar cu potenţial
letal, nou-născuţii prezentând hipercalcemie severă, simptomatică, concentraţii
mult crescute de PTH, hipotonie şi detresă respiratorie. Se numeşte hiperparatiroidism primar neonatal sever (19).
Tratamentul constă în paratiroidectomie totală de urgenţă.
Hiperparatiroidismul
familial izolat este rar întâlnit, se transmite autozomal dominant, având o
penetranţă redusă. Constă în: hipercalcemie, PTH seric crescut. Din punct de
vedere histopatologic, au fost descrise două entităţi: hiperplazie sau adenoame
paratiroidiene multiple; adenom paratiroidian unic, posibil carcinom (12).
Genetic, hiperparatiroidismul familial
izolat este un sindrom heterogen. Nu a fost identificată încă o anomalie
genetică specifică (13), dar mutaţii descrise în celelalte forme de
hipercalcemie familială se întâlnesc şi în unele cazuri de hiperparatiroidism
familial izolat, putând fi considerate fie forme moderate, cu penetranţă
incompletă, fie stadii precoce ale sindroamelor mai sus-menţionate. Mutaţii la
nivelul locusului HRPT2 (CDC73) al cromozomului 1q21-q32, evidenţiate în unele
cazuri caracterizate prin adenoame paratiroidiene unice, cu componentă chistică
(probabil variante ale sindromului HPT-JT) (22, 26). Mutaţie a meninei diferită
de cea din sindromul MEN1, determinând un sindrom caracterizat prin afectare
multiglandulară (23), dar cu evoluţie clinică adesea favorabilă (probabil
variantă a sindromului MEN1). La cazurile de hiperparatiroidism familial izolat
cu mutaţie MEN1 analizate genetic, 41% au avut mutaţii missense şi 37% mutaţii nonsense
sau frameshift ce duc la apariţia de
proteine truncate. În contrast, dintre familiile cu sindrom MEN1, mai puţin de
20% prezintă mutaţii missense. Mutaţia
receptorului pentru calciu a fost identificată la cinci familii cu
hiperparatiroidism primar familial izolat (27), pe principiul: o genă – mai
multe sindroame. Mutaţiile receptorului de calciu în zona 3q sunt asociate cu
fenotip variabil al homeostaziei calciului, forma homozigotă putând determina
adenoame paratiroidiene (4, 18, 24). O nouă mutaţie inactivatoare a
receptorului pentru calciu a fost descrisă la unele familii cu hipercalcemie şi
hipercalciurie (25), la care inactivarea receptorului la nivel renal este slab
pronunţată, permiţând menţinerea mecanismului compensator renal al
hipercalcemiei de creştere a eliminării urinare de calciu (25).
Diagnosticul se pune prin excluderea
celorlalte forme de hipercalcemie familială, fiind utilă, în funcţie de
contextul clinic, testarea pentru mutaţii ale genelor meninei, proto-oncogenei
RET, a receptorului pentru calciu (13) şi, mai ales, a genei HRPT2, deoarece
mutaţia acesteia se asociază cu risc crescut de carcinom paratiroidian (20,
21).
Diagnosticul diferenţial poate fi uneori
dificil, deoarece o parte dintre pacienţii diagnosticaţi iniţial cu
hiperparatiroidism familial izolat dezvoltă ulterior şi celelalte componente
ale sindromului MEN1. De aceea, la aceşti pacienţi, este foarte importantă
monitorizarea periodică.
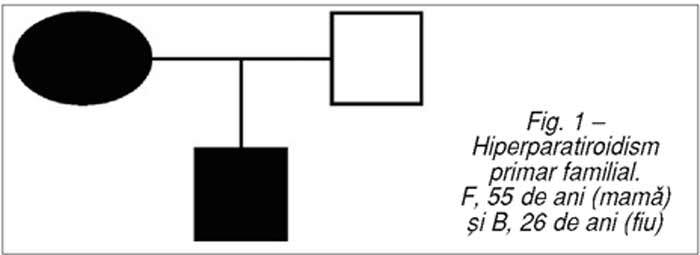
Prezentare clinică
Din cazuistica hiperparatiroidismului
primar familial prezentăm cazul din fig.
1.
Fiul se prezintă în clinica noastră pentru
evaluare în contextul unor valori crescute ale calcemiei (11,6 mg/dl),
descoperite la un screening de rutină. Dintre antecedentele personale
patologice, reţinem obezitate, HTA debutată de aproximativ un an (TA max =
160/100 mm Hg), neinvestigată şi pentru care primise tratament cu asocierea
trandolapril 2 mg / verapamil 180 mg.
Probele de laborator confirmă prezenţa
hipercalcemiei (11,2 mg/dl), cu hipofosfatemie (2,2 mg/dl), fosfatază alcalină
crescută (320 U/l), calciurie şi fosfaturie crescute (1,2 g la 24 ore,
respectiv 2,35 g la 24 ore). Dozarea PTH evidenţiază o valoare crescută: 208
pg/ml. Asociat: hipotiroidie (TSH=5.8 µUI/ml). Pentru etiologia HTA, la acest
pacient tânăr s-au efectuat analize suplimentare: dozarea repetată a
metanefrinelor şi  normetanefrinelor plasmatice şi urinare a fost normală.
Cortizolul plasmatic şi metaboliţii săi urinari (bază şi inhibiţie) au fost
normali, ca şi renina şi aldosteronul.
normetanefrinelor plasmatice şi urinare a fost normală.
Cortizolul plasmatic şi metaboliţii săi urinari (bază şi inhibiţie) au fost
normali, ca şi renina şi aldosteronul.
S-au recomandat investigaţii imagistice
pentru localizarea unui posibil adenom paratiroidian. Ecografia regiunii
cervicale anterioare a evidenţiat o tiroidă uşor mărită, cu structură hipodensă,
neomogenă, pseudonodularizată (aspect de tiroidită cronică), dar nu a
vizualizat imagini sugestive pentru ţesut paratiroidian. Nici examenul CT al
regiunii cervicale nu a adus informaţii suplimentare.
Examenul scintigrafic paratiroidian cu
99mTc a evidenţiat o zonă de hipercaptare paramedian drept pe imaginea
scintigrafică precoce (fig. 2).
Diagnostic: Hiperparatiroidism primar prin
adenom paratiroidian drept inferior; Tiroidită cronică autoimună cu
hipotiroidie; Obezitate, HTA.
S-a intervenit chirurgical şi s-a localizat
o tumoră paratiroidiană dreaptă inferioară, confirmată de examenul histopatologic
ca adenom paratiroidian cu celule principale. Evoluţia postoperatorie a fost
favorabilă, cu normalizarea calcemiei şi a valorilor PTH.
Mama, în vârstă de 55 de ani, se prezintă
un an mai târziu, pentru HTA severă (TA max = 220/110 mm Hg) şi simptomatologie
polimorfă: palpitaţii, fatigabilitate, iritabilitate, insomnii, cefalee. Dintre
antecedentele personale fiziologice şi patologice, menţionăm: obezitate,
menopauză spontană la 54 de ani; ulcer gastric (diagnosticat la 40 de ani); guşă
micropolinodulară cu hipotiroidie în tratament cu levotiroxin 50 µg/zi; boală
cardiacă ischemică cu test de efort pozitiv. Analizele paraclinice – la
momentul evaluării iniţiale – au fost în limite normale. S-au dozat
metanefrinele şi normetanefrinele plasmatice şi urinare, care au fost normale.
Se recomandă tratament cu metoprolol 50 mg/zi şi asocierea irbesartan 150 mg şi
hidroclorotiazidă 12,5 mg.
Patru ani mai târziu, la una dintre reevaluări,
se descoperă o calcemie crescută (11.17 mg/dl) dar cu fosfor, fosfatază alcalină
normale. Dozarea PTH arată o valoare crescută, de 211 pg/ml.
Ecografia regiunii cervicale anterioare
descrie o tiroidă cu structură hipoecogenă prezentând, în lobul drept
tiroidian, un nodul izoecogen, imprecis delimitat, de 0,7/0,5 cm, iar în lobul
stâng un nodul de 0,85/0,5 cm. În polul inferior al lobului stâng tiroidian,
paracarotidian se vizualizează un nodul bine vascularizat de 1,5/0,6/1,55 cm –
posibil adenom paratiroidian (fig. 3).
Scintigrafia paratiroidiană a fost negativă,
iar tomografia regiunii cervicale descrie nodulii tiroidieni, dar nu vizualizează
mase sugestive pentru adenoame paratiroidiene.
Diagnostic: Hiperparatiroidism primar –
forma familială; Adenom paratiroidian stâng inferior; Tiroidită cronică
autoimună cu hipotiroidie în tratament de substituţie; HTA, Boală cardiacă
ischemică, Obezitate.
Se intervine chirurgical şi se practică
tiroidectomie totală şi paratiroidectomie stângă inferioară şi reducţională
(parţială) pe paratiroida dreaptă superioară (care prezenta hiperplazie).
Examenul histopatologic relevă adenom paratiroidian inferior stâng cu celule de
tip principal, dar şi microcarcinom papilar sclerozant, focar lob drept
tiroidian marginal invaziv, de 0,3/0,2 cm.
Postoperator, evoluţia a fost favorabilă cu
scăderea concentraţiei PTH şi a calcemiei, necesitând tratament zilnic cu 2 g
calciu şi 1 µg alfacalcidiol, precum şi tratamentul carcinomului papilar
conform protocolului specific.
Concluzii
Hipercalcemia familială constituie un grup
heterogen de afecţiuni. Asemenea celorlalte forme de hipercalcemie, este adesea
asimptomatică şi dozarea calciului în cadrul testelor de rutină este de
importanţă vitală pentru diagnosticul precoce. Investigaţiile paraclinice
complexe confirmă diagnosticul, iar tratamentul curativ este cel chirurgical.
Testarea genetică ocupă un loc important în evaluarea pacientului, mai ales în
situaţiile în care este necesară aprecierea riscului de apariţie a carcinomului
paratiroidian, precum şi investigarea rudelor de sânge, impunând monitorizarea
atentă a celor cu mutaţii confirmate.
Notă autor:
Bibliografie
1. Wermers RA, Khosla S, Atkinson EJ, Achenbach SJ, Oberg AL, Grant CS, Melton LJ 3rd. Incidence of primary hyperparathyroidism in Rochester, Minnesota, 1993-2001: an update on the changing epidemiology of the disease. J Bone Miner Res. 2006 Jan;21(1):171-7
2. Fraker DL, Harsono H, Lewis R. Minimally invasive parathyroidectomy: benefits and requirements of localization, diagnosis, and intraoperative PTH monitoring. long-term results. World J Surg. 2009 Nov;33(11):2256-65
3. Brandi ML, Gagel RF, Angeli A, Bilezikian JP, Beck-Peccoz P, Bordi C, Conte-Devolx B, Falchetti A, Gheri RG, Libroia A, Lips CJ, Lombardi G, Mannelli M, Pacini F, Ponder BA, Raue F, Skogseid B, Tamburrano G, Thakker RV, Thompson NW, Tomassetti P, Tonelli F, Wells SA Jr, Marx SJ. Guidelines for diagnosis and therapy of MEN type 1 and type 2. J Clin Endocrinol Metab. 2001 Dec;86(12):5658-71
4. Bilezikian JP, Brandi ML, Rubin M, Silverberg SJ. Primary hyperparathyroidism: new concepts in clinical, densitometric and biochemical features. J Intern Med. 2005 Jan;257(1):6-17
5. Gardner DG, Shoback D. Greenspan’s Basic and Clinical Endocrinology. Chapter 23, McGraw Hill Medical 2007
6. Larsson C, Skogseid B, Oberg K, Nakamura Y, Nordenskjöld M. Multiple endocrine neoplasia type 1 gene maps to chromosome 11 and is lost in insulinoma. Nature. 1988 Mar 3;332(6159):85-7
7. Chandrasekharappa SC, Guru SC, Manickam P, Olufemi SE, Collins FS, Emmert-Buck MR, Debelenko LV, Zhuang Z, Lubensky IA, Liotta LA, Crabtree JS, Wang Y, Roe BA, Weisemann J, Boguski MS, Agarwal SK, Kester MB, Kim YS, Heppner C, Dong Q, Spiegel AM, Burns AL, Marx SJ. Positional cloning of the gene for multiple endocrine neoplasia-type 1. Science. 1997 Apr 18;276(5311):404-7
8. Szabó J, Heath B, Hill VM, Jackson CE, Zarbo RJ, Mallette LE, Chew SL, Besser GM, Thakker RV, Huff V, et al. Hereditary hyperparathyroidism-jaw tumor syndrome: the endocrine tumor gene HRPT2 maps to chromosome 1q21-q31. Am J Hum Genet. 1995 Apr;56(4):944-50
9. Pellegata NS, Quintanilla-Martinez L, Siggelkow H, Samson E, Bink K, Höfler H, Fend F, Graw J, Atkinson MJ. Germ-line mutations in p27Kip1 cause a multiple endocrine neoplasia syndrome in rats and humans. Proc Natl Acad Sci U S A. 2006 Oct 17;103(42):15558-63
10. Simonds WF, James-Newton LA, Agarwal SK, Yang B, Skarulis MC, Hendy GN, Marx SJ. Familial isolated hyperparathyroidism: clinical and genetic characteristics of 36 kindreds. Medicine (Baltimore). 2002 Jan;81(1):1-26
11. Agarwal SK, Guru SC, Heppner C, Erdos MR, Collins RM, Park SY, Saggar S, Chandrasekharappa SC, Collins FS, Spiegel AM, Marx SJ, Burns AL. Menin interacts with the AP1 transcription factor JunD and represses JunD-activated transcription. Cell. 1999 Jan 8;96(1):143-52
12. Larsson C. Dissecting the genetics of hyperparathyroidism—new clues from an old friend. J Clin Endocrinol Metab. 2000 May;85(5):1752-4
13. Simonds WF, James-Newton LA, Agarwal SK, Yang B, Skarulis MC, Hendy GN, Marx SJ. Familial isolated hyperparathyroidism: clinical and genetic characteristics of 36 kindreds. Medicine (Baltimore). 2002 Jan;81(1):1-26
14. Marx SJ, Simonds WF, Agarwal SK, Burns AL, Weinstein LS, Cochran C, Skarulis MC, Spiegel AM, Libutti SK, Alexander HR Jr, Chen CC, Chang R, Chandrasekharappa SC, Collins FS. Hyperparathyroidism in hereditary syndromes: special expressions and special managements. J Bone Miner Res. 2002 Nov;17 Suppl 2:N37-43
15. Carpten JD, Robbins CM, Villablanca A, Forsberg L, Presciuttini S, Bailey-Wilson J, Simonds WF, Gillanders EM, Kennedy AM, Chen JD, Agarwal SK, Sood R, Jones MP, Moses TY, Haven C, Petillo D, Leotlela PD, Harding B, Cameron D, Pannett AA, Höög A, Heath H 3rd, James-Newton LA, Robinson B, Zarbo RJ, Cavaco BM, Wassif W, Perrier ND, Rosen IB, Kristoffersson U, Turnpenny PD, Farnebo LO, Besser GM, Jackson CE, Morreau H, Trent JM, Thakker RV, Marx SJ, Teh BT, Larsson C, Hobbs MR. HRPT2, encoding parafibromin, is mutated in hyperparathyroidism-jaw tumor syndrome. Nat Genet. 2002 Dec;32(4):676-80
16. Shattuck TM, Välimäki S, Obara T, Gaz RD, Clark OH, Shoback D, Wierman ME, Tojo K, Robbins CM, Carpten JD, Farnebo LO, Larsson C, Arnold A. Somatic and germ-line mutations of the HRPT2 gene in sporadic parathyroid carcinoma. N Engl J Med. 2003 Oct 30;349(18):1722-9
17. Simonds WF, Robbins CM, Agarwal SK, Hendy GN, Carpten JD, Marx SJ. Familial isolated hyperparathyroidism is rarely caused by germline mutation in HRPT2, the gene for the hyperparathyroidism-jaw tumor syndrome. J Clin Endocrinol Metab. 2004 Jan;89(1):96-102
18. Pollak MR, Brown EM, Chou YH, Hebert SC, Marx SJ, Steinmann B, Levi T, Seidman CE, Seidman JG. Mutations in the human Ca(2+)-sensing receptor gene cause familial hypocalciuric hypercalcemia and neonatal severe hyperparathyroidism. Cell. 1993 Dec 31;75(7):1297-303
19. Fuleihan GE, Brown EM, Heath HH III. Familial benign hypocalciuric hypercalcemia and neonatal primary hyperparathyroidism. In: Principles of Bone Biology, 3rd Edition (Bilezikian JP, Raisz LG, Martin TJ, eds). Academic Press, San Diego, 2008:1327-45
20. Arnold A. Familial hyperparathyroidism. In: Primer on the Metabolic Bone Diseases and Disorders of Mineral Metabolism (Rosen CJ, ed), 7th edition. American Society for Bone and Mineral Research, Washington, DC, 2008:361-7
21. Marcocci C, Cetani F, Rubin MR, Silverberg SJ, Pinchera A, Bilezikian JP. Parathyroid carcinoma. J Bone Miner Res. 2008 Dec;23(12):1869-80
22. Teh BT, Farnebo F, Twigg S, Höög A, Kytölä S, Korpi-Hyövälti E, Wong FK, Nordenström J, Grimelius L, Sandelin K, Robinson B, Farnebo LO, Larsson C. Familial isolated hyperparathyroidism maps to the hyperparathyroidism-jaw tumor locus in 1q21-q32 in a subset of families. J Clin Endocrinol Metab. 1998 Jun;83(6):2114-20
23. Kassem M, Kruse TA, Wong FK, Larsson C, Teh BT. Familial isolated hyperparathyroidism as a variant of multiple endocrine neoplasia type 1 in a large Danish pedigree. J Clin Endocrinol Metab. 2000 Jan;85(1):165-7
24. Pearce SH, Williamson C, Kifor O, Bai M, Coulthard MG, Davies M, Lewis-Barned N, McCredie D, Powell H, Kendall-Taylor P, Brown EM, Thakker RV. A familial syndrome of hypocalcemia with hypercalciuria due to mutations in the calcium-sensing receptor. N Engl J Med. 1996 Oct 10;335(15):1115-22
25. Carling T, Szabo E, Bai M, Ridefelt P, Westin G, Gustavsson P, Trivedi S, Hellman P, Brown EM, Dahl N, Rastad J. Familial hypercalcemia and hypercalciuria caused by a novel mutation in the cytoplasmic tail of the calcium receptor. J Clin Endocrinol Metab. 2000 May;85(5):2042-7
26. Cascón A, Huarte-Mendicoa CV, Javier Leandro-García L, Letón R, Suela J, Santana A, Costa MB, Comino-Méndez I, Landa I, Sánchez L, Rodríguez-Antona C, Cigudosa JC, Robledo M. Detection of the first gross CDC73 germline deletion in an HPT-JT syndrome family. Genes Chromosomes Cancer. 2011 Nov;50(11):922-9
27. Frank-Raue K, Leidig-Bruckner G, Haag C, Schulze E, Lorenz A, Schmitz-Winnenthal H, Raue F. Inactivating calcium-sensing receptor mutations in patients with primary hyperparathyroidism. Clin Endocrinol (Oxf). 2011 Mar 29
28. Motokura T, Bloom T, Kim HG, Jüppner H, Ruderman JV, Kronenberg HM, Arnold A. A novel cyclin encoded by a bcl1-linked candidate oncogene. Nature. 1991 Apr 11;350(6318):512-5
29. Heppner C, Kester MB, Agarwal SK, Debelenko LV, Emmert-Buck MR, Guru SC, Manickam P, Olufemi SE, Skarulis MC, Doppman JL, Alexander RH, Kim YS, Saggar SK, Lubensky IA, Zhuang Z, Liotta LA, Chandrasekharappa SC, Collins FS, Spiegel AM, Burns AL, Marx SJ. Somatic mutation of the MEN1 gene in parathyroid tumours. Nat Genet. 1997 Aug;16(4):375-8
30. Fukuda N, Tanaka H, Tominaga Y, Fukagawa M, Kurokawa K, Seino Y. Decreased 1,25-dihydroxyvitamin D3 receptor density is associated with a more severe form of parathyroid hyperplasia in chronic uremic patients. J Clin Invest. 1993 Sep;92(3):1436-43
31. Sudhaker Rao D, Han ZH, Phillips ER, Palnitkar S, Parfitt AM. Reduced vitamin D receptor expression in parathyroid adenomas: implications for pathogenesis. Clin Endocrinol (Oxf). 2000 Sep;53(3):373-81
32. Carling T, Kindmark A, Hellman P, Holmberg L, Akerström G, Rastad J. Vitamin D receptor alleles b, a, and T: risk factors for sporadic primary hyperparathyroidism (HPT) but not HPT of uremia or MEN 1. Biochem Biophys Res Commun. 1997 Feb 13;231(2):329-32
33. Carling T, Ridefelt P, Hellman P, Rastad J, Akerström G. Vitamin D receptor polymorphisms correlate to parathyroid cell function in primary hyperparathyroidism. J Clin Endocrinol Metab. 1997 Jun;82(6):1772-5
34. Carling T, Rastad J, Akerström G, Westin G. Vitamin D receptor (VDR) and parathyroid hormone messenger ribonucleic acid levels correspond to polymorphic VDR alleles in human parathyroid tumors. J Clin Endocrinol Metab. 1998 Jul;83(7):2255-9
35. Correa P, Rastad J, Schwarz P, Westin G, Kindmark A, Lundgren E, Akerström G, Carling T. The vitamin D receptor (VDR) start codon polymorphism in primary hyperparathyroidism and parathyroid VDR messenger ribonucleic acid levels. J Clin Endocrinol Metab. 1999 May;84(5):1690-4
 izolat care dezvoltă carcinom paratiroidian.
izolat care dezvoltă carcinom paratiroidian. normetanefrinelor plasmatice şi urinare a fost normală.
Cortizolul plasmatic şi metaboliţii săi urinari (bază şi inhibiţie) au fost
normali, ca şi renina şi aldosteronul.
normetanefrinelor plasmatice şi urinare a fost normală.
Cortizolul plasmatic şi metaboliţii săi urinari (bază şi inhibiţie) au fost
normali, ca şi renina şi aldosteronul.