
Cauză a 3% din accidentele vasculare cerebrale, fenomenul se manifestă în aproape toate cazurile prin cefalee atroce.
Imagistica și scalele de evaluare neurologică stabilesc diagnosticul.
Hemoragia subarahnoidiană (HSA) reprezintă cauza a 3% din accidentele vasculare cerebrale (AVC) și este responsabilă de 5% din mortalitatea prin accident vascular cerebral. Vârful incidenţei pentru HSA este grupa de vârstă 55–60 de ani. Pe parcursul internării pentru această patologie, 30–70% din indivizi suferă o resângerare, iar dintre resângerări, aproximativ 90% se soldează cu exitus, indiferent de tratamentul aplicat.
Hemoragia subarahnoidiană este consecinţa ruperii unui vas din spaţiul subarahnoidian sau din vecinătatea acestuia. Prin urmare, în spaţiul subarahnoidian, adică între pia mater și arahnoidă, unde în mod normal se află doar lichid cefalorahidian, se va extravaza sânge.
După etiologie, se disting următoarele tipuri de hemoragie subarahnoidiană: în context traumatic sau spontană. Forma spontană este asociată valorilor ridicate ale tensiunii arteriale (HSA hipertensivă) sau este consecinţa ruperii unui anevrism, a unei malformaţii arterio-venoase intracerebrale sau spinale ori este secundară disecţiei arterelor cervico-cerebrale. De fapt, 85% din cazurile de HSA sunt secundare ruperii unui anevrism cerebral. Ruptura anevrismului survine mai frecvent toamna și primăvara, fiind pusă în directă legătură, similar AVC-urilor ischemice, cu schimbările de temperatură.
O situaţie mai rară de HSA spontană o reprezintă hemoragia subarahnoidiană idiopatică, în prezenţa unor factori de risc consideraţi netradiţionali: alcoolism, tutun, consum de cocaină/amfetamine. În afara acestora, literatura de specialitate furnizează și o serie de factori de risc tradiţionali, nemodificabili prin intervenţie medicală și stil de viaţă, puși frecvent în legătură cu producerea unei HSA: istoricul familial, afecţiuni ale ţesutului conjunctiv, precum boala rinichiului polichistic, neurofibromatoza de tip 1, sindromul Ehlers-Danlos (în special tipul IV) și alte boli de colagen, dar și sexul feminin (risc de 1,5 ori mai mare), rasa africană (risc dublu), etnia japoneză sau finlandeză, prezenţa vasculitelor sau a unor factori rari: parazitoze, boala Moya-Moya, eclampsia, afecţiuni hematologice, tulburări de coagulare. Este important să atragem atenţia că prin creșterea prevalenţei factorilor de risc netradiţionali este de așteptat o creștere a incidenţei HSA în următoarele decenii.
Din punct de vedere clinic, primul simptom și totodată cel mai constant (aproximativ 97% din cazuri) îl reprezintă cefaleea atroce instalată brutal, cunoscută în literatura anglo-saxonă drept thunderclap headache, și descrisă de pacient drept „cea mai intensă durere de cap din viaţă”.
O situaţie particulară este dată de cefaleea santinelă – o durere bruscă, brutală, care cedează, generând un interval de timp simptom-free, pacientul ignorând de cele mai multe ori episodul, urmat de deteriorarea brutală a stării neurologice, fenomen paroxistic cunoscut în neurochirurgie ca walk, talk and die patients.
Ca simptome de acompaniament, fotofobia este o acuză subiectivă frecventă, alături de alte manifestări oculare – hemoragie subhialoidă, intraretiniană sau vitroasă. Examenul fundului de ochi poate evidenţia edem papilar, consecinţă a hipertensiunii intracraniene secundare sângerării subarahnoidiene. Fenomene vegetative precum vărsături sau sincope se întâlnesc frecvent. Alteori, dar nu și rareori, pacientul ajunge la medic în urma unui episod de pierdere a stării de conștienţă sau în stare de conștienţă alterată, în fapt, starea neurologică la prezentare putând varia de la ușoară confuzie până la comă profundă. Crizele epileptice se întâlnesc frecvent, circa 20% din pacienţii cu HSA prezentând astfel de episoade în primele 24 de ore de la producerea hemoragiei, și sunt considerate a fi corelate cu presiunea intracraniană crescută, cu hiponatremia asociată și cu localizarea anevrismului (în special în teritoriul arterelor sylviene).
Examenul neurologic pune în evidenţă precoce semnele de iritaţie meningeală (redoarea cefei, cefalee, fotofobie, dureri la nivelul globilor oculari, vărsături). Redoarea cefei apare, de obicei, între 6 și 24 de ore de la producerea hemoragiei. După câteva zeci de minute sau ore, se pot asocia semnele Kernig, Brudzinski, Lassègue bilateral, uneori semne neurologice de focar sau manifestări psihiatrice acute (acestea sunt mai specifice la vârstnici). Alte semne și simptome de acompaniament sunt: globul vezical și retenţia urinară, reflexele osteo-tendinoase diminuate sau abolite (la mai mult de 4–6 ore de la debutul sângerării) și, eventual, semne neurologice focale. Vârstele înaintate (peste 70 de ani) se asociază mult mai frecvent cu stare neurologică gravă sau deosebit de gravă la prezentare.
Metoda diagnostică de elecţie în HSA este reprezentată de examinarea prin CT cranio-cerebral nativ la camera de gardă, care evidenţiază prezenţa sângelui în spaţiul subarahnoidian, ocazie cu care se face și încadrarea într-un grup Fisher.
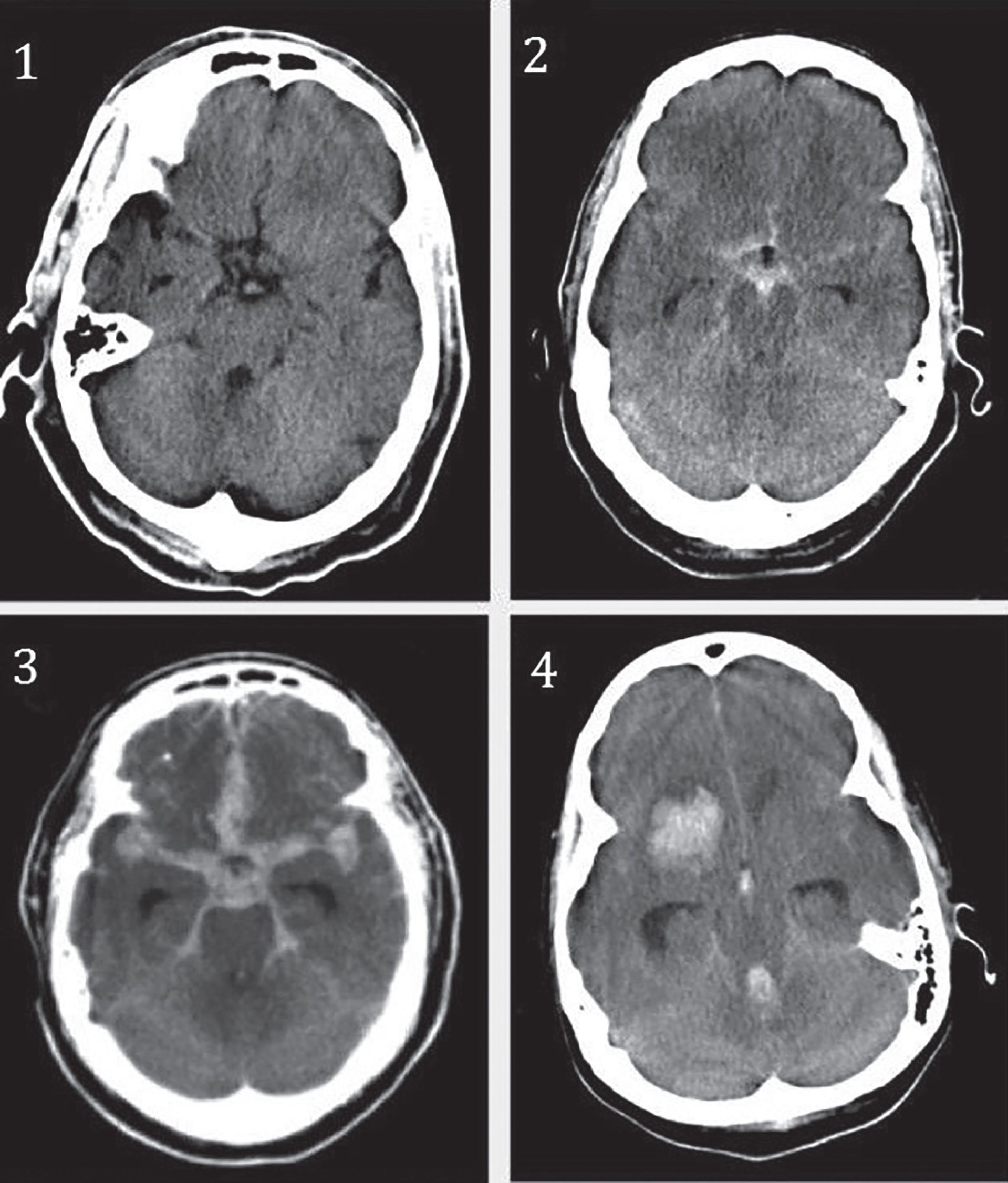
Sursa: Future Neurol@2013 Future Medicine Ltd.
Această investigaţie imagistică este de altfel și standardul de aur în diagnosticul hemoragiei subarahnoidiene, având ca limită faptul că, dacă a trecut relativ puţin timp de la debutul hemoragiei, rezultatul poate fi negativ la o primă examinare, pozitivându-se în câteva zeci de minute. Scala Fisher se bazează pe aspectul CT-ului cranio-cerebral și prevede riscul de a dezvolta vasospasm. Aceasta este ilustrată în tabelul următor. 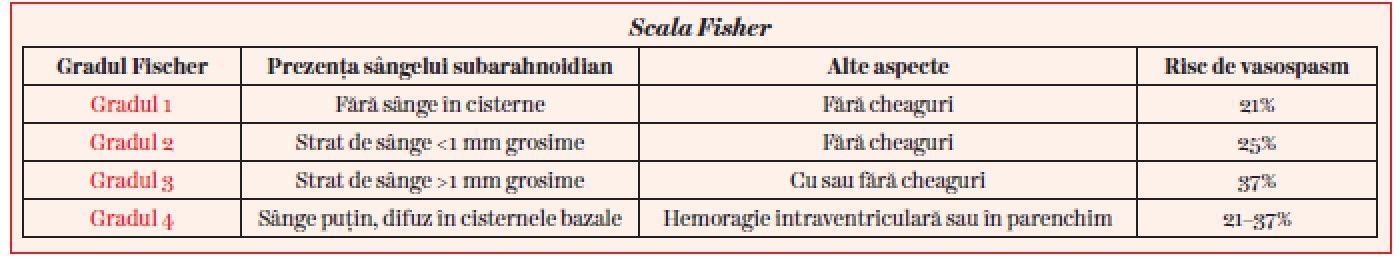
Dacă examenul CT cranio-cerebral nativ este negativ, în prezenţa unei suspiciuni clinice înalte, se poate încerca puncţia lombară în scop diagnostic, la care se va recurge însă cu mare precauţie, după examinarea fundului de ochi, care trebuie să excludă existenţa unei presiuni intracraniene crescute, pentru a evita astfel riscul de herniere cerebrală. Aceasta manevră poate induce o resângerare dacă reduce presiunea intracraniană prea mult, motiv pentru care se recoltează doar câţiva mililitri.
Puncţia lombară, conform datelor din literatură, este cea mai sensibilă metodă de diagnostic pentru HSA. Un rezultat pozitiv presupune presiune crescută a LCR, xantocromie, hematii >100.000/mm3, proteinorahie crescută, glicorahie normală sau ușor scăzută.
IRM cerebrală în secvenţa FLAIR, angio-CT și angio-RM nu sunt foarte relevante din punct de vedere diagnostic în primele 24–48 de ore de la debutul hemoragiei, dar sunt excelente la 3–7 zile, putând indica etiologia anevrismală, precum și localizarea anevrismului și morfologia acestuia.
Angiografia cu substracţie digitală (DSA), devenită în momentul de faţă un instrument de importanţă capitală în managementul HSA, presupune injectarea selectivă de material radioopac (substanţă de contrast pe bază de iod), folosind un cateter introdus într-o arteră de calibru mare și studiu radiologic.
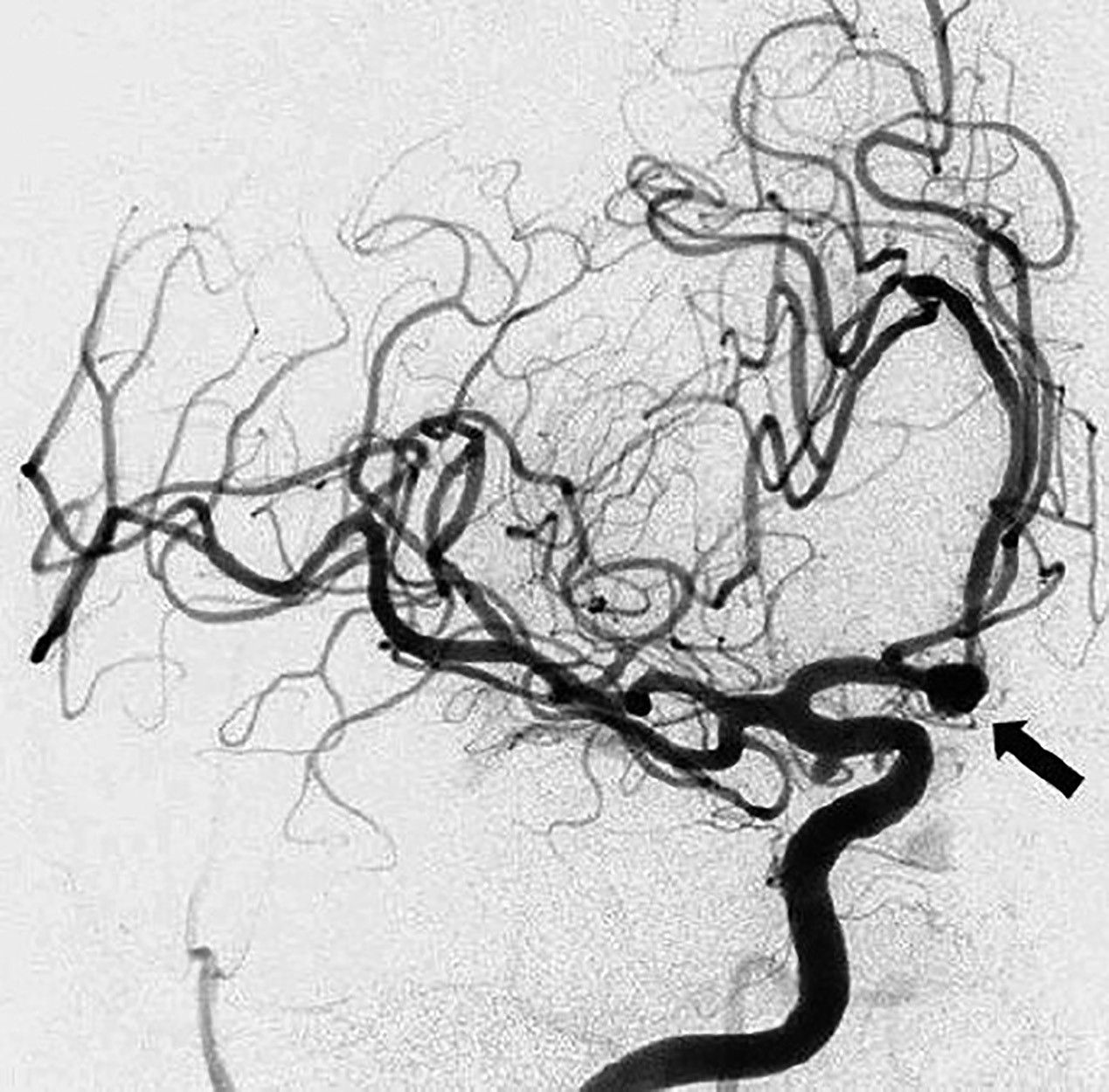
Sursa: OpenSource
Reprezintă o investigaţie deosebită în evaluarea anevrismelor cerebrale și se pretează atât ca instrument diagnostic, cât și terapeutic, prin posibilitatea embolizării concomitente a anevrismului sau a malformaţiei arterio-venoase incriminate. Astfel, anevrismele <5 mm sunt ideale pentru coiling (embolizare endovasculară), în timp ce se consideră că pentru restul există un risc mare de recanalizare sau de ocluzie incompletă, astfel că se poate recurge la coiling asistat de stent sau balon.
Odată confirmat diagnosticul de hemoragie subarahnoidiană, se instituie măsuri de ordin terapeutic pe baza stării clinice și neurologice a pacientului și în funcţie de etiologia hemoragiei și se completează bilanţul diagnostic cu alte investigaţii specifice. Pacientul va fi internat într-un serviciu de neurochirurgie cu terapie intensivă adaptată, în cazul în care starea generală și neurologică impune asistarea funcţiilor vitale.
Tratamentul medical vizează controlul tensiunii arteriale, precum și prevenirea unor complicaţii redutabile și deseori dificil de tratat chiar și cu terapie maximală:
- menţinerea TAS la valori <160 mm/Hg, întrucât valorile tensionale ridicate se asociază cu riscul de agravare a hemoragiei sau de resângerare;
- prevenirea vasospasmului, prin administrare de Nimodipină;
- prevenirea edemului cerebral;
- menţinerea euvolemiei și combaterea hiponatremiei.
Profilaxia anticomiţială este obligatorie, prin efectul iritativ al sângelui din spaţiul subarahnoidian la nivel cortical.
Momentul operator oportun în cazul HSA anevrismală este considerat astăzi a fi localizat la 24–72 de ore de la debut, la pacienţii cu scor Hunt & Hess 1 (cefalee moderată, eventual și redoare de ceafă) sau 2 (cefalee moderată sau severă, redoare de ceafă, pareze de nervi cranieni). Intervenţia constă în securizarea anevrismului prin clipare (chirurgie clasică) sau prin coiling (metoda intervenţională). Pacienţii cu scor Hunt & Hess superior (confuzie/stupoare/comă, așadar cu stare de conștienţă alterată, asociată cu deficite neurologice focale) vor fi internaţi în unitatea de terapie intensivă pentru susţinerea funcţiilor vitale și cu scopul trecerii într-un grad Hunt & Hess de 1 sau 2, pentru ca intervenţia neurochirurgicală să se poate realiza cu un raport risc/beneficiu acceptabil. 
Excepţie de la această situaţie se face în caz de HSA însoţită de hematoame intraparenchimatoase mari (gradul Fisher 4) ce pun viaţa pacientului în pericol, indiferent de etiologia HSA. În acest caz se va interveni în urgenţă indiferent de gradul Hunt & Hess. O situaţie similară este cea în care viaţa pacientului este pusă în pericol iminent de sindromul de hipertensiune intracraniană (consecinţă a hidrocefaliei obstructive ce survine în evoluţia HSA), caz în care se poate practica în urgenţă un drenaj ventricular extern, însoţit de dispozitiv de monitorizare a presiunii intracraniene, cu scopul de a obţine o ameliorare clinică și neurologică, până la tratamentul definitiv al cauzei ce a dus la producerea HSA.
În perioada postoperatorie, după securizarea anevrismului incriminat de producerea HSA, alături de măsurile de ordin general și de prevenire a complicaţiilor, se va efectua ecografie Doppler transcraniană, pentru a aprecia fluxul pe arterele mari intracraniene și vasospasmul, precum și tomografie cerebrală de control, pentru a verifica dispozitivele de ocluzie și evoluţia imagistică a HSA. În cazuri de vasospasm rezistent, se poate recurge la terapie vasodilatatoare intraarterială endovasculară (injectare selectivă intraarterială de agenţi vasodilatatori sub control angiografic).
În perioada postoperatorie, se continuă măsurile de ordin medical instituite din momentul diagnosticării. Având în vedere riscul de resângerare, care se menţine la 30–70% în ciuda tratamentului corect aplicat, și cunoscându-se că 90% din resângerări conduc la deces indiferent de măsurile aplicate, pacientul va fi monitorizat postoperator în unitatea de terapie intensivă. Cu toate acestea, în ciuda aplicării tuturor aceste atitudini și resurse terapeutice, se menţine riscul major de producere a unor complicaţii serioase și dificil de tratat – vasospasm și ischemie cerebrală tardivă, tulburări vegetative centrale, hematoame intracerebrale, resângerare, dezechilibre hidroelectrolitice, hidrocefalie normotensivă internă. Riscul de a dezvolta vasospasm survine încă de la debutul hemoragiei, dar se consideră că riscul major survine în intervalul de 3–7 zile de la debut și până la 3 săptămâni. El se apreciază destul de fidel cu ajutorul gradului Fisher, acesta fiind direct proporţional cu un grad Fisher mai ridicat.
În concluzie, nu se poate vorbi momentan de un tratament curativ al hemoragiei subarahnoidiene, aceasta nefiind, în fond, o boală, ci mai degrabă un șir de evenimente patologice care se succed în timp, evolutiv, și care implică o serie de consecinţe asupra structurilor encefalice atât pe termen scurt, cât și pe termen lung. Tratamentul hemoragiei subarahnoidiene este, așadar, unul multimodal, multidisciplinar, etapizat, care se adresează simultan factorului etiologic, factorilor favorizanţi sau agravanţi, precum și prevenirii complicaţiilor. Un prognostic cât mai bun și reabilitatea supravieţuitorilor unei HSA presupun un diagnostic stabilit cât mai rapid, într-un centru primar de neurochirurgie cu servicii de radiologie și terapie intensivă disponibile oricând. Prognosticul acestor pacienţi și reabilitarea neurologică presupun cooperarea eficace a echipei multidisciplinare formate din urgentist, radiolog, intervenţionist, neurochirurg, medic de terapie intensivă, neurolog, specialist în recuperare.
Având în vedere că 15–20% din indivizii ce suferă o HSA decedează înainte de a intra în contact cu un serviciu medical de orice fel, conform datelor Organizaţiei Mondiale a Sănătăţii, și că 40% din pacienţii supravieţuitori unei HSA vor avea deficite neurologice permanente, se impune identificarea rapidă a cazurilor cu suspiciune înaltă și îndrumarea acestora către un serviciu de neurochirurgie de urgenţă.
1. Youmans and Winn Neurological Surgery, 7th edition. Elsevier, 2017; 379: 3232–56, 380: 3257–73
2. Wu L, Chen G. Signaling Pathway in Cerebral Vasospasm After Subarachnoid Hemorrhage: News Update. Acta Neurochir Suppl. 2016; 121: 161–5
3. Vivancos J, Gilo F,. Clinical management guidelines for subarachnoid haemorrhage. Diagnosis and treatment, Neurologia, 2014 Jul–Aug; 29(6): 353–70
4. Schmideck & Sweet Operative: Neurosurgical Techniques, 6th edition. Elsevier, 2012; 84:1019-1028, 93: 1115–25
5. A.V. Ciurea. Tratat de neurochirurgie, volumul II. Ed. Medicală, București, 2011; 3: 121–33
6. L. Dănăilă, F. Ștefănescu. Anevrismele cerebrale. Ed. Academiei Române, București, 2007; 44–63
7. A. Constantinovici, A.V. Ciurea. Ghid practic de neurochirurgie. Ed. Medicală, București, 1998, 11: 352–69
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe