Impactul genomicii cancerului în oncologia
clinică
Lectura
articolelor precedente dedicate oncogenomicii permite înţelegerea realizărilor
extraordinare din acest nou domeniu în descifrarea mecanismelor moleculare ale
bolii canceroase, precum şi a consecinţelor benefice pe care progresul cunoaşterii
le-a adus în oncologia clinică. Vom încerca acum o sinteză integratoare a
aplicaţiilor practice curente ale oncogenomicii şi o perspectivă a evoluţiei
viitoare în acest domeniu. Considerăm însă că este utilă o rememorare a câtorva
elemente esenţiale despre oncogenomică, discutate anterior (1–3).
Boala
canceroasă este o afecţiune genetică complexă, produsă de acumularea unor modificări genetice şi epigenetice, moştenite şi dobândite, în gene multiple; prin aceste evenimente, o
clonă celulară capătă un set complet de capacităţi
distinctive, definitorii („the hallmarks of cancer“), proliferează intens şi
formează o tumoră care evoluează multistadial,
creşte necontrolat şi diseminează la distanţă (4). Tumora este un „organ“ complex, alcătuit dintr-un „parenchim“, cu
celule specializate heterogene (inclusiv celule stem canceroase şi celule
„invazive“), şi o „stromă“ (fibroblaşti asociaţi tumorii, celule endoteliale,
celule imune inflamatorii ş.a.) ce formează micromediul
tumoral. Tumora evoluează în timp, dobândind o heterogenitate clonală (mai multe subpopulaţii cu diferenţe în numărul
şi tipul de mutaţii) (3).
Genele
implicate în producerea cancerelor pot fi grupate în mai multe categorii
funcţionale: • oncogene (gene
„proliferative“)• gene supresoare ale creşterii tumorale („antioncogene“), subîmpărţite în gene „gatekeeper“ (opresc proliferarea şi
activează apoptoza), gene „caretaker“
(implicate în păstrarea integrităţii/stabilităţii genomului), gene „landscaper“ (controlează
micromediul celular, care produce semnale antiproliferative) • gene ce codifică
microARN, cu rol reglator al celorlalte gene (1).
Fiecare tumoră conţine un număr foarte mare
de modificări genetice şi epigenetice
diverse. Dar numai un număr mic de mutaţii (mai puţin de zece), numite „mutaţii
conductoare“ („driver mutations“)
sunt necesare pentru iniţierea clonei canceroase (mutaţii „oncogenice“) şi pentru menţinerea/expansiunea tumorală (mutaţii „de menţinere“) (5, 6). Din perspectiva
utilităţii clinice, unele mutaţii conductoare au fost definite ca modificări „acţionabile“ („actionable aberrations“), în sensul că
„implică acţiuni practice“ – deoarece
au impact asupra managementului
cancerului prin utilizarea lor în diagnostic, prognostic şi/sau predicţie; o
parte dintre acestea sunt şi „tratabile“(„druggable aberrations“) – întrucât
oncoproteinele codificate pot fi ţinta unor noi terapii, care schimbă evoluţia
bolii (5).
Identificarea mutaţiilor conductoare, mai
ales a celor comune mai multor forme de cancer, a adus beneficii clinice importante, multe dintre ele fiind deja
încorporate în practica oncologică: • ameliorarea diagnosticului precoce şi
stabilirea subtipului molecular al bolii • optimizarea tratamentului pentru
subgrupe de pacienţi cu acelaşi tip histologic de cancer, dar cu profiluri de expresie genică („semnătura
moleculară“) diferite • identificarea unor noi markeri prognostici (prin
analiza expresiei unor gene implicate în metastazare sau „semnătura metastatică“) • creşterea posibilităţilor terapeutice
prin „inhibarea specifică, ţintită“, a proteinelor codificate de genele de
cancer • monitorizarea statusului bolii şi a eficienţei tratamentului • managementul
susceptibilităţii genetice la cancer (7–9). Cert este că progresele
înregistrate în ultimii zece ani „pe toate fronturile“ oncologiei prefigurează
„un asalt decisiv“ contra cancerului („împăratul
tuturor bolilor“), responsabil de unul din opt decese în întreaga lume.
Progresele deosebite în domeniul genomicii
cancerului s-au datorat tehnologiilor revoluţionare de analiză ADN. Prin
introducerea metodelor de secvenţiere a
întregului genom de generaţia a doua şi a treia (mai rapide, mai precise şi
mult mai ieftine), a devenit posibilă secvenţierea completă a genomului mai
multor tipuri frecvente de cancer (sân, plămân, prostată, diverse hemopatii
maligne ş.a.). Pe această bază, International
Cancer Genome Consortium (înfiinţat în 2008) şi-a propus ca obiectiv
principal „realizarea unui catalog complet al modificărilor genomice
semnificative asociate cancerului (denumit TCGA – TheCancer Genome Atlas)1,
pentru a accelera cercetările bazelor moleculare ale cancerului“ (5). Pe termen
scurt, se vor utiliza însă strategii de
secvenţiere „ţintită“ a regiunilor importante de ADN, cum ar fi întregul exom al genelor de cancer (totalitatea
secvenţelor codante sau exonii).
Biomarkeri moleculari
tisulari
În scopuri clinice, pentru determinarea unor
biomarkeri moleculari în biopsiile
tumorale, se utilizează tehnicile de
genotipare a mutaţiilor cunoscute
şi selectate. Folosind platforme cu
debit mare, de tipul microreţelelor (microarrays),
care permit analiza simultană a mii de mutaţii, este posibilă determinarea în
timp real („la patul bolnavului“) a mutaţiilor germinale sau somatice din
tumori, analiza metilării ADN (pentru
depistarea modificărilor epigenetice) şi stabilirea profilului de expresie genică. Foarte utilă în practica curentă
este însă determinarea (în ADN extras din eşantioane mici de biopsie tumorală)
unui „panel de mutaţii genice“ ce
afectează oncogene importante şi sunt prezente la pacienţii cu un anumit tip de
cancer. La acestea se adaugă metodele de citogenetică moleculară (bazate pe FISH – hibridizare fluorescentă in situ sau
pe array-CGH – microreţele de hibridizare genomică
comparativă), care vor depista alte aberaţii genomice: translocaţii, deleţii,
amplificări. Toate aceste tehnici, rapide şi relativ ieftine (deci accesibile şi
necesare în centrele oncologice de referinţă), permit diagnosticul precoce şi stabilirea subtipului molecular de cancer,
oferind soluţii pentru selectarea şi personalizarea unor terapii ţintite,
precum şi indicatori prognostici utili.
Biomarkeri moleculari
din circulaţia sanguină
În prezent, depistarea cancerelor frecvente
se bazează pe datele clinice şi pe diferite modalităţi imagistice. Cu toate
performanţele recente, tehnicile imagistice actuale dau un procent variabil de
rezultate fals-pozitive şi necesită alte procedee invazive pentru un diagnostic
definitiv. În aceste condiţii a devenit necesară descoperirea unor teste neinvazive adiţionale (practice şi
cost-eficiente), care să permită, cu ajutorul unor biomarkeri sanguini, diagnosticul şi monitorizarea bolii
canceroase. Identificarea acestor noi markeri moleculari a devenit posibilă
datorită progreselor recente remarcabile ale oncogenomicii în descifrarea
mecanismelor moleculare ale bolii canceroase, precum şi ale noilor tehnologii „multiomice“ (folosite în evaluarea
genomului, transcriptomului, proteomului şi metabolomului). Biomarkerii
sanguini vor permite screeningul şi
diagnosticul cancerelor în primele stadii, când intervenţiile curative sunt
încă posibile, clasificarea tumorilor
pe subtipuri moleculare şi selecţia
tratamentului specific, predicţia şi
monitorizarea răspunsului terapeutic şi a recidivelor (10).
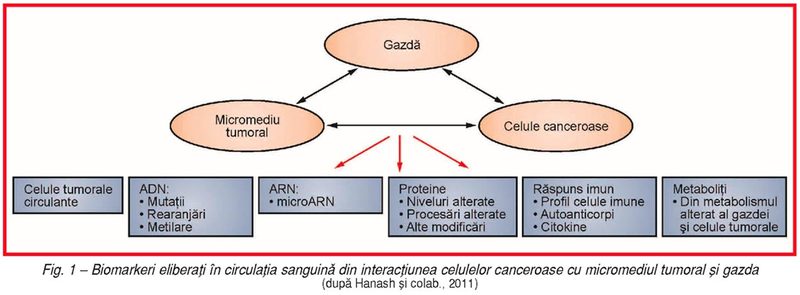
Biomarkerii
sanguini sunt reprezentaţi de diferite elemente moleculare şi celulare
circulante care provin din celulele canceroase, micromediul tumoral şi interacţiunile
lor cu gazda (fig. 1).
Primii markeri identificaţi şi utilizaţi în
clinică pentru screeningul unor forme de cancer au fost proteine circulante: CA125 (antigenul
de cancer 125) în cancerul ovarian, CEA (antigenul
carcinoembrionar) pentru cancerul de colon, PSA (antigenul prostatic specific), CA19-9 (antigenul carbohidrat 19-9) în cancerul pancreatic, AFP în hepatocarcinom.
Utilitatea lor este însă limitată de specificitatea şi sensibilitatea redusă
(reacţii fals-pozitive şi fals-negative), mai ales în primele stadii ale
cancerelor; în plus, pentru alte cancere frecvente (plămân, sân), nu au fost
descoperiţi markeri serici. Pe baza cercetărilor recente ale profilului proteomic în diferite
cancere, au fost identificaţi însă numeroşi noi markeri „candidaţi“ (în special
a şi b chemokine şi interleukine), cu utilitate diagnostică potenţială în
tumorile incipiente (de exemplu, chemokina CXCL7 permite identificarea
cancerului pulmonar cu până la 30 de luni înainte de diagnosticul clinic), mai
ales în determinări combinate (multiplex
immunoasay) (10). Aceşti markeri promiţători se află în stadiul de validare
clinică.
O altă categorie de markeri circulanţi o
reprezintă autoanticorpii faţă de
antigenele tumorale prezente în stadiile precoce ale bolii. De exemplu,
determinarea concomitentă (pe microreţele
proteice) a unor anticorpi multipli pentru un panel de şase antigene (BRCA1,
BRCA2, HER2, p53, c-myc, NY-ESO-1), folosită în diagnosticul cancerului de sân,
are o sensibilitate de 64% şi o specificitate de 85%. De asemenea, eficienţa
dozării beta-carotenului şi retinolului (studiul CARET), pentru diagnosticul
cancerului pulmonar în stadiul presimptomatic, se află în stadiul de validare
(10).
Progrese importante s-au obţinut şi în
determinarea plasmatică a profilului
metabolomic specific, prin măsurarea produşilor intermediari şi finali ai căilor
metabolice modificate genetic în cancer (de exemplu, glicoliza şi ciclul
Krebs).
Analiza
acizilor nucleici din plasmă poate reprezenta cea mai eficace metodă
neinvazivă de diagnostic precoce şi
monitorizare a pacientului (predicţia şi evaluarea răspunsului la tratament
sau detecţia recidivelor). Metodele preconizate se bazează pe identificarea în
plasmă a fragmentelor libere de ADN sau ARN, derivate din tumoră, şi
amplificarea lor prin PCR, urmată de secvenţiere; ADN se poate extrage şi din celulele tumorale circulante. Analiza
acizilor nucleici astfel obţinuţi a permis determinarea unor mutaţii specifice (de exemplu, în geneleKRAS sau TP53 în carcinoamele pancreatice), a hipermetilării ADN şi deci a inactivării unor gene (în cancerele de
plămân, sân, gastrointestinale) sau detecţia unor molecule specifice de microARN necodant, cu rol reglator (de
exemplu, miR-92 în cancerul colo-rectal sau miR-25 şi miR-223 în cancerul de plămân).
În prezent, se studiază posibilitatea
analizei ADN liber din plasmă sau ADN extras din celulele tumorale circulante,
pentru clasificarea moleculară a
tumorilor şi urmărirea răspunsului lor la tratament, fie înlocuind markerii
din ţesutul tumoral – mai greu accesibil –, fie completând şi actualizând
markerii tisulari. Promiţătoare este mai ales posibilitatea detectării unor noi
evenimente moleculare (mutaţii noi) ce se produc în anumite subtipuri de
cancere (pulmonar, de sân) în cursul terapiei ţintite, fără a se recurge la
biopsie tumorală.
În perioada următoare, se va evalua eficienţa
abordărilor „multiomice“ integrative,
prin selecţia şi validarea celor mai promiţători biomarkeri sanguini şi
determinarea lor concomitentă în variate situaţii clinice specifice:
screeningul populaţional, detecţia precoce, diagnosticul, evaluarea răspunsului
la tratamentul şi monitorizarea recidivelor.
Tratamentul bolii canceroase
Cea mai importantă problemă clinică în boala
canceroasă este însă optimizarea şi creşterea eficienţei tratamentului. Chimioterapia anticanceroasă (fie primară,
fie pre- sau postoperatorie) omoară celulele tumorale care se divid activ,
folosind agenţi citostatici (agenţi alchilanţi, antimetaboliţi, alcaloizi din
plante, antracicline etc.). Din păcate, sunt afectate şi celulele normale din
compartimentele proliferative (de exemplu, măduva hematogenă) producând numeroase
şi grave efecte secundare. O soluţie este administrarea citotoxicelor „în
cicluri“ (de obicei la interval de trei săptămâni), inclusiv pentru a permite
recuperarea ţesuturilor normale (care au mecanismele de reparare ADN intacte).
O alternativă recentă, bazată pe descifrarea
mecanismelor moleculare ale cancerogenezei, este terapia ţintită, ce vizează proteinele exprimate anormal în celule
neoplazice esenţiale pentru proliferarea acestora. Prototipul terapiei ţintite (numită metaforic „glonţul magic“) a fost descoperirea
(în 1990) a imatinibului, care inhibă specific o tirozin-kinază (BCR-ABL), a cărei
activare – prin translocaţia t(9;22)(q34;q11), cunoscută sub numele de
cromozomul Philadelphia – produce leucemia mieloidă cronică. Terapia ţintită
este o strategie importantă şi de succes, care foloseşte inactivarea
proteinelor (antigenelor) tumorale cu ajutorul unor anticorpi monoclonali sau inhibitori de tirozin-kinază (ce „ţintesc“
specific o anumită proteină-receptor, ligandul acesteia sau o componentă a căii
de semnal aferente), anticorpi conjugaţi
cu un agent citotoxic (medicament, toxină, ARN interferent, radioizotop) sau anticorpi imunomodulatori (12).
Anticorpii antitumorali distrug mult mai specific celulele canceroase (cu
anumite modificări genetice sau epigenetice), afectarea celulelor normale (care
nu au asemenea modificări) fiind minimă; în consecinţă, aceste terapii nu
comportă efectele secundare ale chimioterapiei tradiţionale, dar administrarea
lor continuă creşte riscul unor alte
efecte adverse serioase şi neaşteptate şi, în plus, duce la rezistenţa
celulelor canceroase faţă de tratament.
Distrugerea celulelor canceroase cu
anticorpi
se poate realiza prin trei mecanisme:
a. Acţiunea directă a anticorpilor monoclonali(fig. 2a), prin: • blocarea receptorilor sau a altor componente ale căilor de semnalizare
proliferativă; de exemplu, cetuximab
– inhibitor al receptorul factorului de creştere epidermal, EGFR – în cancerele
de colon sau ale sferei ORL; vemurafenib
– inhibitor specific al kinazei B-RAF implicată în calea de semnalizare MAPK („mitogen-activated protein kinase“), la
bolnavii cu melanom care prezintă o mutaţie specifică a genei B-RAF • activarea receptorilor ce induc apoptoza;
de exemplu, mapatumumab – agonist al
receptorului TRAIL (TNF-related
apoptosis-inducing ligand) – în tumorile de colon, plămân şi pancreas • anticorpi conjugaţi care eliberează o
„încărcătură citotoxică“ în celulele canceroase (de exemplu, gemtuzumab ozogamicin – în leucemia
mieloidă acută).
b. Distrugerea imun-dependentă a celulelor
canceroase(fig. 2b) prin: • citotoxicitate
celulară dependentă de anticorp (AADC) (de exemplu, rituximab – în limfoame) sau complement-dependentă (de exemplu, alemtuzumab – în leucemia limfocitară
cronică cu celule B) • fagocitoză mediată de receptorul Fc • modularea imună a
funcţiei celulelor T citotoxice (de exemplu, ipilimumab – în melanoame, carcinoame pulmonare sau de prostată).
c. Efecte specifice asupra vascularizaţiei
tumorale (fig. 2c) (de exemplu, bevacizumab – inhibitor al VEGF) sau stromei tumorale (de exemplu, sibrotuzumab – în cancerele de colon,
sân, plămân, pancreas) (12).
 Recent, a fost propusă o nouă abordare
terapeutică (pentru tumorile în care folosirea anticorpilor monoclonali nu este
posibilă), folosind inducţia apoptozei
prin fenomenul de letalitate sintetică (11).
Acest concept se bazează pe interacţiunea
genetică dintre două sau mai multe gene sau căi moleculare; inhibarea
singulară a oricăreia dintre gene sau căi implicate nu afectează viabilitatea
celulară, dar inhibarea lor combinată/concomitentă produce eliminarea selectivă
a clonelor de celule premaligne, fără efecte citostatice asupra celulelor
normale şi deci fără efecte toxice. Astfel, celulele canceroase dezvoltă
rezistenţă la apoptoză, prin activarea unor „căi
de supravieţuire celulară“, secundară unor mutaţii (de exemplu, a genei APC în cancerul colorectal sau a
oncogenei KRAS în cancerul pulmonar fără
celule mici); celulele canceroase cu aceste mutaţii pot fi eliminate prin
folosirea unei combinaţii sintetic-letale
între ligandul TRAIL din familia TNF şi retinilacetat,
care induce apoptoza2, dar numai în celulele cu mutaţii ale APC sau KRAS (11). Un alt exemplu de letalitate sintetică este reprezentat
de celulele canceroase cu mutaţii ale genelor de reparare ale leziunilor ADN
(de tipul BRCA1 şi BRCA2 în cancerul
ereditar de sân şi ovar sau PTEN în
cancerul de prostată). Administrarea unor inhibitori
ai PARP3 – poly-ADP-ribose-polimerase, o enzimă implicată în repararea ADN,
duce la cumularea efectelor (amplificarea rupturilor ADN) în celulele
canceroase şi moartea acestora; evident, inhibitorii PARP afectează celulele
normale într-o măsură mult mai mică (11). Efectele inhibitorilor PARP sunt
amplificate de radioterapie, care produce rupturi ale catenelor ADN. Din
exemplele de mai sus rezultă că acest concept al letalităţii sintetice poate fi
utilizat pentru o terapie personalizată
în cancer, determinată de profilul individual al mutaţiilor oncogenice.
Recent, a fost propusă o nouă abordare
terapeutică (pentru tumorile în care folosirea anticorpilor monoclonali nu este
posibilă), folosind inducţia apoptozei
prin fenomenul de letalitate sintetică (11).
Acest concept se bazează pe interacţiunea
genetică dintre două sau mai multe gene sau căi moleculare; inhibarea
singulară a oricăreia dintre gene sau căi implicate nu afectează viabilitatea
celulară, dar inhibarea lor combinată/concomitentă produce eliminarea selectivă
a clonelor de celule premaligne, fără efecte citostatice asupra celulelor
normale şi deci fără efecte toxice. Astfel, celulele canceroase dezvoltă
rezistenţă la apoptoză, prin activarea unor „căi
de supravieţuire celulară“, secundară unor mutaţii (de exemplu, a genei APC în cancerul colorectal sau a
oncogenei KRAS în cancerul pulmonar fără
celule mici); celulele canceroase cu aceste mutaţii pot fi eliminate prin
folosirea unei combinaţii sintetic-letale
între ligandul TRAIL din familia TNF şi retinilacetat,
care induce apoptoza2, dar numai în celulele cu mutaţii ale APC sau KRAS (11). Un alt exemplu de letalitate sintetică este reprezentat
de celulele canceroase cu mutaţii ale genelor de reparare ale leziunilor ADN
(de tipul BRCA1 şi BRCA2 în cancerul
ereditar de sân şi ovar sau PTEN în
cancerul de prostată). Administrarea unor inhibitori
ai PARP3 – poly-ADP-ribose-polimerase, o enzimă implicată în repararea ADN,
duce la cumularea efectelor (amplificarea rupturilor ADN) în celulele
canceroase şi moartea acestora; evident, inhibitorii PARP afectează celulele
normale într-o măsură mult mai mică (11). Efectele inhibitorilor PARP sunt
amplificate de radioterapie, care produce rupturi ale catenelor ADN. Din
exemplele de mai sus rezultă că acest concept al letalităţii sintetice poate fi
utilizat pentru o terapie personalizată
în cancer, determinată de profilul individual al mutaţiilor oncogenice. După un deceniu de cercetări intense şi
investiţii enorme, a fost introdus în practică doar un număr mic de medicamente
antitumorale „ţintite“ eficiente (circa 30), deoarece anomaliile genetice în cancer s-au dovedit a fi multiple şi complexe,
făcând dificilă identificarea unor „ţinte“. Mai mult, efectele obţinute cu
inhibitori specifici au fost tranzitorii,
fiind urmate de recidive; o explicaţie posibilă o reprezintă faptul că anumite
caracteristici distinctive ale clonelor neoplazice (de exemplu, proliferarea
excesivă) sunt realizate prin căi de semnalizare alternative, parţial
redundante: inhibarea unei căi nu blochează fenomenul, celula malignă începând
să utilizeze alte căi („rezistenţă
adaptativă“). Situaţia creată a impus investigarea amplă a tuturor căilor
de semnalizare activate excesiv în cancer, pentru dezvoltarea unei terapii combinate, care să permită
atacul concomitent al mai multor ţinte, diminuând riscul de recidivă.
Din păcate, problema se complică din cauza
faptului că genomul celulelor canceroase
evoluează pe măsura progresiei tumorale şi apare fenomenul de
heterogenitate intratumorală: existenţa unor subclone minore, ce derivă din
clona majoră, care au mutaţii adiţionale
(însă deseori în aceleaşi gene ca şi în clona iniţială). Evoluţia policlonală
„ramificată“ determină însă dificultăţi în folosirea unei terapii ţintite pe o
anumită proteină şi explică recurenţa tumorală după astfel de tratamente (noi
mutaţii conductoare, ce activează alte căi de semnalizare şi conferă rezistenţă
la tratament) (6). Dar leziunile genetice găsite în „trunchiul principal“
(clona iniţială) sunt exprimate şi în „ramurile sale“ (subclone). În aceste
condiţii, se impune schimbarea strategiilor terapeutice şi direcţionarea lor spre genă şi nu spre proteina codificată de genă,
urmărind inhibiţia ei funcţională sau restaurarea structurii ei normale (13).
Predispoziţia genetică în cancer
Într-un articol anterior (2), am discutat pe
larg despre importanţa determinării predispoziţiei
genetice la cancer în profilaxia bolii. Studiile efectuate până în prezent
relevă că în circa 30–35% din cancere
există o predispoziţie genetică, ce poate fi evidenţiată prin anamneză
familială şi/sau teste genetice, permiţând iniţierea unor măsuri profilactice eficiente la persoane sănătoase dar vulnerabile
(14, 15). În aceste condiţii, identificarea pacienţilor şi a familiilor cu
aceste tipuri de cancere devine imperativă, iar înfiinţarea unor servicii de „genetică oncologică“ în
clinicile de profil este necesară şi utilă pentru sfatul genetic, testarea şi
managementul persoanelor/familiilor cu risc crescut de a dezvolta cancer (16).
Singura problemă o reprezintă disponibilitatea
şi abilitatea clinicienilor de a aborda acest domeniu. Ca şi în cazul altor
teste genetice, medicii vor fi confruntaţi însă cu dificultăţi de interpretare, care cer o expertiză în domeniu
(actualizarea cunoştinţelor), precum şi cu probleme etice (de exemplu, confidenţialitatea,
comunicarea rezultatelor, păstrarea probelor ADN, testarea la copii etc.) şi
socioeconomice (rambursarea acestor teste, deosebit de utile, dar
costisitoare).
În
încheiere, vom sublinia din nou că toate realizările recente ale oncogenomicii
au deschis calea medicinii personalizate
în cancer, definită ca „o formă de
medicină care foloseşte informaţiile despre genele, proteinele şi mediul unei
persoane, pentru prevenirea, diagnosticul şi tratamentul bolii“ (US
National Cancer Institute). Importanţa acestei abordări este recunoscută de o echipă internaţională
de experţi, într-un articol special din Journal
of Clinical Oncology (2012), care concluzionează: „impactul potenţial al genomicii cancerului este enorm“ (5).
1TCGA se va realiza
prin analiza a 500 de tumori pentru fiecare din 50 tipuri de cancere diferite.
2TRAIL se fixează pe
receptorii DR4 şi DR5 („death
receptors“)
şi activează procaspazele 8 şi 10, declanşând apoptoza.
3Olaparib în cancerul ereditar de sân şi ovar sau
cancerul colorectal, iniparib în
cancerul pulmonar cu celule scuamoase.
 Recent, a fost propusă o nouă abordare
terapeutică (pentru tumorile în care folosirea anticorpilor monoclonali nu este
posibilă), folosind inducţia apoptozei
prin fenomenul de letalitate sintetică (11).
Acest concept se bazează pe interacţiunea
genetică dintre două sau mai multe gene sau căi moleculare; inhibarea
singulară a oricăreia dintre gene sau căi implicate nu afectează viabilitatea
celulară, dar inhibarea lor combinată/concomitentă produce eliminarea selectivă
a clonelor de celule premaligne, fără efecte citostatice asupra celulelor
normale şi deci fără efecte toxice. Astfel, celulele canceroase dezvoltă
rezistenţă la apoptoză, prin activarea unor „căi
de supravieţuire celulară“, secundară unor mutaţii (de exemplu, a genei APC în cancerul colorectal sau a
oncogenei KRAS în cancerul pulmonar fără
celule mici); celulele canceroase cu aceste mutaţii pot fi eliminate prin
folosirea unei combinaţii sintetic-letale
între ligandul TRAIL din familia TNF şi retinilacetat,
care induce apoptoza2, dar numai în celulele cu mutaţii ale APC sau KRAS (11). Un alt exemplu de letalitate sintetică este reprezentat
de celulele canceroase cu mutaţii ale genelor de reparare ale leziunilor ADN
(de tipul BRCA1 şi BRCA2 în cancerul
ereditar de sân şi ovar sau PTEN în
cancerul de prostată). Administrarea unor inhibitori
ai PARP3 – poly-ADP-ribose-polimerase, o enzimă implicată în repararea ADN,
duce la cumularea efectelor (amplificarea rupturilor ADN) în celulele
canceroase şi moartea acestora; evident, inhibitorii PARP afectează celulele
normale într-o măsură mult mai mică (11). Efectele inhibitorilor PARP sunt
amplificate de radioterapie, care produce rupturi ale catenelor ADN. Din
exemplele de mai sus rezultă că acest concept al letalităţii sintetice poate fi
utilizat pentru o terapie personalizată
în cancer, determinată de profilul individual al mutaţiilor oncogenice.
Recent, a fost propusă o nouă abordare
terapeutică (pentru tumorile în care folosirea anticorpilor monoclonali nu este
posibilă), folosind inducţia apoptozei
prin fenomenul de letalitate sintetică (11).
Acest concept se bazează pe interacţiunea
genetică dintre două sau mai multe gene sau căi moleculare; inhibarea
singulară a oricăreia dintre gene sau căi implicate nu afectează viabilitatea
celulară, dar inhibarea lor combinată/concomitentă produce eliminarea selectivă
a clonelor de celule premaligne, fără efecte citostatice asupra celulelor
normale şi deci fără efecte toxice. Astfel, celulele canceroase dezvoltă
rezistenţă la apoptoză, prin activarea unor „căi
de supravieţuire celulară“, secundară unor mutaţii (de exemplu, a genei APC în cancerul colorectal sau a
oncogenei KRAS în cancerul pulmonar fără
celule mici); celulele canceroase cu aceste mutaţii pot fi eliminate prin
folosirea unei combinaţii sintetic-letale
între ligandul TRAIL din familia TNF şi retinilacetat,
care induce apoptoza2, dar numai în celulele cu mutaţii ale APC sau KRAS (11). Un alt exemplu de letalitate sintetică este reprezentat
de celulele canceroase cu mutaţii ale genelor de reparare ale leziunilor ADN
(de tipul BRCA1 şi BRCA2 în cancerul
ereditar de sân şi ovar sau PTEN în
cancerul de prostată). Administrarea unor inhibitori
ai PARP3 – poly-ADP-ribose-polimerase, o enzimă implicată în repararea ADN,
duce la cumularea efectelor (amplificarea rupturilor ADN) în celulele
canceroase şi moartea acestora; evident, inhibitorii PARP afectează celulele
normale într-o măsură mult mai mică (11). Efectele inhibitorilor PARP sunt
amplificate de radioterapie, care produce rupturi ale catenelor ADN. Din
exemplele de mai sus rezultă că acest concept al letalităţii sintetice poate fi
utilizat pentru o terapie personalizată
în cancer, determinată de profilul individual al mutaţiilor oncogenice.