Predispoziţia genetică
la cancer – o soluţie valoroasă de profilaxie a bolii
Studiile epidemiologice efectuate între anii
1940 şi 1950 au stabilit că boala canceroasă este produsă de numeroase şi
variate cauze. Factorii de mediu sunt consideraţi principala cauză în dezvoltarea
cancerelor; în aproximativ 75% din cazuri sunt implicate: dieta, substanţele
cancerigene (de exemplu, fumul de ţigară, responsabil de 20% din toate
cancerele), radiaţiile ionizante sau ultraviolete, infecţiile virale (de
exemplu, virusurile papilloma sau hepatitice B şi C) sau bacteriene (de
exemplu, Helicobacter pylori în
cancerul gastric) etc. (1). Studiile epidemiologice au evidenţiat însă şi incidenţa familială crescută, precum şi
riscul crescut la rudele de gradul I ale bolnavilor de cancer. Agregarea
familială ar putea fi explicată de acţiunea unor factori comuni de mediu sau de
apariţia întâmplătoare, la mai mulţi membri ai unei familii, a unei boli
frecvente. Fără a exclude aceste ipoteze şi nici rolul major al factorilor de
mediu, numeroase studii privind cancerele familiale au demonstrat că există o susceptibilitate ereditară / o predispoziţie
genetică, cu un rol foarte important. Pentru existenţa unei predispoziţii
genetice pledează şi concordanţa mai mare a bolii canceroase la gemenii
monozigoţi (cu aceeaşi ereditate), comparativ cu gemenii dizigoţi sau cu
fratria (cu eredităţi diferite). În aceste condiţii, în jurul anilor ’80, a
început „bătălia“ pentru descoperirea
genelor de susceptibilitate la cancer (în special în cancerele frecvente)
care ar permite: • identificarea persoanelor sănătoase cu risc crescut de
cancer, la care s-ar putea iniţia acţiuni profilactice • înţelegerea mai amplă
a mecanismelor biologiei tumorale şi găsirea unor „ţinte“ potenţiale pentru
tratament.
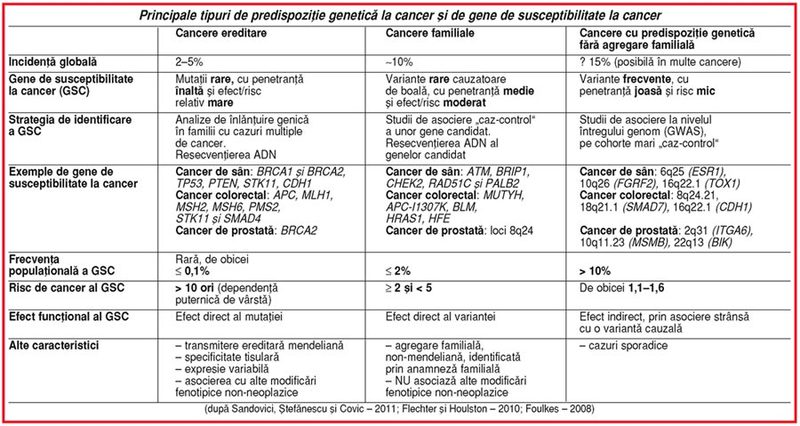
Principala trăsătură care permite recunoaşterea clinică a existenţei unei
predispoziţii genetice este istoricul
familial pozitiv. Dar predispoziţia genetică la cancer poate îmbrăca un spectru larg, de la existenţa unor forme
rare de cancere ereditare sau a unor
forme mai frecvente de cancere familiale,
până la forme comune de cancere cu predispoziţie genetică dar fără istoric familial sugestiv (v. tabelul). În mod paradoxal, ultima
categorie de cancere, fără agregare familială evidentă, reprezintă forma cea
mai frecventă de cancere cu predispoziţie genetică (1). Celor trei tipuri de
predispoziţie genetică la cancer (definite prin anamneză familială) le
corespund, în mare măsură, trei clase majore de gene de susceptibilitate la cancer (identificate prin diferite
tehnici de analiză genetică): • mutaţii rare,
cu penetranţă înaltă şi risc relativ mare • variante rare cauzatoare de boală, cu penetranţă medie şi risc moderat • variantecomune/frecvente de susceptibilitate,
cu penetranţă redusă şi risc mic (2). Se estimează că genele de
susceptibilitate la cancer determină aproximativ 30% din riscul total de cancer
în populaţia generală (3).
Cancerele ereditare
Se cunosc aproximativ 50 de sindroame cu transmitere ereditară mendeliană, care
se asociază cu un risc mare de dezvoltare a unor forme specifice de cancer.
Exemplele cele mai cunoscute sunt: cancerul de sân şi de ovar, polipoza adenomatoasă
familială (FAP), cancerul colorectal non-polipozic ereditar (HNPCC),
neurofibromatoza tip 1 şi tip 2, neoplaziile endocrine multiple (MEN1 şi MEN2),
sindromul Li-Fraumeni, retinoblastomul familial etc. Majoritatea acestor boli
sunt transmise autozomal dominant (risc de recurenţă de 50%), dar
există şi sindroame cu transmitere recesivă (de exemplu, anemia Fanconi sau
ataxia-telangiectazia).
Pentru unele tipuri de cancere (de exemplu,
cancerul colorectal) s-au descris forme
ereditare, cu debut în copilărie, dar şi
forme sporadice, ce apar la adulţi. Pentru a explica diferenţele între
aceste forme de neoplazie malignă, Knudson a propus (în 1971) ipoteza celor „două lovituri“ („two hits“)
necesare pentru transformarea unei celule normale într-o celulă tumorală, prin
mutaţiile unei perechi de gene (N/N). În cazurile ereditare, prima mutaţie este moştenită şi prezentă de la naştere în toate
celulele persoanei „susceptibile“,
care este heterozigotă (N/a); posibilitatea apariţiei unei noi mutaţii care să
inactiveze a doua alelă în cel puţin o celulă a organismului este crescută şi,
ca urmare, „pierderea heterozigozităţii (N/a
→ a/a)1 poate apărea la o vârstă tânără, în una sau
mai multe celule, explicând apariţia mai
timpurie a tumorilor, deseori multicentrice.
În cazurile sporadice, mutaţiile celor două gene se produc succesiv (N/N → N/a → a/a), dar mai târziu în cursul vieţii
individului respectiv.
Analizele genetice efectuate în familiile
bolnavilor cu cancere ereditare au permis identificarea a numeroase gene de susceptibilitate (v. tabelul). Acestea prezintă mutaţii rare (≤ 0,1% din populaţie), cu
penetranţă2 înaltă şi risc relativ mare (≥ 10%, frecvent peste
50–80%).
În prezent, se cunosc circa 100 de gene (în majoritate gene supresoare de tumori) care au mutaţii germinale cu penetranţă
înaltă ce produc o predispoziţie genetică transmisă mendelian; ele explică mai
puţin de 5% din toate cancerele cu predispoziţie genetică (3).
Toate cancerele ereditare au un grad crescut
de specificitate tisulară, iar
manifestările fenotipice ale mutaţiilor cauzale prezintă o variabilitate substanţială
privind vârsta de debut şi tipul de cancer ce predomină în cadrul unor familii
(1). Important este însă faptul că, deseori, aceste sindroame de cancere ereditareasociază manifestări fenotipice non-neoplazice, care permit specialiştilor
diagnosticul precoce şi profilaxia secundară a tumorilor. În acest context, vom
sublinia că testarea genetică, pentru
identificarea persoanelor sănătoase dar cu risc crescut de cancer din aceste
familii, este posibilă şi benefică, făcând parte din managementul standard al
acestui tip de neoplazii (în caseta
alăturată reluăm un exemplu convingător, prezentat într-un articol anterior).
Dintre cancerele ereditare, poate cel mai frecvent
este cancerul de sân şi ovar ereditar (circa
10–15% din toate cancerele de sân), prezent la circa 1:500–1:1000 persoane din
populaţia generală, care au mutaţii ale genelor supresoare de tumori BRCA1 şi BRCA2 („breast-cancer gene 1 and
2“) şi mai rar ale altor gene (v.
tabelul). Riscul dezvoltării unui cancer de sân la femeile purtătoare de
mutaţii în genele BRCA1 şi BRCA2 este
de 90% pe parcursul întregii vieţi şi de 60% până la vârsta de 50 de ani
(penetranţă înaltă). Persoanele din familiile cu cazuri multiple de cancer de
sân şi/sau ovar trebuie să beneficieze de consult şi teste genetice şi, în
cazul identificării unor mutaţii germinale ale genelor BRCA1 ori BRCA2, trebuie incluse în programe speciale de
supraveghere şi profilaxie (1, 4).
Aproape la fel de frecvent este şi cancerul colorectal non-polipozic ereditar (HNPCC)
sau sindromul Lynch (1:1000
persoane), responsabil de 3–6% din cancerele de colon. Această afecţiune
ereditară, cu transmitere autozomal dominată, se deosebeşte de cancerele de
colon sporadice prin debutul mai precoce (vârsta medie fiind de 42 de ani),
localizarea predominantă la hemicolonul drept, frecvenţa unor tumori multiple şi
prognosticul mai bun (v. caseta).
HNPCC este cauzat de mutaţii germinale ale genelor MMR (MLH1, MSH2, MSH6), care intervin în repararea erorilor de
împerechere („mismatch repair“) ale
nucleotidelor în cursul replicării ADN, ce pot fi evidenţiate prin teste
genetice („testul de instabilitate a microsateliţilor“).
O altă boală din aceeaşi categorie este polipoza adenomatoasă familială (FAP),
cu frecvenţă rară de 1:10.000 persoane (răspunzătoare de circa 1% din
cancerele de colon), caracterizată prin dezvoltarea a sute sau mii de polipi
adenomatoşi de-a lungul colonului şi rectului, care se transformă malign până
la vârsta de 40 de ani. Depistarea precoce se poate face prin anamneză familială,
prezenţa unor manifestări non-neoplazice: osteoamele mandibulare frecvente şi
hipertrofia congenitală a epiteliului retinian (CHRPE – de la „congenital hypertrophy of the retinal pigment) şi,
evident, prin testare genetică (mutaţii ale genei APC, cauzatoare de boală) (1, 4).
Cancerele
familiale
Genele
de susceptibilitate identificate în cancerele ereditare de sân sau colorectale
nu explică decât 20–40% din riscul familial crescut. O mare parte din
susceptibilitatea la cancerele familiale (â10% dintre toate cancerele) – în
special ginecologice şi digestive – este rezultatul unui model poligenic, în care moştenirea unor multiple variante cauzale rare (≤ 2%), cu penetranţă
medie, fiecare cu un efect/risc individual moderat (2–5%), poate determina
o mare parte din riscul populaţional (v.
tabelul) (2). Spre deosebire de formele ereditare, care se asociază
frecvent cu alte modificări fenotipice non-neoplazice, în cancerele familiale
singura trăsătură care poate fi recunoscută este agregarea familială, ceea ce
face şi mai importantă anamneza familială corectă.
Studiul
acestei forme de predispoziţie genetică (prin analize „caz-control“ de asociere
a unor gene candidat cu markeri genetici anonimi de tip SNP3) este important atât pentru implicaţiile
privind sănătatea publică, cât şi pentru posibilitatea identificării unor noi
procese relevante pentru dezvoltarea cancerelor.
Unele
dintre mutaţiile identificate în cancerele familiale sunt localizate la nivelul
aceloraşi gene implicate şi în formele ereditare de boală (de exemplu, mutaţia
I1307K a genei APC). Cele mai multe
mutaţii sunt însă localizate la nivelul unor gene noi (v. tabelul) şi de aceea relaţiile cauzale dintre aceşti loci şi
patogeneza cancerelor respective nu sunt încă bine înţelese. Mai mult chiar,
unele alele nou identificate nu sunt localizate în interiorul unor gene, ci în
regiunile intergenice, iar mecanismul prin care cresc riscul de apariţie al
cancerului rămâne şi mai obscur. Este interesant şi faptul că unele dintre
alelele nou identificate par a fi răspunzătoare de creşterea riscului pentru
cancer mai ales în anumite populaţii, cel mai probabil ca urmare a unui efect de fondator4 (1).
Cancerele cu predispoziţie genetică fără istoric familial
Deşi
considerate în cea mai mare parte rezultatul intervenţiei factorilor de mediu,
majoritatea cancerelor sunt incluse în prezent în categoria bolilor multifactoriale, componenta
genetică şi cea de mediu având ponderi variabile de la caz la caz.
Studiile de asociere la scara întregului
genom (genome-wide association
studies – GWAS)5 au condus în ultimii ani la identificarea a
peste 150 de regiuni cromozomiale / loci de susceptibilitate, în 24 de tipuri
de cancer, ce conţin variante genetice
frecvente/comune (>10% din populaţie), cu penetranţă joasă dar cu efecte/risc mic de dezvoltare a cancerelor
(de cel mult 1,5 ori mai mare, comparativ cu riscul înregistrat în populaţia
generală) (5).
O
parte dintre locii identificaţi în cancerele sporadice conţin variante noi ale unor gene care au fost
implicate şi în cancerele familiale. Dar, în majoritate, locii identificaţi în
cadrul studiilor GWAS sunt localizaţi în regiuni genomice care nu fuseseră
implicate anterior în cancer şi deci conţin gene
noi de susceptibilitate. Pentru câteva dintre variantele genetice nou
identificate, cum ar fi FGFR2 în
cancerul de sân şi MSMB în cancerul
de prostată, au fost elucidate mecanismele de acţiune. Totuşi, pentru
majoritatea variantelor genetice, rolul lor funcţional este încă neelucidat şi
se crede că intervin în căi patogenice
noi. De exemplu, în cancerul colorectal au fost identificaţi zece loci noi
implicaţi în calea de semnalizare a superfamiliei TGF-β.
Interesant
de semnalat este faptul că unele dintre noile regiuni cromozomiale asociate cu
susceptibilitatea la cancer nu conţin gene ce codifică proteine, ci gene ARN
sau elemente de control ce reglează gene situate la distanţă. Spre exemplu, un
marker SNP localizat în regiunea 8q24.21, asociat cu cancerul colorectal şi cu
cancerul de prostată, prezintă o variantă a unui element activator („enhancer“) care reglează oncogena MYC, aflată la 300 de kilobaze de
acesta.
Majoritatea
locilor de susceptibilitate sunt specifici
unui anumit tip de cancer sau chiar unor subtipuri specifice de boală (de exemplu, FGFR2 pentru cancerele de sân pozitive pentru receptorul
estrogenic) (5). Utilitatea clinică a identificării acestor variante în predicţia personalizată a riscului de
boală este limitată în momentul de faţă, însă se estimează că acest fapt se va
schimba radical odată cu identificarea unor noi variante de risc. Există însă şi
abateri de la „regula specificităţii“, deoarece unele gene de susceptibilitate
(de exemplu, gena telomerazei TERT)
au efecte pleiotrope, fiind implicate în mai multe tipuri de tumori.
Studiile
de asociere la scara întregului genom (GWAS) au stabilit că arhitectura
susceptibilităţii genetice la cancer este mult mai complexă decât se
anticipa şi, foarte probabil, diferită la cancere diferite, indicând mecanisme
patogenice distincte (3, 5). Rezultatele obţinute până în prezent, deşi
reprezintă un succes incontestabil, explică însă numai o parte din ponderea
eredităţii (numită heritabilitate) în
etiologia cancerelor. Într-adevăr, GWAS nu pot evidenţia variante rare (<
0,5–1%) dar cu efecte mari sau asocierea altor variaţii genomice structurale (CNV – variaţii ale numărului de cópii, indels – inserţii şi deleţii mici, inversii etc.) cu susceptibilitatea la
cancer. În aceste condiţii, asistăm la o
schimbare a strategiei de studiu bazată pe noile generaţii de tehnici de
secvenţiere a genomului tumoral, precum şi pe studiul interacţiunilor dintre
gene sau dintre gene şi mediu (au fost deja identificate gene ce cresc vulnerabilitatea individuală la unii cancerigeni din
mediu; de exemplu, CRNA3/5 la fumat
în cancerul pulmonar, NAT2 la fumat
în cancerul de vezică sau loci pentru pigmentaţie în cancerul cutanat) (5).
În încheiere, anticipăm întrebarea firească a
cititorilor care află noile descoperiri ale oncogenomicii privind
susceptibilitatea la cancer: ce învăţăminte şi, mai ales, ce consecinţe
clinice practice aduc aceste progrese ştiinţifice remarcabile?
Studiile
efectuate până în prezent relevă că, în
circa 30% din cancere, există o predispoziţie genetică, ce poate fi evidenţiată
prin anamneză familială şi/sau teste genetice, permiţând iniţierea unor măsuri profilactice eficiente (3). În
aceste condiţii, recunoaşterea pacienţilor şi familiilor cu aceste tipuri de
cancere devine imperativă iar înfiinţarea unor servicii de „genetică oncologică“,
în clinicile de profil, este necesară şi utilă pentru sfatul genetic, testarea şi
managementul persoanelor/familiilor cu risc crescut de a dezvolta cancer (4) (v. şi caseta alăturată).
Cancerul colorectal non-polipozic ereditar
(prezentare de caz)
După
o emisiune medicală despre cancerele familiale, urmărită pe Discovery Channel, Radu P. (37 de ani)
consultă medicul de familie deoarece sora sa mai mare, Elena (46 de ani), a
fost operată de cancer colorectal, iar mama lor a decedat de cancer uterin
(endometrial). Medicul remarcă ironic că este prea tânăr pentru a face cancer
(?!), dar îl trimite la un gastroenterolog pentru o colonoscopie de screening.
Deşi specialistul „(…) nu identifică polipi adenomatoşi pe colon sau rect“, are
„inspiraţia“ să-l trimită la un genetician. Cei doi medici ar fi trebuit să
realizeze o anamneză familială corectă/completă şi, la alte cazuri
identificate, să întrebe vârsta fiecărui bolnav la debutul cancerului, tipul de
cancer, localizarea etc. Ar fi aflat astfel că bunicul patern a murit la 60 de
ani de cancer de colon non-polipozic, cu localizare pe hemicolonul drept, la
fel ca şi sora probandului. Se îndeplinesc astfel criteriile Amsterdam II
pentru diagnosticul clinic de cancer colorectal non-poliplozic, o afecţiune
ereditară cu transmitere dominantă
autozomală (Radu are un risc de 50% de a face boala), cunoscută şi sub
numele de sindromul Lynch.
Această
formă de cancer este produsă de mutaţii ale genelor MMR, care intervin în repararea erorilor de replicare ale ADN, mutaţii
posibil de diagnosticat prin testare genetică. Efectuarea testării la sora
pacientului ar oferi informaţii pentru un diagnostic genotipic presimptomatic
(în absenţa unor leziuni macroscopice vizibile la colonoscopie) la pacientul
Radu P.
Testarea genetică pentru genele cu
penetranţă înaltă este posibilă în multe laboratoare (vezi www.genetests.org) şi sunt disponibile ghiduri practice care stabilesc pacienţii care vor fi testaţi şi ce
teste ar trebui realizate în diferite situaţii. Singura problemă o reprezintă
disponibilitatea şi abilitatea clinicienilor de a aborda acest domeniu. Poate
cea mai bună motivaţie o reprezintă evaluările recente – prezentate la ultimul
congres al Societăţii Americane de Oncologie Clinică (Chicago, iunie 2012) –
potrivit cărora 10% din cancerele adultului şi 25% din neoplaziile survenite la
copii şi adolescenţi sunt produse prin mutaţii germinale cu penetranţă înaltă,
ce pot fi identificate prin analize genotipice (6). Ca şi în cazul altor teste
genetice, medicii vor fi confruntaţi însă cu dificultăţi de interpretare, care
cer o expertiză în domeniu, precum şi cu probleme etice (de exemplu, testarea
la copii) şi sociale (de exemplu, rambursarea acestor teste, care sunt deosebit
de utile, dar costisitoare).
O problemă delicată este utilizarea variantelor comune de susceptibilitate la cancer, evidenţiate
prin GWAS, pentru predicţia riscului de cancer. Deşi au apărut deja teste
comerciale accesibile direct „consumatorilor“, în opinia specialiştilor este
încă „prea devreme“ să le folosim în predicţia vulnerabilităţii la cancer.
Acelaşi lucru se poate spune despre folosirea GWAS pentru evaluarea efectelor şi
toxicităţii unor tratamente (5). Devine evident că integrarea practică a
rezultatelor cercetărilor oncogenomicii în sfera „predicţiei“ riscului şi evoluţiei
bolii canceroase necesită studii viitoare pentru validarea utilităţii determinării
variantelor genetice comune de risc.
1Deşi sindroamele cu cancere ereditare se
transmit dominant autozomal (unul dintre părinţi transmite o alelă mutantă la
50% din copii, care vor fi heterozigoţi, N/a), la nivel celular ele sunt
recesive, tumorile apar la indivizii deveniţi homozigoţi (prin pierderea
heterozigozităţii);
2Penetranţa este probabilitatea
unei gene mutante dominante de a se manifesta fenotipic, indiferent de
intensitate; poate fi penetranţă completă (toţi indivizii ce poartă alela
mutantă o manifestă fenotipic) şi incompletă (înaltă/medie/joasă);
3Reamintim că prin prescurtarea SNP (de la single nucleotid polymorphism) se înţelege
polimorfismul unui singur nucleotid;
4Unele boli genetice pot fi frecvente într-o
anumită populaţie în care indivizii sunt descendenţi ai unui număr mic de strămoşi,
din care unul sau câţiva au o anumită boală (mutaţie);
5GWAS sunt studii de tip „caz-control“, pe
cohorte mari, fără cunoştinţe anterioare
despre localizarea şi funcţia genelor de susceptibilitate identificate.
Această „abordare agnostică“ diferă
de studiile de asociere cu gene candidat, utilizate în cancerele familiale
descrise anterior.