
Fibrilaţia atrială este cea mai frecventă aritmie susţinută întâlnită în practica medicală, în ciuda progreselor în tratament, ea rămânând unul dintre principalii determinanţi ai apariţiei accidentului vascular cerebral, insuficienţei cardiace și decesului.
Creșterea continuă a prevalenţei fibrilaţiei atriale poate fi atribuită atât îmbătrânirii populaţiei, cu o acumulare continuă a factorilor de risc, cât și îmbunătăţirii metodelor de detecţie a aritmiei. Diagnosticul fibrilaţiei atriale se bazează pe documentarea electrocardiografică a unui pattern specific caracterizat prin absenţa oricăror unde P decelabile și intervale RR neregulate, prin convenţie fiind diagnostice episoadele cu durata de peste 30 de secunde (1).
Diagnosticul fibrilaţiei atriale se bazează pe documentarea electrocardiografică a unui pattern specific caracterizat prin absenţa oricăror unde P decelabile și intervale RR neregulate, prin convenţie fiind diagnostice episoadele cu durata de peste 30 de secunde (1).
Această definiţie, deși unanim acceptată, transformă fibrilaţia atrială dintr-o boală într-un fenotip electrocardiografic, ușor de recunoscut, dar total inadecvat pentru o abordare clinică adecvată. Este foarte puţin probabil ca un tânăr cu cord structural normal, care prezintă un unic episod de fibrilaţie atrială cu ocazia unui efort fizic extrem, să aibă aceeași aritmie ca un vârstnic, protezat mitral și fiind în fibrilaţie atrială permanentă de peste 20 de ani, doar pentru căaspectul electrocardiografic este identic.
Definită printr-un pattern electrocardiografic caracteristic, fibrilaţia atrială presupune obligatoriu o alterare a propagării electricităţii la nivel atrial. Din acest punct de vedere, este clar că fibrilaţia atrială este în esenţa ei o boală a electricităţii miocardice.
Elementul-cheie al propagării excitaţiei la nivelul miocardului în fibrilaţia atrială îl constituie prezenţa unor fronturi de activare electrică care se mișcă aleatoriu prin miocard în jurul unor zone de ţesut refractar. Fiecare dintre aceste fronturi poate fi accelerat sau încetinit, după cum ele întâlnesc ţesut miocardic într-o stare de recuperare a excitabilităţii mai mult sau mai puţin avansată. Ele se pot stinge, divide sau combina cu fronturile învecinate și continuă să fluctueze în dimensiune și să își schimbe direcţia de propagare în funcţie de coridoarele disponibile de ţesut excitabil (2).
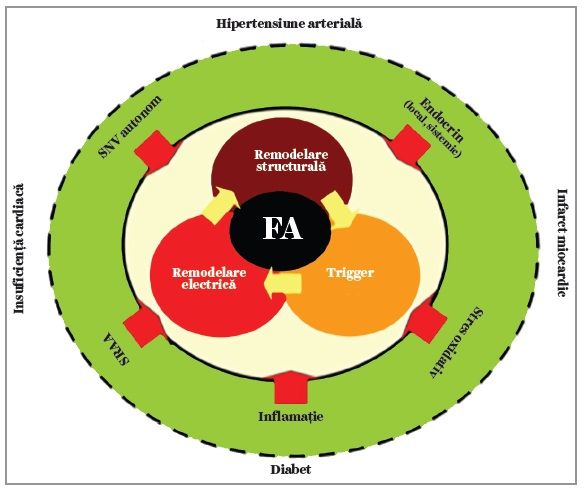
Modificarea propagării excitaţiei la nivelul miocardului atrial în timpul fibrilaţiei atriale este datorată interacţiunii dintre trei factori: remodelarea structurală, remodelarea electrică și factori trigger.
Modificările structurale ale atriilor au fost printre primii factori corelaţi cu apariţia fibrilaţiei atriale. Însăși structura anatomică a atriilor, cu multiple neregularităţi ale suprafeţelor și prezenţa a numeroase orificii (vene cave, vene pulmonare, orificiul mitral sau tricuspidian), creează chiar la atriul normal condiţiile apariţiei circuitelor de reintrare (3). Microscopic, modificările care predispun la fibrilaţia atrială sunt reprezentate de fibroza interstiţială și de înlocuire, infiltraţia grăsoasă, depozitele inflamatorii și de amiloid. Acestea determină alterarea conducerii intraatriale, favorizând reintrarea și perpetuarea fibrilaţiei atriale (1). Este însă dificil de precizat cât dintre aceste modificări reprezintă cauza și cât consecinţa fibrilaţiei atriale.
Remodelarea electrofiziologică se realizează prin modificarea expresiei unor canale ionice, îndeosebi de potasiu, alterarea dinamicii calciului intracelular și redistribuirea joncţiunilor intercelulare de tip gap. Modificarea expresiei canalelor de potasiu scurtează durata potenţialului de acţiune și favorizează perpetuarea circuitelor de reintrare, la fel ca redistribuirea joncţiunilor de tip gap. Alterarea dinamicii calciului intracelular predispune la automatism anormal prin postdepolarizări tardive (4). Ca și în cazul remodelării structurale, este dificil de precizat cât dintre aceste modificări reprezintă cauza și cât consecinţa fibrilaţiei atriale.
În condiţiile existenţei unui substrat electric și anatomic, cel de-al treilea factor necesar pentru declanșarea fibrilaţiei atriale îl constituie existenţa unui factor trigger. Acesta poate fi reprezentat, de exemplu, de o extrasistolă atrială responsabilă de iniţierea reintrării sau de ritmuri atriale prea rapide ori prea lente. Îndeosebi rolul focarelor atriale cu origine la nivelul venelor pulmonare a fost reconsiderat în ultimele două decenii, după demonstrarea faptului că activitatea susţinută a acestor focare, urmată de incapacitatea miocardului atrial de a urma 1:1 această activitate, poate genera un pattern electrocardiografic de fibrilaţie atrială, iar înlăturarea acestor focare prin tehnici ablative poate fi curativă (5).
Înţelegerea interrelaţiei complexe între cele trei componente ale substratului electric permite diferenţierea mai multor tipuri de fibrilaţie atrială, cu implicaţii practice. Astfel, este deja clasică diferenţierea în fibrilaţie atrială trigger-dependentă, în care focare de automatism cu descărcări mai mult sau mai puţin susţinute localizate cel mai adesea la nivelul venelor pulmonare declanșează episoade aritmice repetitive - și fibrilaţia atrială dependentă de substrat, în care perpetuarea circuitelor de reintrare este determinată de modificările electrice și structurale la nivelul miocardului atrial. Caracteristicile clinice ale celor două forme de aritmie sunt relativ distincte (6) și, ceea ce este mai important, ele sunt abordate terapeutic diferit, înlăturarea triggerilor prin procedura de izolare ablativă a venelor pulmonare putând fi curativă în fibrilaţia atrială trigger-dependentă.
Este însă important de reţinut că cele două forme de fibrilaţie atrială nu reprezintă decât extremele unui spectru foarte larg în care componenta trigger și cea legată de substrat se întrepătrund în proporţii extrem de variabile de la un pacient la altul sau chiar, în evoluţie, la același pacient. Astfel, un elegant model experimental, susţinut apoi de numeroase date clinice, demonstrează că fibrilaţia atrială generează ea însăși fibrilaţie atrială (atrial fibrillation begets atrial fibrillation) prin remodelarea electrică ce scurtează refractaritatea la nivel atrial și creează premisele unor circuite de reintrare mai stabile (7). Implicaţiile practice imediate ale acestui concept sunt legate pe de-o parte de nevoia de tratare promptă a episoadelor aritmice, pentru a preveni apariţia remodelării electrice, iar pe de altă parte de utilitatea medicaţiei care previne remodelarea sau reversează modificările electrice induse de remodelare, în scopul de a reduce riscul de recidive aritmice. Remodelarea structurală poate modifica și ea ponderea componentei de substrat în fibrilaţia atrială, cu importanţă în decizia terapeutică. De exemplu, aprecierea prin IRM a gradului de fibroză atrială ca marker al remodelării structurale se corelează bine cu succesul terapiei de izolare a venelor pulmonare adresată înlăturării triggerilor aritmici (8).
Deși rare, anumite forme clinice de fibrilaţie atrială argumentează foarte bine importanţa terapeutică a înţelegerii componentelor mecanismelor electrofiziologice implicate în patogeneză. Astfel, este cunoscută predispoziţia particulară pentru fibrilaţie atrială a pacienţilor cu episoade de tahicardie prin reintrare atrioventriculară mediată de o cale accesorie, predispoziţie la care contribuie scurtarea refractarităţii prin remodelare legată de activarea rapidă, dar și distensia atrială prin contracţia atriului contra unor valve atrioventriculare închise, producând și prin aceasta scurtarea refractarităţii atriale și dispersia inomogenă a acestei scurtări (9). Rolul acestor mecanisme este concludent demonstrat de faptul că, la acești pacienţi, tratamentul prin ablaţia căii accesorii duce adesea la dispariţia completă a episoadelor de fibrilaţie atrială.
De asemenea, bradicardia, prin dispersia refractarităţii la nivel atrial, favorizează vulnerabilitatea atrială, cardiostimularea atrială reducând considerabil, adesea până la dispariţie, numărul episoadelor de fibrilaţie atrială.
Deși o abordare bazată pe înţelegerea mecanismelor electrofiziologice este extrem de atractivă din punct de vedere academic, pentru translatarea acestor concepte în clinică este foarte important a se reţine că proprietăţile electrice și ultrastructura miocardului atrial sunt influenţate de multiple mecanisme de reglare care, la rândul lor, sunt modificate în numeroase situaţii normale sau patologice (vezi figura).
Implicarea sistemului nervos vegetativ în mecanismul fibrilaţiei atriale a fost propusă de Coumel, care diferenţiază două forme caracteristice de fibrilaţie atrială: prin mecanism vagal și prin mecanism adrenergic (10).
Fibrilaţia atrială prin mecanism vagal este iniţiată în condiţiile dominanţei tonusului parasimpatic (noaptea, postprandial), fiind precedată de o perioadă de bradicardie pe fondul căreia o extrasistolă declanșează episodul aritmic, fibrilaţia atrială de acest tip alternând cu activitate atrială organizată de tip flutter. Mecanismul fibrilaţiei atriale vagale a fost demonstrat pe numeroase modele experimentale, factorii care contribuie la inducţia aritmiei fiind reprezentaţi de scurtarea refractarităţii miocardice cu neuniformitatea acestei scurtări, întârzierea conducerii intraatriale și bradicardia care crește susceptibilitatea pentru reintrare.
Fibrilaţia atrială prin mecanism adrenergic apare în condiţiile dominanţei tonusului simpatic (efort, stres), aritmia fiind precedată de o perioadă de tahicardie sinusală alternând cu salve de tahicardie atrială. Deși clasificarea fibrilaţiei atriale în funcţie de modificările tonusului sistemului nervos vegetativ pare o ipoteză atractivă, furnizând și indicaţii terapeutice, majoritatea formelor clinice de fibrilaţie atrială nu pot fi încadrate riguros în una dintre clase. Mai mult, se pare că automatismul anormal prin postdepolarizări tardive ale focarelor din venele pulmonare este dependent de o anumită balanţă între tonususul simpatic și parasimpatic (11).
Este unanim acceptat că hiperactivitatea sistemului renină-angiotensină-aldosteron participă la patogeneza fibrilaţiei atriale prin multiple mecanisme, cum ar fi remodelarea și fibroza atrială, modularea unor canale ionice și a joncţiunilor de tip gap, ponderea lor fiind puternic dependentă de tipul patologiei cardiovasculare (12). Aceasta face probabil ca și rezultatele terapiei care modulează sistemul renină-angiotensină-aldosteron în prevenţia fibrilaţiei atriale să fie oarecum contradictorii.
Pe de altă parte însă, această terapie are indicaţie obligatorie în majoritatea situaţiilor clinice asociate cu activarea în exces a acestui sistem de reglare, rolul în prevenţia fibrilaţiei atriale în absenţa acestor patologii fiind încă discutabil.
Rolul inflamaţiei ca factor predispozant pentru fibrilaţia atrială este susţinut de studii clinice și experimentale care demonstrează implicarea acesteia în remodelare structurală și fibroză. Mecanismul exact prin care inflamaţia determină acest lucru nu este clar, dar există studii care argumentează că unul dintre mecanisme ar fi prin creșterea stresului oxidativ.
Intervenţia extinsă asupra acestor mecanisme în anumite situaţii clinice, cum ar fi insuficienţa cardiacă, este de natură să amelioreze rezultatele tratamentului fibrilaţiei atriale, așa cum au demonstrat recent rezultatele studiului RACE 3 (13).
Din punct de vedere clinic, fibrilaţia atrială este abordată în funcţie de patologia subiacentă, pornind de la aserţiunea că este mai puţin important ce aritmie are bolnavul decât ce bolnav are aritmia. Pe de altă parte însă, această abordare este departe de a include întreaga eterogenitate a acestei aritmii.
Cu toate că este clar că o abordare specifică a diverselor fenotipuri de fibrilaţie atrială ar putea ameliora decizia terapeutică, această atitudine nu este nici pe departe standardizată. În ce măsură ghidarea terapiei poate fi făcută pe baza anumitor fenotipuri specifice ale aritmiei este un lucru care urmează a fi studiat.
Corelarea fenotip-genotip poate fi în acest sens o abordare interesantă, știut fiind că anumite gene de tipul PITX2, KCNN3 sau ZFHX3 conferă o susceptibilitate particulară pentru fibrilaţia atrială. Un studiu interesant bazat pe genotiparea a 660 de pacienţi cu fibrilaţie atrială paroxistică și persistentă, trataţi prin ablaţie transcateter, demonstrează că doar gena ZFHX3 este asociată cu dilataţie atrială stângă și recurenţă după ablaţie (14).
O idee interesantă este aceea de a defini anumite profiluri clinice particulare (clustere) care să fie corelate cu prognosticul clinic. Analiza registrului ORBIT-AF, care a înrolat 10.137 de pacienţi cu fibrilaţie atrială între iunie 2010 și august 2011 în 176 de centre din SUA, a permis identificarea a patru profiluri clinice particulare: (1) pacienţi cu încărcătură scăzută de comorbidităţi; (2) pacienţi tineri, cu patologie comportamentală; (3) pacienţi cu dispozitive implantabile pentru tratamentul bradiaritmiilor; (4) pacienţi cu comorbidităţi aterosclerotice.
Interesant, clasificările convenţionale de felul tipului de fibrilaţie atrială (paroxistică, persistentă, permanentă) sau dimensiunea atriului nu generează clustere cu informaţii prognostice. În schimb, cele patru fenotipuri definite se asociază semnificativ cu riscul de evenimente clinice, subliniind eterogenitatea fibrilaţiei atriale și importanţa comorbidităţilor și a substratului pentru ameliorarea calităţii terapiei (15).
Toate aceste date confirmă încă o dată faptul că fibrilaţia atrială este mai degrabă un sindrom decât o boală și că evaluarea și tratamentul ei trebuie să însemne mult mai mult decât urmărirea unui pattern electrocardiografic, caracterizarea substratului având implicaţii majore în deciziile legate de pacient.
1. Kirchhof P et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016 Oct 7;37(38):2893-2962
2. Abildskov JA. Additions to the wavelet hypothesis of cardiac fibrillation. J Cardiovasc Electrophysiol. 1994 Jun;5(6):553-9
3. Boyden PA. Models of atrial reentry. J Cardiovasc Electrophysiol. 1995 Apr;6(4):313-24
4. Pandozi C, Santini M. Update on atrial remodelling owing to rate; does atrial fibrillation always ‚beget’ atrial fibrillation? Eur Heart J. 2001 Apr;22(7):541-53
5. Haïssaguerre M et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 1998 Sep 3;339(10):659-66
6. Farrell M et al. Non-pulmonary vein mediated atrial fibrillation: A novel sub-phenotype. PLoS One. 2017 Sep 7;12(9):e0184354
7. Wijffels MC et al. Atrial fibrillation begets atrial fibrillation. A study in awake chronically instrumented goats. Circulation. 1995 Oct 1;92(7):1954-68
8. Siebermair J et al. Assessment of Left Atrial Fibrosis by Late Gadolinium Enhancement Magnetic Resonance Imaging: Methodology and Clinical Implications. JACC Clin Electrophysiol. 2017 Aug;3(8):791-802
9. Zipes DP. The seventh annual Gordon K. Moe Lecture. Atrial fibrillation: from cell to bedside. J Cardiovasc Electrophysiol. 1997 Aug;8(8):927-38
10. Coumel P. Paroxysmal atrial fibrillation: a disorder of autonomic tone? Eur Heart J. 1994 Apr;15 Suppl A:9-16
11. Patterson E et al. Triggered firing in pulmonary veins initiated by in vitro autonomic nerve stimulation. Heart Rhythm. 2005 Jun;2(6):624-31
12. Bouzegrhane F, Thibault G. Is angiotensin II a proliferative factor of cardiac fibroblasts? Cardiovasc Res. 2002 Feb 1;53(2):304-12
13. Rienstra M et al. Targeted therapy of underlying conditions improves sinus rhythm maintenance in patients with persistent atrial fibrillation: results of the RACE 3 trial. Eur Heart J. 2018 Aug 21;39(32):2987-2996
14. Husser D et al. Association of atrial fibrillation susceptibility genes, atrial fibrillation phenotypes and response to catheter ablation: a gene-based analysis of GWAS data. J Transl Med. 2017 Apr 5;15(1):71
15. Inohara T et al. Association of of Atrial Fibrillation Clinical Phenotypes With Treatment Patterns and Outcomes: A Multicenter Registry Study. JAMA Cardiol. 2018 Jan 1;3(1):54-63
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe