Noţiunea de encefalopatie hepatică (EH) cuprinde un spectru larg de manifestări neurologice și psihiatrice reversibile
Acestea variază de la modificări cognitive ușoare la comă, în general întâlnite la pacienţi cu insuficienţă hepatică cronică și hipertensiune portală, dar și la pacienţi cu insuficienţă hepatică acută (1,2).
Prevalenţa EH în momentul stabilirii diagnosticului de ciroză hepatică este de 10-14%, la cei cu ciroză hepatică decompensată de 16-21%, iar la cei cu șunt transjugular intrahepatic portosistemic (TIPS) este cuprinsă între 10% și 50% (3-5). EH compensată la pacienţii cu ciroză hepatică este cuprinsă între 20% și 80%, conform ultimelor raportări (6,7). Riscul apariţiei EH în primii cinci ani de la diagnosticul cirozei este de 5-25%, în funcţie de prezenţa altor factori, cum ar fi: infecţii, hemoragie variceală, ascită, diabet sau hepatită virală C (8,9).  Riscul de recurenţă la un an este de 40%, iar la acești pacienţi riscul cumulat pentru un nou episod de EH în următoarele șase luni este de 40%, în ciuda tratamentului simptomatic (10).
Riscul de recurenţă la un an este de 40%, iar la acești pacienţi riscul cumulat pentru un nou episod de EH în următoarele șase luni este de 40%, în ciuda tratamentului simptomatic (10).
Natura reversibilă a encefalopatiei hepatice cu variabilitatea modificărilor cerebrale sugerează că la baza acestora se află un mecanism metabolic. Cu toate acestea, nicio tulburare metabolică unică nu poate explica encefalopatia hepatică. Procesele care stau la baza acestui fenomen sunt incapacitatea clearance-ului hepatic al produșilor de metabolizare din intestin, fie prin insuficienţă hepatocelulară, fie prin șuntare și alterarea metabolismului aminoacizilor, ambele procese având ca rezultat modificarea neurotransmisiei cerebrale (11). Mai multe toxine neuroactive, în special amoniacul și sistemele de neurotransmiţători, sunt implicate și interdependente. Ratele metabolice cerebrale reduse ale oxigenului și ale glucozei întâlnite în EH sunt puse pe baza scăderii activităţii neuronale (12).
Neurotoxina cu rol central implicată în EH este amoniacul, având ca sursă primordială colonul, unde flora anaerobă metabolizează proteinele și produșii cu conţinut crescut de nitrogen în amoniac. Enterocitele sintetizează amoniacul din glutamat. Odată produs, acesta pătrunde în circulaţia portală, unde, în condiţii optime, este metabolizat și eliminat de hepatocite. La cirotici și în condiţii de hipertensiune portală, funcţia hepatocitară scăzută și șunturile portosistemice contribuie la creșterea nivelului de amoniac din circulaţie. Hiperamoniemia din sângele arterial poate fi observată la 90% dintre pacienţii cu EH, deși nivelurile serice ale amoniacului nu sunt nici specifice, nici sensibile pentru stabilirea diagnosticului de EH. Creșterea permeabilităţii barierei hemato-encefalice are ca rezultat acumularea unor cantităţi de amoniac la nivelul ganglionilor bazali și cerebelului. Hiperamoniemia acută are ca rezultat apariţia edemului cerebral, afectarea funcţiei astrocitelor și transportului componentelor neuronale active cum este mioinozitolul, contribuind astfel la EH (13,14). Alte alterări implicate în patogeneza EH descrise sunt: afectarea fluidităţii membranei neuronale, modificarea expresiei neurotransmiţătorilor sistemului nervos central (SNC) și afectarea expresiei și activării receptorilor neurotransmiţătorilor. Cel mai bine studiat este sistemul acid -aminobutiric (GABA)-benzodiazepine. Se pare că amoniacul se leagă de receptorul benzodiazepinic de la nivel astrocitar și determină producerea de neurosteroizi care activează la rândul lor sistemul GABA-benzodiazepine. Alţi factori care influenţează neurotransmisia la nivelul SNC sunt: serotonina, oxidul nitric, peptidele opioide circulante, monoaminele, creșterea producerii de radicali liberi de oxigen (15).
EH cuprinde o gamă largă de manifestări neurologice și psihiatrice. În formele compensate apar modificări de atenţie, afectări ușoare ale memoriei, ale vitezei psihomotorii și abilităţii vizuospaţiale. Odată cu progresia EH, apar și modificările de personalitate: apatie, iritabilitate și dezinhibiţie, alterarea stării de conștienţă și afectarea funcţiilor motorii. Alterarea ciclului somn-veghe cu somnolenţă diurnă este frecvent întâlnită. Pot apărea, de asemenea, dezorientare temporo-spaţială, comportament inadecvat, status confuzional acut cu agitaţie sau somnolenţă, stupor și, în final, comă (16).
La pacienţii cu EH apar anomalii motorii ca hipertonie, hiperreflexie, semn Babinski pozitiv, iar în stadiul comatos, reflexele se diminuează sau dispar. Deficitele focale neurologice tranzitorii și crizele sunt rar raportate ca manifestări ale EH. Disfuncţii extrapiramidale ca hipomimie, rigiditate musculară, tremor, bradikinezie, hipokinezie, diskinezie cu diminuarea mișcărilor voluntare sunt manifestări frecvente, spre deosebire de ticuri sau coree, care apar rar. Asterixisul sau flapping tremor este o manifestare frecventă la pacienţii cu EH în stadiile care preced stuporul și coma și reprezintă o mioclonie negativă care constă în pierderea tonusului postural. Este ușor declanșat de acţiuni care necesită tonus postural, cum este hiperextensia articulaţiei mâinii cu depărtarea degetelor. Poate fi observat și la nivelul altor segmente: picior, gambă, braţ, limbă sau pleoapă. Asterixisul nu este o manifestare patognomonică a EH, putând fi observat și în alte afecţiuni (17,18).
Mielopatia hepatică este o manifestare atipică în EH, probabil legată de șuntul portocav îndelungat, caracterizată prin anomalii severe motorii. Literatura descrie cazuri de paraplegie cu spasticitate progresivă, scăderea forţei la nivelul membrelor inferioare cu hiperreflexie și alterarea ușoară persistentă sau recurentă a statusului mental, fără răspuns la tratamentul standard, dar reversibilă după transplantul hepatic (19).
Fiind vorba despre un sindrom heterogen, există mai multe clasificări, în funcţie de substrat, severitatea manifestărilor, modul de evoluţie și prezenţa factorilor precipitanţi (1).
În funcţie de substrat: tip A, în insuficienţa hepatică acută; tip B, în șunturi sau bypassuri portosistemice; tip C, în ciroza hepatică. Manifestările clinice ale ultimelor două sunt similare, în timp ce tipul A se poate asocia cu creșterea presiunii intracraniene și risc de herniere cerebrală.
În funcţie de severitatea manifestărilor clinice: au fost descrise patru grade ale EH, detaliate în tabelul 1.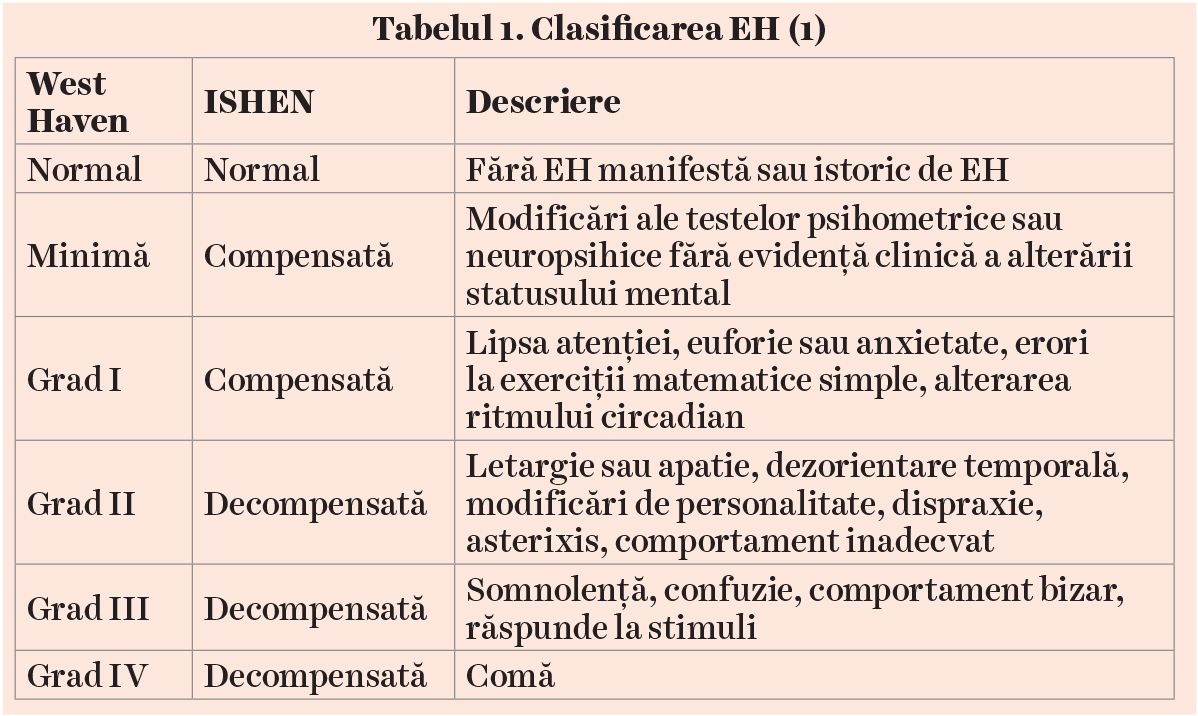
În funcţie de modul de evoluţie: EH episodică – apariţia unor episoade la un interval mai mare de 6 luni; EH recurentă – apariţia episoadelor la un interval mai scurt de 6 luni; EH persistentă – alterări comportamentale permanente, cu apariţia unor episoade de decompensare.
În funcţie de prezenţa factorilor precipitanţi: EH neprecipitată; EH precipitată – factorii precipitanţi trebuie menţionaţi și trataţi specific.
Diagnosticul EH compensate este dificil deoarece în acest stadiu pacientul nu prezintă dezorientare sau asterixis. Pacienţii cu EH grad 1 (conform criteriilor West Haven) pot prezenta modificări cognitive observate mai ales de membrii familiei. Acești pacienţi prezintă modificări la testele psihometrice, în special moficări ale atenţiei, ale funcţiilor de execuţie, coordonării vizuo-spaţială și ale reacţiilor psihomotorii. Metodele de diagnostic includ testarea hârtie-creion, teste computerizate și teste neurofiziologice. Alegerea tipului de testare se face în funcţie de disponibilitatea locală și de costuri (20).
Testarea hârtie-creion constă într-un set de cinci teste hârtie-creion care evaluează procesele cognitive și psihomotorii și coordonarea vizuo-motorie. Se mai numește și Scor Psihometric Hepatic de Encefalopatie și reprezintă gold-standardul, având o sensibilitate de 96% și o specificitate de 100% (20).
Testele computerizate – testul de control inhibitor (TIC) evaluează inhibarea, atenţia, vigilenţa și memoria de lucru. EH este diagnosticată atunci când pacienţii au timpi de reacţie mai lungi, rată mai mică a răspunsurilor-ţintă și o rată mai mare a răspunsurilor vagi, cu o sensibilitate și specificitate de 87% și, respectiv, 77%. TIC este ușor de administrat, gratuit și validat, dar necesită pacienţi cu funcţionalitate ridicată. Bateria de teste cognitive este o altă metodă utilizată pentru a diagnostica EH, având o validitate bună, fiind ușor de folosit și necostisitoare. Aplicaţia de mobil EncephalApp Stroop este un instrument care testează viteza psihomotorie și vigilenţa cognitivă prin măsurarea timpului pentru a identifica corect o serie de simboluri de culori diferite („off-time”) și cuvinte de culori diferite („on-time”). O întrerupere de peste 190 de secunde a identificat EH cu acurateţe excelentă. Aplicaţia este gratuită, ușor de utilizat, accesibilă și poate fi ideală pentru centrele care nu au acces la teste formale (20).
Teste neurofiziologice – Electroencefalografia (EEG) este un test care poate fi utilizat pentru evidenţierea tulburărilor neuropsihiatrice în ciroză. Sensibilitatea pentru diagnosticarea EH variază de la 43% la 100%. EEG prezintă variabilitate inter- și intraobservatorie și necesită tehnician pentru efectuare și neurolog pentru interpretare, ceea ce o face o resursă costisitoare. Testarea frecvenţei prin click măsoară funcţia corticală și se corelează bine cu testele psihometrice. Testul poate fi influenţat de medicaţie, vârstă și echipamentul utilizat. Cu toate acestea, este o metodă simplă, validă și eficientă pentru diagnosticarea EH compensată. Potenţialele evocate vizuale, auditorii și somato-senzitive au mai fost utilizate, dar prezintă variabilitate semnificativă, cu rezultate inconstante (20). Aceste teste au o valoare predictivă negativă bună, prin urmare, pacienţii care prezintă rezultate în limite normale pot fi testaţi din nou în șase luni (21).
Pacienţii cu EH decompensată prezintă deficite neurologice globale. În stadiile 2 și 3 (conform criteriilor West Haven), anomaliile motorii sunt manifeste clinic și includ: hiperreflexie, hipertonie, asterixis, bradikinezie, rigiditate, tremor și ataxie. De asemenea, apar modificări de comportament sau modificări cognitive: agresivitate, agitaţie, dezorientare temporo-spaţială, modificări de personalitate, comportament bizar, letargie sau apatie. În stadiul 4, pacientul este comatos, cu reflexe diminuate sau abolite, cu prezenţa semnelor de tract piramidal, fără asterixis (vezi tabelul 1) (21).
EH decompensată se asociază de obicei cu un factor precipitant: sângerări gastrointestinale, insuficienţă renală acută, infecţii, constipaţie, dezechilibre electrolitice și alte afectări hepatice (hepatită alcoolică, tromboză de venă portă, hepatocarcinom). Necesită diagnostic diferenţial cu alte afecţiuni neurologice, cum ar fi accidente cerebrovasculare acute (AVC), afecţiuni legate de consumul de alcool și alte forme de encefalopatie metabolică (22).
În practica clinică nu există teste de laborator care să stabilească diagnosticul de EH decompensată, ci mai degrabă teste care să evidenţieze factorul precipitant sau o altă cauză de afectare a statusului mental. Deși nivelul crescut al amoniemiei sangvine în EH a fost descris în numeroase studii, în clinică nu este folosit ca test diagnostic, deoarece poate fi influenţat de o serie de factori, cum ar fi: utilizarea unui garou, strângerea pumnului și depozitarea necorespunzătoare a probei înainte de a fi trimisă în laborator. Imagistica cerebrală (CT sau IRM) poate fi utilizată și pentru a exclude alte patologii (23).
Managementul pacienţilor cu EH compensată se face de regulă în ambulator, utilizând dizaharide nonabsorbabile, antibiotice (ex: rifaximină) sau alţi agenţi cu scopul de a preveni EH decompensată, de a crește calitatea vieţii și de a scădea mortalitatea. În funcţie de severitate, EH decompensată poate fi tratată fie în ambulator, fie în spital, cu scopul de a diagnostica și trata factorii precipitanţi și de a ameliora statusul mental (1,21). Identificarea factorilor precipitanţi care predispun în peste 90% din cazuri la apariţia EH și tratamentul acestora se soldează cu remiterea episodului actual de EH în cea mai mare parte a cazurilor (vezi tabelul 2) (23).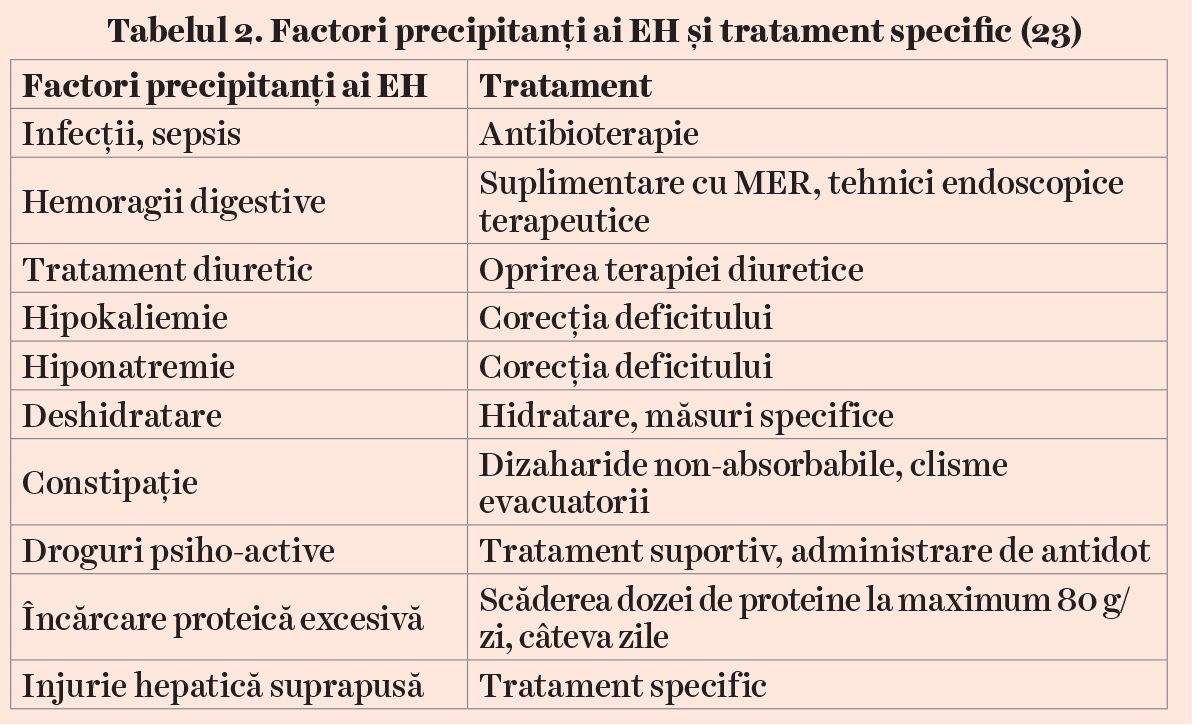
Medicaţia utilizată în mod curent în tratamentul EH
Dizaharidele nonabsorbabile cum sunt lactuloza și lactilolul sunt degradate de microbiota colonică și creează în lumenul colonic un mediu acid, cu un gradient osmotic crescut. Mediul acid reduce bacteriile producătoare de amoniac de la nivel intestinal și, în același timp, transformă amoniacul de la acest nivel în amoniac nonabsorbabil. Gradientul osmotic crescut duce la eliminarea nitrogenului în exces din fecale prin efectul său laxativ. Lactuloza se administrează ca sirop, cu reglarea dozelor astfel încât pacientul să aibă 2-4 scaune moi pe zi. La pacienţii la care nu poate fi administrată oral, se recomandă administrare intrarectală, 300 ml diluată în 700 ml de soluţie salină. Efectele adverse includ flatulenţă, disconfort abdominal și diaree. Lactilolul este o pudră cristalină mai bine tolerată și la fel de eficientă precum lactuloza (24).
Antibioticele sunt utilizate în EH pentru a împiedica producţia și absorbţia neurotoxinelor produse la nivel intestinal și reducerea endotoxinemiei și a inflamaţiei. Antibioticele studiate în EH sunt: neomicină, metronidazol, vancomicină, paromomicină și rifaximină. Dintre acestea, rifaximina s-a dovedit a fi cea mai eficientă, având cel mai bun profil de siguranţă.
Rifaximina este un antibiotic oral nonabsorbabil, cu un spectru larg al activităţii atât asupra bacteriilor gram pozitive și negative, cât și a celor enterice anaerobe. Acţionează prin legarea de ARN polimeraza ADN dependentă a bacteriilor și întrerupe sinteza ARN bacterian. Doza recomandată este de 1.200 mg/zi, în administrare discontinuă, șapte zile pe lună, atât pentru episodul acut, cât și pentru profilaxia secundară. Efectele adverse cele mai frecvente constau în flatulenţă, durere abdominală, cefalee și constipaţie (23).
Medicaţia alternativă
Probioticele sunt suplimente care conţin microorganisme vii ce influenţează balanţa intestinală a microflorei organismului. Mecanismul de acţiune constă în deprivarea substratului bacterian cu potenţial patogen de la nivel colonic, cu reechilibrarea balanţei bacteriene.
Din păcate, încă nu există date suficiente în literatură care să susţină o superioritate a tratamentului probiotic faţă de lactuloză și nici probiotice standardizate în tratamentul EH (23).
L-ornitină-L-aspartat scade nivelul amoniemiei sangvine prin stimularea ciclului ureei și a sintezei de glutamină. Fenilacetat ornitina și fenilbutirat glicerolul scad de asemenea nivelul amoniacului din sânge, dar necesită evaluări ulterioare în practica clinică (23).
Suplimentele de zinc: nivelurile scăzute de zinc au ca rezultat scăderea enzimelor implicate în ciclul ureei, ducând la niveluri crescute ale amoniemiei. Suplimentele de zinc au valoare limitată în practica clinică, dar pot fi administrate la pacienţii cu deficit de zinc, rezistenţi la terapia uzuală a EH (23).
Infuzia cu albumină și dializa cu albumină au fost utilizate în tratamentul EH decompensate. Deși nu au avut efect asupra rezoluţiei episodului, se pare că se asociază cu o supravieţuire mai mare (23).
Alţi agenţi studiaţi, precum benzoatul de sodiu, L-carnitina, acarboza, antagoniștii de receptor benzodiazepinic, nu și-au dovedit eficienţa în tratamentul EH (21).
Dieta
Pacienţii cu ciroză trebuie să consume 1,2 g/kg până la 1,5 g/kg de proteine zilnic pentru a-și menţine masa musculară. În plus, creșterea consumului de aminoacizi cu catenă ramificată (BCAA) poate fi benefică pentru EH, dar nu a arătat niciun beneficiu în privinţa mortalităţii sau a calităţii vieţii (25). Există cazuri rare în care un pacient va avea episoade recurente de EH decompensată, în ciuda managementului medical optim și a complianţei la tratament.
În aceste situaţii trebuie să căutăm alte posibile motive, cum ar fi șunturi spontane portosistemice. La acei pacienţi la care EH nu se îmbunătăţește în ciuda terapiilor medicale agresive, transplantul de ficat este tratamentul definitiv (26).
Encefalopatia hepatică este o complicaţie importantă a cirozei hepatice asociată cu morbiditate și mortalitate. De asemenea, este asociată cu o utilizare considerabilă a serviciilor de îngrijiri medicale. Recunoașterea din timp a EH este esenţială pentru gestionarea în timp util. Tratamentul EH se învârte în jurul gravităţii sale și include lactuloza și rifaximina, fie singure, fie în combinaţie. Investigarea este în curs de desfășurare privind opţiunile pentru tratarea EH refractară la tratament, incluzând embolizarea șuntului splenorenal spontan, fenil-butirat glicerol și suportul artificial hepatic.
1. Vilstrup H et al. Hepatic encephalopathy in chronic liver disease: 2014 practice guideline by the European Association for the Study of the Liver and the American Association for the Study of Liver Diseases. J Hepatol. 2014 Sep;61(3):642-59. doi: 10.1016/j.jhep.2014.05.042
2. Suraweera D, Sundaram V, Saab S.Evaluation and Management of Hepatic Encephalopathy: Current Status and Future Directions.Gut Liver. 2016 Jul 15;10(4):509-19. doi: 10.5009/gnl15419
3. Saunders JB, Walters JRF, Davies P, Paton A. A 20-year prospective study ofcirrhosis. BMJ 1981;282:263-66
4. D’Amico G, Morabito A, Pagliaro L, Marubini E. Survival and prognosticindicators in compensated and decompensated cirrhosis. Dig Dis Sci1986;31:468-75
5. Nolte W, Wiltfang J, Schindler C, Münke H, Unterberg K, Zumhasch U, et al.Portosystemic hepatic encephalopathy after transjugular intrahepaticportosystemic shunt in patients with cirrhosis: clinical, laboratory, psychometric,and electroencephalographic investigations. Hepatology1998;28:1215-25
6. Groeneweg M, Moerland W, Quero JC, Krabbe PF, Schalm SW. Screening ofsubclinical hepatic encephalopathy. J Hepatol 2000;32:748-53
7. Sharma P, Sharma BC, Puri V, Sarin SK. Critical flicker frequency: diagnostictool for minimal hepatic encephalopathy. J Hepatol 2007;47:67-73
8. Hartmann IJ et al. The prognostic significance of subclinical hepatic encephalopathy. AmJ Gastroenterol 2000;95:2029-34
9. Watson H, Jepsen P, Wong F, Gines P, Cordoba J, Vilstrup H. Satavaptantreatment for ascites in patients with cirrhosis: a meta-analysis of effect onhepatic encephalopathy development. Metab Brain Dis 2013;28:301-5
10.Sharma BC, Sharma P, Agrawal A, Sarin SK. Secondary prophylaxis ofhepatic encephalopathy: an open-label randomized controlled trial oflactulose vs. placebo. Gastroenterology 2009;137:885-91, [891.e1]
11. Hazell AS, Butterworth RF. Hepatic encephalopathy: anupdate of pathophysiologic mechanisms. Proc. Soc. Exp.Biol. Med. 1999; 222: 99
12. Jones EA, Weissenborn K. Neurology and the liver. J. Neurol.Neurosurg. Psychiatr. 1997; 63: 279
13. Szerb JC, Butterworth RF. Effect of ammonium ions onsynaptic transmission in the mammalian central nervoussystem. Prog. Neurobiol. 1992; 39: 135
14. Yamada’s Textbook of Gastroenterology, 6th ed. Podolski D, Camilleri M, Fitz G, Kallo A, Shanahan F, Wang T. Wiley-Blackwell; 2015
15. Diseases of the Liver and Biliary System, 11th ed. Sherlock S, Dooley J. Blackwell Science; 2002
16. Weissenborn K. Diagnosis of encephalopathy. Digestion 1998;59:22-4
17. Weissenborn K, Bokemeyer M, Krause J, Ennen J, Ahl B. Neurological and neuropsychiatric syndromes associated with liver disease. AIDS 2005;19:S93-8
18. Adams RD, Foley JM. The neurological disorder associated with liverdisease. Res Publ Assoc Res Nerv Ment Dis 1953;32:198-237
19. Read AE, Sherlock S, Laidlaw J, Walker JG. The neuro-psychiatric syndromesassociated with chronic liver disease and an extensive portal-systemiccollateral circulation. Q J Med 1967;141:135-50
20. Irimia R, Stanciu C, Cojocariu C, Sfarti C, Trifan A.Oral glutamine challenge improves the performance of psychometric tests for the diagnosis of minimal hepatic encephalopathy in patients with liver cirrhosis. J Gastrointestin Liver Dis. 2013 Sep;22(3):277-81
21. Patidar KR, Bajaj JS.Covert and Overt Hepatic Encephalopathy: Diagnosis and Management.Clin Gastroenterol Hepatol. 2015 Nov;13(12):2048-61. doi: 10.1016/j.cgh.2015.06.039
22. Gheorghe L et al. Natural history of compensated viral B and D cirrhosis.Rom J Gastroenterol. 2005 Dec;14(4):329-35
23. Trifan A, Gheorghe C, Dumitrașcu D, Diculescu M, Gheorghe L, Sporea I. Gastroenterologie și hepatologie clinica, 1st ed. Ed. Medicală, 2018:
676-91
24. Gerber T, Schomerus H. Hepatic encephalopathy in liver cirrhosis: pathogenesis, diagnosis and management. Drugs. 2000; 60:1353-70
25. Gheorghe L1, Iacob R, Vădan R, Iacob S, Gheorghe C.Improvement of hepatic encephalopathy using a modified high-calorie high-protein diet. Rom J Gastroenterol. 2005 Sep;14(3):231-8
26. Iacob S, Gheorghe L, Iacob R, Gheorghe C, Hrehoreţ D, Popescu I.MELD exceptions and new predictive score of death on long waiting lists for liver transplantation.Chirurgia (Bucur). 2009 May-Jun;104(3):267-73
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe