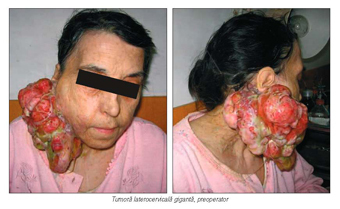
Chirurgia oncologică din sfera ORL are ca
scop îndepărtarea tumorii maligne primare, a tuturor ganglionilor limfatici
sateliţi şi a ţesuturilor non-vitale asociate acestora: muşchi, nervi şi vase
sanguine. Extirparea situsurilor de multiplicare tratează astfel cancerul,
asociindu-se strategiilor complexe ce includ radioterapia şi chimioterapia
indicate de tipul histologic. Ştiind că lanţurile ganglionare acţionează ca staţii
de diseminare limfatică, se acceptă astfel „preţul scump“ al rezecţiei extinse,
care poate determina secundar afectarea sensibilităţii şi mişcării în
teritoriile prinse de masa tumorală.
Chirurgia oncologică a capului şi gâtului
cuprinde: laringectomia (totală sau parţială), glosectomia, faringectomia,
parotidectomia, hemimandibulectomia şi disecţia radicală. Transplantul
musculo-cutanat reconstructiv devine necesar ca parte a rezecţiilor întinse.
Necesitatea de a creşte controlul oncologic asupra bolii şi a reduce
morbiditatea perioperatorie a dus la „modificarea“ tehnicilor de disecţie
clasică. O astfel de „abatere“ poate fi considerată prezervarea uneia sau a mai
multor structuri non-limfatice (ex.: nervul spinal accesor, vena jugulară
internă sau muşchiul sternocleidomastoidian).
Standardizarea tehnicilor de rezecţie şi a
terminologiei se datorează Academiei Americane de ORL şi Chirurgie a Capului şi
Gâtului (American Academy of Otolaryngology – Head and Neck Surgery).
Cel mai important factor prognostic la
pacienţii cu afecţiuni tumorale cervicale s-a dovedit a fi statusul morfologic
al ganglionilor regionali. Acesta stă la baza clasificării TNM propuse de
American Joint Commitee on Cancer (AJCC).
Nx – nodulii cervicali nu se pot evalua
N0 – fără noduli cervicali metastatici
N1 – metastază ganglionară unică (cel mult 3
cm diametru)
N2a – metastază unică (mai mare de 3 cm dar până
la 6 cm în diametru)
N2b – noduli metastatici multipli ipsilateral
(niciunul mai mare de 6 cm în diametru)
N2c – noduli multipli metastatici bilaterali
sau contralaterali (niciunul mai mare de 6 cm în diametru)
N3 – adenopatie masivă (mai mare de 6 cm în
diametru)
Standardizarea se realizează utilizând
evaluarea clinică în combinaţie cu imagistica performantă (examen CT, IRM,
ecografie, Doppler carotidian, angiografie cerebrală) şi cu citologia de aspiraţie
ecoghidată. O menţiune specială merită tomografia cu emisie de pozitroni (PET),
care furnizează informaţii despre activitatea metabolică a ţesuturilor prin
fixarea diferenţiată a unui trasor anume (ex: carcinomul cu celule scuamoase
captează selectiv fluoro-2-dezoxi-D-glucoza).
Ca urmare a extensiei şi a plasării în zone
cu risc vital a tumorilor, chirurgia oncologică din ORL practică rezecţii
dificile, laborioase, „de mare virtuozitate“ tehnică. A apărut astfel
necesitatea unei anestezii de fineţe, ce include intubaţia oro-traheală dificilă
sau imposibilă la inducţie, profunzime în menţinere şi o trezire prudentă, cu
securizarea căii aeriene.
Evaluarea preoperatorie
Pacientul tipic pentru chirurgia oncologică
a capului şi gâtului este vârstnic, consumator cronic de etanol şi/sau fumător.
Patologia asociată cel mai frecvent şi care necesită evaluare şi optimizare
preoperatorie cuprinde: bronhopneumopatia cronică obstructivă, emfizemul
pulmonar, boala coronariană ischemică, hepatopatia cronică, coagulopatiile
asociate acesteia, malnutriţia, anemia, deshidratarea şi tulburările
electrolitice.
Calea aeriană dificilă se datorează nu atât
malformaţiilor (deşi se pot asocia uneori), cât tumorii în sine, care poate
ocupa parţial lumenul sau determină uneori compresie extrinsecă prin volum.
Radioterapiei preoperatorii, menite să reducă dimensiunile cancerului, i se
datorează fibroza extinsă şi fragilitatea vasculară a zonei. Libertatea căii
aeriene se evaluează clinic pe baza prezenţei disfoniei, a stridorului
inspirator, a dispneei, a sibilantelor, a wheezingului, a gradului limitat de
mişcare a gâtului şi de deschidere a gurii, precum şi prin vizualizarea directă
a tumorii în gură, pe limbă sau în gât.
Informaţiile se coroborează cu cele obţinute
de specialistul orelist prin examinarea specifică, asociată uneori cu
fibroscopia, iar decizia de traheostomie de elecţie, sub anestezie locală, se
ia de comun acord. Excesul de prudenţă se motivează prin toleranţa scăzută la
hipoxie a acestor pacienţi, asociată cu probabilitatea mare de dislocare a unor
fragmente tumorale în cursul manevrei de intubare, cu sângerare consecutivă şi
aspiraţie pulmonară secundară. Managementul căii aeriene a evoluat spectaculos în
ultimele decenii, atingând o extensie ce depăşeşte cu mult cadrul acestei lucrări.
Evaluarea paraclinică de rutină include:
hemoleucograma cu formula completă, glicemia, ionograma, ureea, creatinina,
proteinograma, radiografia pulmonară, electrocardiograma (ECG). Pentru pacienţii
cu hepatopatie cronică se adaugă: enzime de citoliză hepatică (ALAT, ASAT,
gamma-GT), LDH, fosfataza alcalină, bilirubina totală (directă şi indirectă) şi
markerii virali. Pacienţii pulmonari se explorează suplimentar prin
spirometrie, gazometrie sanguină, eventual CT pulmonar. În foaia de observaţie
se consemnează preoperator grupul sanguin şi Rh-ul pacientului, pentru că
necesitatea de transfuzie poate apărea în orice moment. În funcţie de contextul
clinic, specialistul ATI poate indica extinderea explorărilor paraclinice şi a
examenelor cerute altor specialităţi medicale (ex.: patologia cardiacă
decompensată; patologia osoasă severă ce modifică în plus planurile cervicale).
Premedicaţia
Premedicaţia cuprinde, alături de anxiolitic
(midazolam), obligatoriu un antisecretor parasimpatolitic de tip atropină sau
glicopirolat. Protectorul gastric (inhibitor de pompă de protoni sau antagonist
de receptori H2) se administrează având în vedere intervenţiile lungi, potenţial
şocogene, pentru a preveni reacţia digestivă la stresul operator.
Managementul intraoperator
Dat fiind riscul mereu prezent al sângerării
masive şi prevalenţa afecţiunilor cardiopulmonare preexistente, este necesară
instalarea unui cateter arterial pentru monitorizarea invazivă a tensiunii
arteriale, a gazelor sanguine şi a hematocritului.
Accesul venos periferic se obţine cu cel puţin
două linii cu diametru mare. Cateterizarea venoasă centrală va permite repleţia
volemică în timp real şi va asigura o cale separată pentru suportul vasopresor şi/sau
inotrop, la nevoie.
Se preferă inserţia femurală a accesului,
facil la injectare şi la distanţă de câmpul operator (uneori intervenţiile
presupun şi timpi septici). Rareori, poate fi necesară cateterizarea arterei
pulmonare prin cateter Swan-Ganz.
Se montează cateter urinar pentru măsurarea
diurezei.
Preoperator, se montează dispozitivele
standard de monitorizare neinvazivă şi continuă a TA, AV, SpO2 şi a
temperaturii. Vasoconstricţia indusă de hipotermie şi hipotensiunea severă pot
compromite microvascularizaţia lamboului de reconstrucţie, devitalizându-l.
Ideal, gazele inspirate vor fi încălzite şi umidificate, iar suprafaţa corpului
va fi atent acoperită.
Traheostomia electivă
Traheostomia electivă face parte din actul
chirurgical propriu-zis. Se efectuează la pacientul treaz, cu intubaţie
apreciată ca fiind dificilă sau imposibilă, sub anestezie locală (xilină 1%),
preoxigenat. Eliberarea de catecolamine se poate preveni prin administrarea
unui betablocant înalt selectiv (esmolol sau labetalol) în doză mică.
După cuplarea
pacientului la circuitul anestezic cu ajutorul sondei de intubaţie special
conformate (în formă de „J“), se verifică poziţia acesteia prin caprografie
(prezenţa curbei de ETCO2) şi
prin auscultaţia simetrică a zgomotelor pulmonare.
Traheostomia se
poate efectua şi la finalul intervenţiei, la pacientul sub anestezie generală,
iniţial intubat orotraheal, ca ultim pas al chirurgiei.
Stoma traheală
poate fi definitivă, certificând absenţa totală a laringelui secundară disecţiei,
sau temporară, protejând calea aeriană de o eventuală sângerare sau de edemul
postchirurgical.
Intraoperator,
vaporizorul se închide, pacientul se ventilează cu FiO2 = 1 pentru scurt
timp, iar sonda de intubaţie se extrage cefalic. Circuitul anestezic se
recuplează la canula de traheostomă (cu balonaş) instalată de chirurg.
Pentru primele
24 de ore postoperator, în locul canulei, prin stoma traheală se poate insera o
noua sondă IOT, cu diametru superior primei, fixată sub control vizual de
echipa chirurgicală. La primul pansament se va schimba cu canula corespunzătoare.
O creştere bruscă
a presiunilor de asistare sau o desaturare importantă, imediat după montarea
acesteia, pot indica: bronhospasm sever, poziţionare incorectă sau colmatare cu
sânge şi/sau resturi tisulare a stomei recente.
Pentru chirurgia
oncologică din ORL, de elecţie este anestezia generală balansată cu intubaţia
orotraheală, pe pivot inhalator.
Componentele
fundamentale ale anesteziei generale – hipnoza, analgezia şi relaxarea
neuromusculară – se realizează prin participarea echilibrată a agenţilor
intravenoşi, a volatilelor şi a relaxantelor musculare.
Profunzimea
anesteziei se poate modifica pe parcursul intervenţiei chirurgicale, astfel încât
să se obţină protecţie maximă la nocicepţie, stabilitate hemodinamică fără
modificări de ritm cardiac şi trezire în condiţii de maximă siguranţă.
Administrarea
succesivă de substanţe diferite ca structură şi farmacocinetică îi conferă
anesteziei balansate complexitate, dar creşte riscul de apariţie atât a reacţiilor
adverse, cât şi a „trezirii intraanestezice“. Funcţiile renală şi hepatică ale
pacientului influenţează decisiv eliminarea anestezicelor intravenoase,
stabilind variaţiile individuale pentru timpul de acţiune.
Folosirea
relaxantelor neuromusculare impune antagonizarea acestora la sfârşitul intervenţiei
(în funcţie de tipul de curarizare).
Chirurgia
oncologică cervicală solicită o anestezie specială, bipolară, cu analgezie
profundă şi hipnoză, dar adesea fără relaxare musculară. Se permite astfel
identificarea, prin stimulare în timpul disecţiei, a unor structuri nervoase de
tip spinal (n. accesor, n. facial) şi evaluarea funcţiei acestora la finalul
intervenţiei. Tehnica permite pacienţilor reluarea respiraţiei spontane rapid,
la trezire, fără disconfort sau risc de reacţii adverse decurarizării (ex.:
disritmii grave, bronhospasm, convulsii, depresie respiratorie la neostigmină).
Agenţii
anestezici administraţi inhalator conferă mai multe avantaje pentru aceste
intervenţii oncologice: scad bronhoconstricţia acţionând direct pe muşchiul
neted bronşic, produc un nivel stabil de relaxare musculară fără folosirea
curarizantelor şi determină un grad variabil de hipotensiune arterială. Prin
eliminarea rapidă, prin plămâni, permit revenirea promptă, la finalul
chirurgiei, a reflexelor de protecţie a căilor aeriene.
Sevofluranul pare a fi cel mai utilizat
dintre volatile, în acest scop. Formula chimică conţine un analog fluorinat al
izofluranului. Solubilitatea scăzută în lipide determină trezirea rapidă.
Proprietăţile bronhodilatatoare, vasodilatatoare sistemice, minima depresie
miocardică, lipsa efectului iritant respirator îl recomandă ca „agent de
croazieră“ în anestezia generală, în parteneriat cu un opioid major (fentanyl,
sufentanyl, remifentanyl).
Inducţia anesteziei intravenoase
Inducţia anesteziei intravenoase se
realizează, de obicei, prin hipnoza indusă de: barbiturice, etomidat, propofol şi
ketamină. După administrarea intravenoasă, efectul acestora se instalează
rapid, în funcţie de timpul specific de circulaţie braţ-creier. La atingerea
concentraţiei cerebrale critice, somnul anestezic înlocuieşte starea de veghe.
Pentru menţinere, pacientul este „preluat“ de combinaţia volatil plus opioid.
Barbituricele
sunt compuşi alcalini al căror nucleu central rezultă prin fuziunea dintre uree
şi acid malonic. Cuprind două subgrupe: tiobarbiturice (tiopental, pentobarbital)
şi oxibarbiturice (methohexital). Produc inconştienţă la trei minute de la
injectarea i.v., iar trezirea are loc în zece minute de la doza iniţială. Sunt
deprimante respiratorii, inotrop negative, produc hipotensiune în hipovolemia
severă, prin eliberare de histamină. La pacienţii cu cale aeriană compromisă se
administrează cu precauţie pentru că nu protejează împotriva laringospasmului şi
bronhospasmului.
Etomidatul
este un compus imidazolic, structural înrudit cu antifungicele de tip
ketoconazol. Se utilizează la pacienţii instabili hemodinamic sau cu performanţă
cardiacă scăzută, dat fiind impactul minim asupra funcţiei cardiovasculare.
Produce supresia sintezei de cortizol, nu eliberează histamină, alegându-se
pentru pacienţii polialergici. Miocloniile care apar uneori la inducţia cu
etomidat se combat cu benzodiazepină şi/sau opioid.
Propofolul
este un fenol substituit, cu debut rapid şi durată scurtă de acţiune. Trezirea
după o doză administrată i.v. este promptă, fără sedare reziduală. La vârstnici
şi la hipovolemici determină hipotensiune arterială marcată, prin vasodilataţie
periferică. Este inotrop şi cronotrop negativ. Deprimă marcat respiraţia.
Suprimarea completă a răspunsului presor la intubaţie şi a reflexelor
laringiene (tuse, laringospasm) îl recomandă de elecţie pentru inserţia şi menţinerea
măştii laringiene.
Ketamina
are structură şi funcţie similare halucinogenului fenciclidină. Modul său de acţiune
în producerea anesteziei se dovedeşte unic. Întrerupe percepţia corticală a durerii
prin blocarea receptorilor NMDA. După doza de inducţie, pacientul pare conştient,
dar nu reacţionează la stimuli dureroşi şi nici nu are memoria acestora.
Descrierea corespunde „efectului disociativ“ al ketaminei. Chiar în doze mici,
subanestezice (0,5–1 ml/kgc), produce analgezie intensă, amnezie retrogradă şi
anterogradă şi susţine tensiunea arterială prin eliberare de catecolamine
endogene.
Combinaţia ketamină plus propofol şi-a câştigat
locul în tehnica TIVA (anestezia totală intravenoasă), oferind stabilitate
hemodinamică şi efecte secundare minime la trezire. Ketamina nu deprimă respiraţia,
dar creşte producţia de secreţii orale şi incidenţa laringospasmului. Cu precauţie,
se poate folosi ca supliment i.v. pentru anestezia locală, la traheostomia de
elecţie pe pacientul treaz.
Opiozii şi antagoniştii lor
Agoniştii narcoticelor oferă analgezia de
bază în tehnicile cu suport intravenos. Acţiunea lor se datorează legării
stereospecifice de receptorii opioizi din creier şi măduva spinării. Analgezia
obţinută, de bună calitate, are ca preţ cunoscutele reacţii adverse: mioză,
depresie respiratorie, constipaţie, retenţie urinară şi, uneori, prurit.
Morfina,
cap de serie, e un compus natural, derivat de opiu, folosit de secole ca
narcotic şi antidiareic. Aproape insolubilă în lipide, este inactivată în cea
mai mare parte la primul pasaj hepatic. Se administrează i.m., i.v., epidural şi
intratecal. Ieftină, cu durată de acţiune acceptabilă (patru-şase ore), în doze
mici poate fi folosită pentru premedicaţie şi controlul postoperator al
durerii. Chiar în aceste condiţii, poate produce apnee la vârstnici sau la
pacienţii taraţi. Eliberarea de histamină produce hipotensiune severă la
hipovolemici.
Folosirea opioizilor sintetici, potenţi, cum
sunt: fentanyl, alfa-fentanyl, sufentanyl
şi remifentanyl, este limitată la
sala de operaţie unde este disponibil echipamentul de suport ventilator.
Solubilitatea mare în lipide le conferă un debut rapid şi o acţiune intensă.
Depresia respiratorie, bruscă şi profundă, poate coincide cu instalarea
analgeziei. Hipotensiunea şi bradicardia, comune clasei la injectarea rapidă de
doze mari, sunt mai pronunţate pentru alfa-fentanyl. Apariţia rigidităţii
toracice, cu dificultăţi de ventilaţie, impune administrarea rapidă de relaxant
muscular.
Opioizii fac parte din „standardul de aur“
pentru anestezia generală, oferind analgezie profundă, cu stabilitate
cardiovasculară. Împreună cu un hipnotic pot asigura desfăşurarea actului
chirurgical, excluzând chiar pivotul inhalator (tehnica TIVA).
Deformarea mecanică prin tumoră sau manevră
instrumentală brutală a sinusului carotidian (situat la bifurcaţia arterei
carotide comune) poate declanşa prin baroreceptori un răspuns vagal exagerat,
cu hipotensiune, bradicardie sau chiar oprire cardiacă.
Lezarea chirurgicală a ganglionului stelat
pe partea dreaptă şi a lanţului cervical în timpul disecţiei radicale a gâtului
poate prelungi intervalul QT şi scădea pragul pentru apariţia fibrilaţiei
ventriculare. Tahiaritmii severe şi oprire cardiacă sunt citate în literatură în
acest context, în special asociate hipopotasemiei.
Administrarea promptă de vagolitic, doze
mari de opioid în menţinerea anesteziei şi infiltrarea zonelor susceptibile cu
anestezic local pot preveni acest tip de incidente, potenţial fatale. Iradierea
preoperatorie determină, în multe cazuri, un grad de stenoză carotidiană cu
consecinţe severe pe debitul cardiac, mai ales în condiţii de „hipotensiune
controlată“. De asemenea, disecţia bilaterală a gâtului poate determina atât
HTA postoperatorie, cât şi pierderea drive-ului hipoxic prin denervarea
bilaterală a sinusurilor carotidiene.
Dintre opioizi, pentru chirurgia oncologică
din ORL, cu durata lungă, se preferă fentanylul si sufentanylul, care acoperă,
prin analgezia reziduală, şi primele ore postoperator.
Naloxona
este antidotul depresiei respiratorii şi al celorlalte efecte secundare ale
narcoticelor. Efectul se realizează prin competiţie, deplasând agoniştii de pe
situsurile receptoare. Două menţiuni însoţesc noţiunea de antagonist: a) durata
de acţiune a antidotului poate fi depăşită de metabolismul lent al unor doze
mari de opioid, administrate intraoperator; depresia respiratorie poate reapărea
astfel în postoperator, necesitând administrarea repetată sau continuă a
naloxonei; b) s-au raportat cazuri de asociere între administrarea antidotului şi
apariţia edemului pulmonar acut şi a unor aritmii cardiace grave la trezire; se
impune prudenţă la pacienţii fragili, taraţi cardiac.
Blocada neuromusculară
Blocada neuromusculară are ca rol principal
facilitarea intubaţiei traheale şi creşterea, prin adiţie, a proprietăţilor
relaxante intrinseci ale anestezicelor volatile. Chirurgia oncologică din ORL
necesită un grad înalt de reversibilitate a relaxării neuromusculare
intraoperator. Devine astfel posibilă evaluarea continuă a integrităţii
structurilor nervoase esenţiale pentru sensibilitatea şi mimica feţei, care pot
suferi în cursul disecţiei laborioase.
Evaluarea efectului curarelor se realizează
continuu, utilizând stimularea electrică periferică, cu tehnica suitei de patru
stimuli.
Ventilaţia mecanică intraoperatorie se
produce ca o consecinţă a analgeziei profunde induse de dipolul opioid major –
inhalator potent şi mai puţin ca efect direct al blocanţilor musculari.
Intubaţia dificilă prezumată exclude
folosirea la inducţie a curarei cu acţiune scurtă (succinilcolină). Bradicardia
severă, hiperpotasemia, contribuţia la declanşarea hipertermiei maligne,
hipotensiunea (indusă de histamină) au erodat folosirea succinilcolinei în
practica curentă. Nu a putut fi însă îndepărtată definitiv, mai ales pentru
secvenţa rapidă de inducţie.
hipertermiei maligne,
hipotensiunea (indusă de histamină) au erodat folosirea succinilcolinei în
practica curentă. Nu a putut fi însă îndepărtată definitiv, mai ales pentru
secvenţa rapidă de inducţie.
La menţinerea anesteziei generale se preferă
curarele cu acţiune medie şi scurtă, de tip benzilizochinoline, cu metabolism
prin degradare Hoffmann, independent de funcţia hepatică. Din triada
mivacurium, atracurium şi cisatracunium, durata de acţiune de 30 de minute îl
recomandă pe ce-l de-al doilea.
Performanţa chirurgicală a echipei care
realizează ablaţia influenţează decisiv durata intervenţiei şi, implicit,
alegerea relaxantului muscular. Esenţială pare astfel comunicarea cu
specialistul ORL, care va estima timpul necesar pentru intervenţie. Pentru
operaţiile lungi (peste două ore), se preferă curarele cu acţiune medie şi lungă,
de tip steroidian, clasice: vecuroniu, rocuroniu şi rapacuroniu.
Avantajul esenţial al benzilizochinolinelor
este însă lipsa antagonizării blocadei la finalul intervenţiei. Folosirea
steroidienelor impune administrarea de antagonişti de tip neostigmină sau
edrofoniu. Ambele substanţe, săruri cuaternare de amoniu, se leagă stereochimic
de acetilcolinesterează, inhibând-o şi permiţând acetilcolinei să se acumuleze în
fanta sinaptică. Activarea receptorilor nicotinici de la nivelul plăcii motorii
de către Ach va facilita transmisia neuromusculară, iar a celor muscarinici
ganglionari va răspunde de efectele sale adverse (aritmii, bronhospasm, stop
respirator).
Particular pentru disecţia radicală a gâtului,
se citează posibilitatea apariţiei de emboli aerieni în circulaţia pulmonară,
ca urmare a necesităţii deschiderii venelor jugulare în timpul intervenţiei.
Prezenţa aerului în sânge se evidenţiază prin examen eco-Doppler precordial,
efectuat după o scădere bruscă a valorii ETCO2.
Hipotensiunea severă şi aritmiile sunt semne tardive.
Tratamentul are ca scop drenajul aerian
prin: ventilaţie mecanică cu presiune pozitivă, compresie pe vena jugulară,
poziţie Trendelenburg şi laterală stângă, oxigenarea cu FiO2:1 şi, atunci când este posibil, aspirarea
aerului printr-un cateter central.
Transfuzia
În chirurgia oncologică din ORL, pierderea
de sânge poate fi rapidă, importantă şi ameninţătoare de viaţă. Încercarea de a
o reduce substanţial poartă numele de tehnica „hipotensiunii controlate“ sau
„deliberate“.
Pacientul oncologic, uneori sever deprimat
imunitar, are indicaţii limitate de transfuzie, din cauza riscului crescut de
recurenţă a cancerului posttransfuzional. Excepţie fac anemia preoperatorie (Hb
mai mică de 8 g/dl) şi pierderea masivă de volum intraoperator (mai mare de o
treime din volumul total), ce compromit sever oxigenarea organelor vitale, prin
ischemii ireversibile. Accesul în circulaţie al produselor de sânge se
realizează prin cateterul venos central instalat preoperator.
Reologic, hematocritul va fi menţinut
relativ scăzut (25–27%), pentru a evita colmatarea cu microemboli a vascularizaţiei
lamboului. Umplerea se va realiza titrat, evitând diureticele cu efect de
hemoconcentraţie.
Hipotensiunea controlată
Reducerea
deliberată a presiunii de perfuzie sistemică scade pierderea de sânge şi îmbunătăţeşte
condiţiile vizuale din câmpul operator. Scăderea timpului total de intervenţie,
hemostaza de bună calitate şi trauma minimă asupra ţesuturilor s-ar putea datora
acestei tehnici.
Mecanismul de autoreglare circulatorie
permite prezervarea fluxului sanguin în organele vitale la valori ale TA medii
cuprinse între 50 şi 150 mm Hg, datorită scăderii rezistenţei vasculare în
paralel cu scăderea TA. Valoarea de siguranţă stabilită pentru limita inferioară
pare a fi de 65 mm Hg, chiar la vârstnici.
Aplicarea „hipotensiunii deliberate“ respectă
trei reguli: selecţia riguroasă a pacienţilor; monitorizarea atentă şi complexă
(este obligatorie prezenţa cateterului arterial pentru monitorizarea invazivă a
TA şi a gazometriei sanguine); titrarea judicioasă a hipotensoarelor.
Contraindicaţiile relative se leagă de lipsa
de experienţă sau de monitorizarea inadecvată. Cele absolute vizează unele boli
sistemice care compromit perfuzia şi/sau oxigenarea: diabetul zaharat, stenoza
coronariană sau carotidiană, boala cerebrovasculară, creşterea presiunii
intracraniene, compresia medulară, policitemia, hipovolemia, anemia severă,
ciroza hepatică decompensată.
Riscul major, care poate oricând depăşi
beneficiile, e reprezentat de perfuzia inadecvată a organelor vitale, cu
consecinţe funcţionale tranzitorii sau permanente.
La nivel cardiovascular, reducerea debitului
cardiac prin vasodilataţie sistemică scade presarcina, travaliul cardiac şi, în
consecinţă, scade MVO2 (cererea de oxigen miocardică). Fluxul
coronarian depinzând direct de presiunea de umplere diastolică, hipotensiunea
severă va determina ischemie miocardică în special la pacienţii cu boală
ischemică preexistentă.
Vasodilataţia intensă duce la scăderea
volumului sanguin circulant, impunând administrarea suplimentară de volum
pentru menţinerea optimă a presarcinii. Dacă aceasta scade, apare tahicardia
compensatorie (care creşte MVO2), mediată
baroreflex. Fluxul sanguin pulmonar se reduce, ducând la creşterea spaţiului
mort alveolar şi a valorii şuntului.
Abonează-te la Viața Medicală!
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
- Tipărit + digital – 249 de lei
- Digital – 169 lei
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
- Colegiul Medicilor Stomatologi din România – 5 ore de EMC
- Colegiul Farmaciștilor din România – 10 ore de EFC
- OBBCSSR – 7 ore de formare profesională continuă
- OAMGMAMR – 5 ore de EMC
Află mai multe informații despre oferta de abonare.
 hipertermiei maligne,
hipotensiunea (indusă de histamină) au erodat folosirea succinilcolinei în
practica curentă. Nu a putut fi însă îndepărtată definitiv, mai ales pentru
secvenţa rapidă de inducţie.
hipertermiei maligne,
hipotensiunea (indusă de histamină) au erodat folosirea succinilcolinei în
practica curentă. Nu a putut fi însă îndepărtată definitiv, mai ales pentru
secvenţa rapidă de inducţie.