
Recent inclusă în rândul bolilor digestive (descrisă ca entitate distinctă abia în anii ’90), esofagita eozinofilică (EE), afecţiune heterogenă cu fenotipuri multiple, tinde să devină una dintre cele mai frecvente patologii esofagiene.
Multiplele articole, review-uri, ghiduri din literatura ultimilor ani demonstrează că EE este o patologie de actualitate, provocatoare, cu elemente de patogeneză, metode de diagnostic și tratamente în continuă preschimbare.
Esofagita eozinofilică este considerată o afecţiune mediată imun (prin limfocite Th2), localizată la nivel esofagian, caracterizată din punct de vedere clinic prin simptome esofagiene, iar din punct de vedere histologic prin infiltrat eozinofilic, în condiţiile excluderii altor cauze locale sau sistemice. Incidenţa EE este de 1-20 de cazuri/100.000 de locuitori, în timp ce prevalenţa variază între 13 și 49 de cazuri/100.000 de locuitori (1). Frecvenţa poate ajunge la 50% dintre pacienţii care efectuează endoscopie digestivă superioară pentru impactare esofagiană de corp străin alimentar. Este mai frecventă la sexul masculin, la copii și la adulţii tineri, deși s-au descris cazuri izolate chiar la vârste înaintate (2). Boala poate avea un caracter progresiv, cu apariţia leziunilor fibrostenotice.
Principalele simptome la adult sunt disfagia, impactarea de corpi străini alimentari și durerea toracică. La copiii mici predomină simptomele de reflux gastroesofagian, vărsăturile, durerile abdominale, refuzul alimentaţiei, tulburările de creștere. Frecvent sunt asociate alte manifestări atopice: rinită, astm bronșic, eczemă sau alte boli autoimune (boală celiacă, boli inflamatorii intestinale, poliartrită reumatoidă). Alergia alimentară mediată prin IgE poate surveni în EE, dar este considerată o afecţiune distinctă.
Endoscopia digestivă superioară și examenul histopatologic sunt definitorii pentru diagnostic. Aspectul endoscopic al mucoasei poate fi normal (în 15% dintre cazuri), dar în majoritatea situaţiilor sunt prezente modificări sugestive pentru diagnosticul de EE: edem, reducerea desenului vascular, șanţuri longitudinale, inele etajate (trahealizarea esofagului), depozite albicioase, mucoasă fragilă, cu aspect creponat, stenoze esofagiene (Fig. 1) (3).
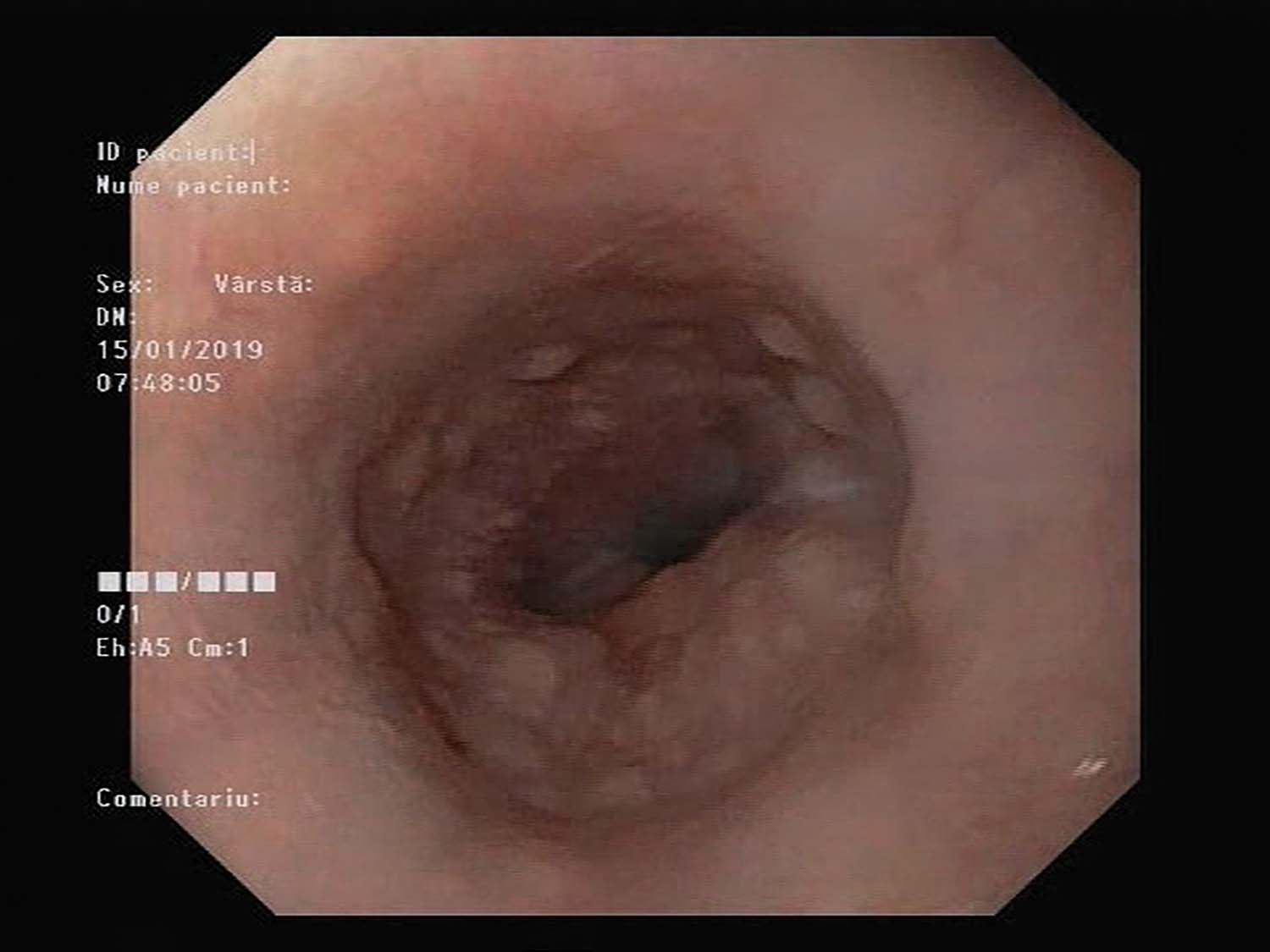
Scorul ERFES (exsudate, inele, șanţuri longitudinale, edem, stenoze) încearcă să standardizeze modificările endoscopice, dar, la fel ca în cazul simptomatologiei clinice, acestea nu se corelează cu severitatea inflamaţiei histologice (4). Noile tehnici endoscopice încearcă să crească vizibilitatea mucoasei („blue laser”, „linked colour”), dar utilizarea lor nu este încă standardizată (5).
Sunt necesare cel puţin șase biopsii prelevate din locuri diferite (esofag proximal și distal), ţintite pe modificările macroscopice ale mucoasei (exsudate albe, șanţuri longitudinale). Biopsiile suplimentare din mucoasa gastrică și duodenală ajută la excluderea gastroenteritei eozinofilice. Se utilizează coloraţie cu hematoxilin-eozină; diagnosticul de EE se consideră atunci când sunt prezente peste 15 eozinofile/HPF (high power field – 0,3 m2), cu o sensibilitate de 100% și o specificitate de 96% (Fig. 2) (6).
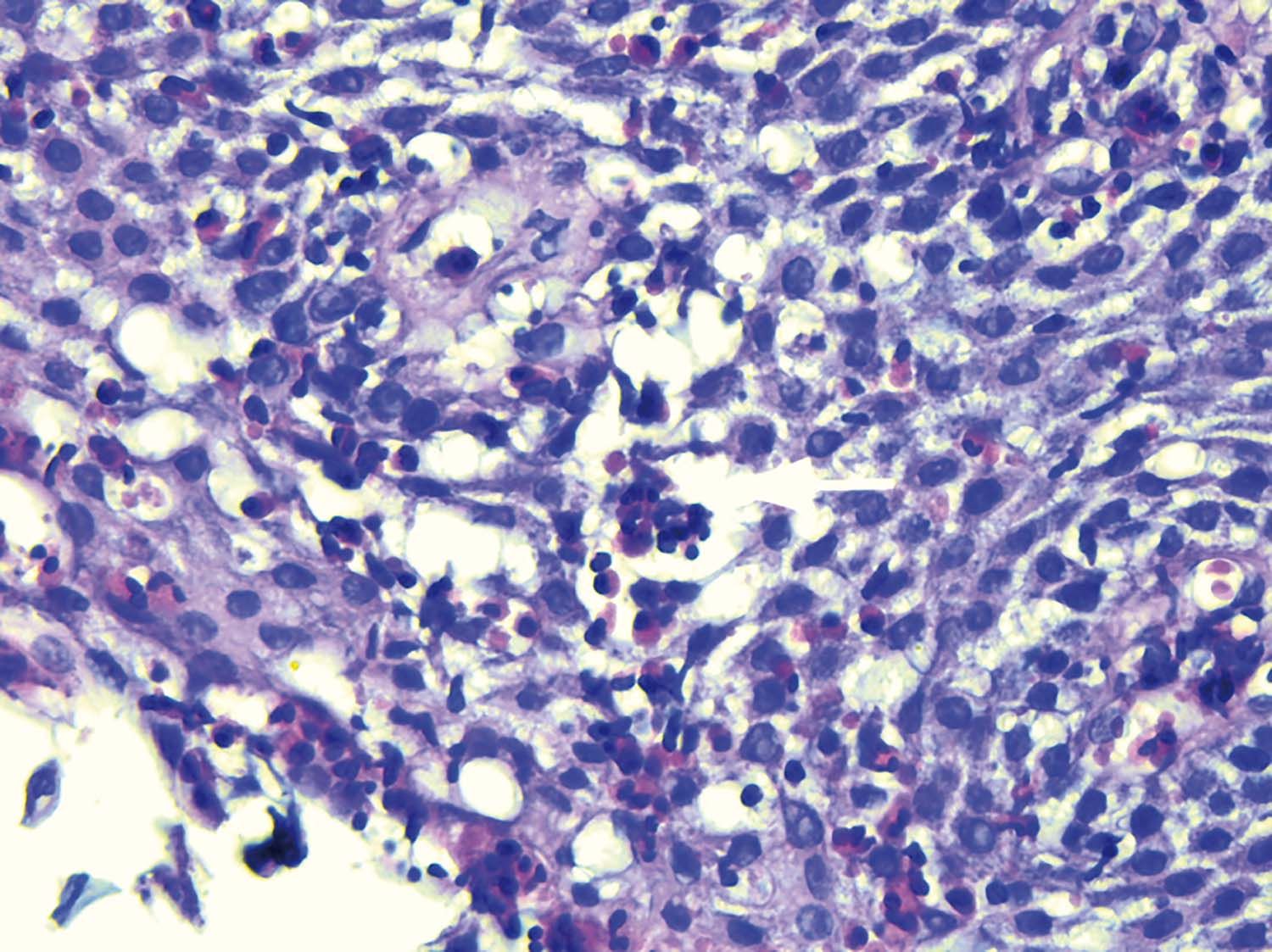
Alte modificări histologice care vin în sprijinul diagnosticului de EE sunt: microabcesele eozinofilice, hiperplazia membranei bazale, prezenţa eozinofilelor în toate straturile mucoasei, dilatarea spaţiilor intercelulare, alungirea papilelor, fibroza laminei propria (1). Există și un scor histologic specific EE (EoEHSS), care cuantifică de la 0 la 3 severitatea și extensia următoarelor modificări histologice: densitatea eozinofilelor, hiperplazia membranei bazale, abcesele eozinofilice, stratificarea eozinofilelor, dilatarea spaţiilor intercelulare, alterările epiteliului de suprafaţă, celulele epiteliale diskeratozice și fibroza laminei proprii (7).
Alte metode diagnostice utilizate obișnuit în afecţiunile esofagiene au un rol limitat în diagnosticul EE. Examenul radiologic baritat identifică stenozele și inelele; măsurarea diametrului maxim esofagian este un parametru de apreciere a răspunsului la tratament. Monitorizarea pH-impedanţă arată valori reduse ale impedanţei esofagiene, iar manometria esofagiană – modificări nespecifice la peste 1/3 dintre pacienti (8). La fel ca examenul radiologic baritat, planimetria prin impedanţă este utilă în aprecierea calibrului esofagian.
Ca în orice afecţiune în care monitorizarea presupune metode invazive (endoscopie cu biopsie) există o preocupare continuă pentru descoperirea unor biomarkeri de diagnostic și urmărire. Există multipli parametri studiaţi, de la cei simpli (numărul de eozinofile sanguine, valoarea IgE), până la proteinele eozinofilice (proteina bazică majoră, proteina cationică, neurotoxina derivată din eozinofile, peroxidaza eozinofilică), determinarea prin flow-citometrie în sângele periferic a progenitorilor sau markerilor de suprafaţă eozinofilici, tehnici de medicină nucleară (heparină marcată cu 99mTc cu afinitate pentru proteina bazică majoră eozinofilică), însă niciunul dintre aceștia nu și-a dovedit utilitatea în practica clinică (9). O alternativă promiţătoare este reprezentată de dispozitivele endoscopice minim invazive, cum ar fi „string test” sau „cytosponge” care permit prelevarea de probe ce cuantifică prezenţa eozinofilelor în mucoasă prin metode histologice și imunologice. EndoFlip reprezintă o probă funcţională intraluminală care apreciază distensibilitatea lumenului și prezice riscul impactării de corpi străini alimentari, fără a se corela însă cu infiltrarea eozinofilică a mucoasei (10).
Nu există corelaţii între simptomatologia clinică și activitatea endoscopică, astfel încât endoscopia cu biopsie rămâne principalul instrument de monitorizare și evaluare a răspunsului la tratament. O serie de chestionare privind calitatea vieţii și modificarea comportamentului alimentar pot constitui instrumente adjuvante: indexul de activitate al EE raportat de pacient (EEsAI PRO), chestionarul privind disfagia la adult, IMPACT etc.
Scopurile terapiei sunt: remiterea simptomatologiei, ameliorarea inflamaţiei esofagiene, menţinerea remisiunii, prevenirea fibrozei și stricturilor. Inhibitorii pompei de protoni (IPP), corticoizii topici, dietele de excludere și dilatarea endoscopică a stenozelor sunt principalele arme din arsenalul terapeutic clasic al EE.
Dietele de eliminare pe baza testării alergenului alimentar produc remisiune histologică la aproximativ o treime dintre pacienţi, mai frecvent la copii comparativ cu adulţii. Totuși, ghidurile actuale nu recomandă eliminarea unor alimente pe baza testelor cutanate sau a determinării de IgE specifice (1). Dieta elementală – formule de aminoacizi – este dificil de administrat, se asociază cu o complianţă redusă și consecinţe cu negative psiho-sociale; ea va fi folosită doar în caz de eșec al dietelor de excludere sau a terapiei medicamentoase. Cele mai bune rezultate au fost raportate cu dietele empirice în care se exclud 2, 4 sau 6 alimente cunoscute a avea potenţial alergen (proteinele din lapte de vacă, ouă, grâu, soia, alune, pește, fructe de mare, legume). În cazul obţinerii remisiunii, dietele de excludere vor fi menţinute pe termen lung.
În ghidurile mai vechi, răspunsul clinic și histologic la tratamentul cu IPP definea o entitate numită EE responsivă la IPP, considerată aparţinând bolii de reflux gastroesofagian (BRGE). În prezent, această entitate responsivă la IPP se consideră a fi o formă de EE la care triggerul inflamator ar putea fi refluxul gastroesofagian. Argumente în acest sens sunt studiile genetice care au identificat o modificare comună în EE și EE responsivă la IPP, modificare care nu se regăsește la pacienţii cu BRGE (11).
BRGE poate coexista cu EE; cele două afecţiuni pot fi independente sau într-o relaţie bidirecţională (refluxul gastroesofagian produce alterarea integrităţii mucoasei esofagiene, cu creșterea permeaţiei pentru antigene și declanșarea mecanismului imun; la rândul său, EE determină modificări mucosale, cu apariţia hipersenzitivităţii la acid și simptome de BRGE (12).
IPP sunt consideraţi prima linie de terapie în EE. O metaanaliză efectuată pe 619 pacienţi cu EE a arătat îmbunătăţirea simptomatologiei clinice la 60,8% dintre pacienţi și remisiune histologică în 50,5% dintre cazurile tratate cu IPP (13). Doza uzuală este de 20-40 mg/zi, preferabil fracţionată, fără a se înregistra diferenţe în funcţie de tipul de IPP folosit. În cazul pacienţilor responsivi se recomandă tratament de menţinere cu doze scăzute de IPP (întreruperea terapiei duce la recurenţa simptomelor în 3-6 luni).
Corticosteroizii (CS) topici sunt utili în inducerea remisiunii histologice atât la copiii, cât și la adulţii cu EE. Datele privind îmbunătăţirea simptomatologiei clinice sunt contradictorii. Tratamentul nu este standardizat. Se administrează fluticasone propionat (1.760 mcg/zi la adult) sau budesonid (2-4 mg/zi), sub diferite forme de administrare (pufuri ingerate, suspensie, soluţie orală vâscoasă, tablete orodispersabile) cu o durată de 2-12 săptămâni. La pacienţii care răspund se continuă terapia de menţinere cu doze înjumătăţite, pe o perioadă de timp nedeterminată. Nu s-au raportat efecte secundare notabile, cu excepţia esofagitei candidozice la 10% dintre pacienţi. Totuși, copiii necesită monitorizare atentă, dat fiind riscul de insuficienţă adrenală și tulburările de creștere. Nu sunt recomandaţi CS cu administrare sistemică. Ciclesonidul, un corticoid topic transformat pulmonar într-un metabolit activ, pare a fi o alternativă promiţătoare de viitor (14).
Tratamentul endoscopic (dilatarea) este indicat în trei situaţii: stenoze esofagiene și disfagie, disfagie fără identificarea endoscopică a stenozei (dar cu diminuarea calibrului esofagian, documentată prin examen radiologic baritat sau planimetrie prin impedanţă) și stenoză esofagiană cu diametrul sub 10 mm fără disfagie (acest lucru apare ca urmare a schimbării comportamentului alimentar – evitare alimente solide, mestecare prelungită, consum de lichide etc.) (15).
Se utilizează atât dilatare cu balon, cât și cu sonde Savary, în funcţie de lungimea stenozei. Dilatarea endoscopică este o procedură sigură și eficientă: ameliorarea disfagiei la 3/4 din pacienţi, risc de perforaţie sub 1%.
Noi terapii în EE. O multitudine de agenţi terapeutici au fost testaţi experimental sau în trialuri randomizate la pacienţi cu EE. Azatioprina și 6-mercaptopurina pot fi folosiţi ca terapie de inducţie și menţinere la pacienţii corticodependenţi. În schimb, substanţe ca antihistaminicele, cromoglicatul disodic, anti-TNF (infliximab), antagoniștii de receptori ai leucotrienelor (montelukast), antagoniștii de substanţe chemotactice ale moleculei omologe receptorului exprimat pe celulele Th2, anticorpi anti-IL5 (mepolizumab, reslizumab), anticorpi anti-IL13, anticorpi anti-IgE (Omalizumab), antagoniști de receptor IL-4 (dupilumab), anti-integrine (Vedolizumab), anti-TGFB1 (Fresulimab) nu au acumulat suficiente evidenţe pentru a putea fi recomandate în practica clinică curentă (15,16).
Terapiile biologice au avantajul eficienţei și în patologiile imune sau atopice asociate; în plus, prin analogie cu bolile inflamatorii intestinale, vindecarea inflamaţiei mucosale ar putea preveni dezvoltarea fenomenelor fibrotice și stenotice.
EE este o boală frecventă, ce afectează în special copiii și adulţii tineri. Diagnosticul, sugerat de simptome ca disfagia, impactarea de corpi străini, durerea toracică, mai ales în asociere cu alte afecţiuni atopice, este precizat prin endoscopie cu biopsie (cel puţin 6 biopsii, eozinofile peste 15/câmp).
Terapia presupune IPP (peste 1/3 dintre pacienţi răspund la IPP!), corticosteroizi topici, modificări dietetice și tratament endoscopic în cazul stenozelor. Cercetările prezente sunt centrate pe înţelegerea mecanismelor fiziopatologice complexe, descoperirea de biomarkeri și modalităţi non-invazive de diagnostic și monitorizare, precum și pe identificarea unor noi terapii, capabile să amelioreze simptomele și activitatea histologică, să prevină evoluţia progresivă, fibrozantă și, nu în ultimul rând, să amelioreze calitatea vieţii pacienţilor cu EE.
Articol publicat în volumul „Gastroenterologie 2020: Metode moderne de diagnostic și tratament”, editat de Viaţa Medicală
Dacă vrei să fii la curent cu tot ce se întâmplă în lumea medicală, abonează-te la „Viața Medicală”, publicația profesională, socială și culturală a profesioniștilor în Sănătate din România!
Titularii abonamentelor pe 12 luni sunt creditați astfel de:
Cookie-urile ne ajută să vă îmbunătățim experiența pe site-ul nostru. Prin continuarea navigării pe site-ul www.viata-medicala.ro, veți accepta implicit folosirea de cookie-uri pe parcursul vizitei dumneavoastră.
Da, sunt de acord Aflați mai multe